| 比较硫、碳、硅的非金属性由强到弱的顺序,请从下列给出的试剂中选择合 | 您所在的位置:网站首页 › c和si的非金属性比较 › 比较硫、碳、硅的非金属性由强到弱的顺序,请从下列给出的试剂中选择合 |
比较硫、碳、硅的非金属性由强到弱的顺序,请从下列给出的试剂中选择合
|
比较硫、碳、硅的非金属性由强到弱的顺序,请从下
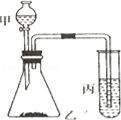
(1)请根据它们的原子结构特点试推断:硫、碳、硅的非金属性由强到弱的顺序为 (2)甲仪器中盛 ,乙仪器中盛 ,丙仪器中盛 . (3)乙仪器中的现象是 丙仪器中的现象是 . (4)结论:三种元素最高价含氧酸的酸性从强到弱的顺序 .(填化学式)[来源:学科网ZXXK] 答案 (1)硫>碳>硅; (2)稀硫酸;Na2CO3粉末;Na2SiO3溶液; (3)产生无色的气体;有白色胶状沉淀产生; (4)H2SO4>H2CO3>H2SiO3. 【解析】 试题分析:比较碳、硅、硫的非金属性强弱,可根据对应的最高价氧化物的水化物的酸性强弱 解:(1)根据原子结构特点:最外层电子数越多,元素的非金属性越强,最外层电子数一样,半径越小,非金属性越强,故硫、碳、硅的非金属性由强到弱的顺序为硫>碳>硅,故答案为:硫>碳>硅; (2)甲盛装液体,应为稀硫酸,甲乙反应用来制备二氧化碳,则乙中应为Na2CO3粉末,注意不能用大理石,因硫酸与大理石反应生成硫酸钙微溶于水,阻碍反应继续进行,丙中盛Na2SiO3溶液,如溶液变浑浊,可说明非金属性C>Si,故答案为:稀硫酸;Na2CO3粉末;Na2SiO3溶液; (3)硫酸和碳酸钠反应生成二氧化碳和水,反应的离子方程式为CO32﹣+2H+=CO2↑+H2O,现象是产生无色的气体,生成的二氧化碳通入丙中,和硅酸钠反应生成硅酸沉淀,可观察到丙中有白色胶状沉淀产生, 故答案为:产生无色的气体;有白色胶状沉淀产生; (4)元素的非金属性越强,对应的最高价氧化物的水化物的酸性越强,由实验可知碳、硅、硫的非金属性由强到弱的顺序为S>C>Si,最高价含氧酸的酸性从强到弱的顺序:H2SO4>H2CO3>H2SiO3;故答案为:H2SO4>H2CO3>H2SiO3. |
【本文地址】