| CYP3A4酶抑制剂的药物学价值 | 您所在的位置:网站首页 › cyp3a抑制剂食物 › CYP3A4酶抑制剂的药物学价值 |
CYP3A4酶抑制剂的药物学价值
|
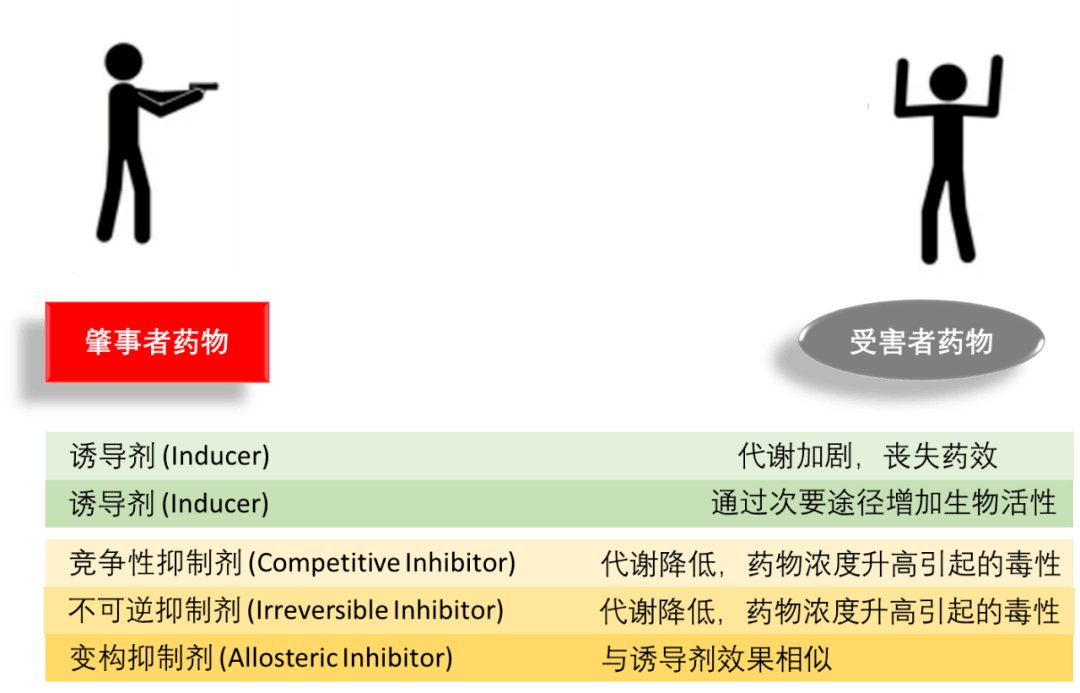
图1. 常见的CYP3A4药物底物。 由于肠道和肝脏代谢的首过效应,一些作为 CYP3A4 底物的药物口服(但不是静脉内)生物利用度低。这些底物的生物利用度会因 CYP3A4 的抑制、诱导或饱和而显著改变。CYP3A4的底物包括对乙酰氨基酚(扑热息痛paracetamol)、可待因(codeine)、环孢菌素(cyclosporin)、地西泮(diazepam)和红霉素(erythromycin)(图1)。CYP3A4还代谢一些类固醇和致癌物。很多药物都会直接被CYP3A4失活。 需要注意的是,虽然许多药物会被CYP3A4灭活,但也有一些药物会被该酶激活。一些化合物,例如某些药物和葡萄柚汁中存在的呋喃香豆素(furanocoumarins),会干扰CYP3A4的作用。因此,这些物质可以增强或削弱那些被CYP3A4影响的药物作用。CYP3A4活性即可被诱导(加强),也可以被抑制,诱导和抑制过程,都会改变体内存在的药物浓度及其药代动力学特征。许多物质被CYP3A4生物激活以形成其活性化合物,许多原毒素被毒化成有毒形式。CYPA34药物底物总结见表1。 表1. CYP3A4药物底物 CYP3A4药物底 物[8] 一些免疫抑制剂:环孢菌素、他克莫司、西罗莫司 许多化疗药物:多西紫杉醇、他莫昔芬、紫杉醇、环磷酰胺、阿霉素、厄洛替尼、依托泊甙、异环磷酰胺、替尼泊甙、长春碱、长春新碱、长春地辛、伊马替尼、伊立替康、索拉非尼、舒尼替尼、维罗非尼、替西罗莫司、阿那曲唑、吉非替尼 唑类抗真菌药:酮康唑、伊曲康唑、 大环内酯类:克拉霉素、红霉素、泰利霉素、 氨苯砜 三环类抗抑郁药:阿米替林、氯米帕明、丙咪嗪、环苯扎林 SSRIs:西酞普兰、去甲氟西汀、舍曲林 其他一些抗抑郁药:米氮平、奈法唑酮、瑞波西汀、文拉法辛、曲唑酮、维拉佐酮 丁螺环酮(抗焦虑药) 抗精神病药:氟哌啶醇、阿立哌唑、利培酮、齐拉西酮、匹莫齐特、喹硫平、鲁拉西酮 阿片类药物(主要是镇痛药):阿芬太尼、丁丙诺啡、可待因、芬太尼、氢可酮、美沙酮、左乙酰美沙多、曲马多 苯二氮卓类:阿普唑仑、咪达唑仑、三唑仑、地西泮、氯硝西 一些催眠药:佐匹克隆、扎来普隆、唑吡坦 多奈哌齐(乙酰胆碱酯酶抑制剂) 他汀类药物:阿托伐他汀、洛伐他汀、辛伐他汀、西立伐他汀 钙通道阻滞剂:地尔硫卓、非洛地、硝苯地、维拉帕米、氨氯地、乐卡地平、尼群地平、尼索地平 胺碘酮(III 类抗心律失常药) 决奈达隆(III 类抗心律失常药) 奎尼丁(I 类抗心律失常药) PDE5抑制剂:西地那非、他达拉非 激肽(血管扩张剂、平滑肌收缩剂) 性激素激动剂和拮抗剂:非那雄胺、雌二醇、黄体酮、炔雌醇、睾酮、托瑞米芬、比卡鲁胺 H1受体拮抗剂:特非那定、阿司咪唑、扑尔敏 蛋白酶抑制剂:茚地那韦、利托那韦、沙奎那韦、奈非那韦 非核苷逆转录酶抑制剂:奈韦拉平 一些糖皮质激素:布地奈德、氢化可的松、地塞米松、氟替卡松 阿苯达唑(驱虫药)、西沙必利(5-HT4 受体激动剂)、阿瑞吡坦(止吐药)、咖啡因(兴奋剂)、可卡因(兴奋剂)、西洛他唑(磷酸二酯酶抑制剂)、右美沙芬(镇咳药)、多潘立酮(抗多巴胺能)、依普利酮(醛固酮拮抗剂)、利多卡因(局部麻醉剂,抗心律失常药)、昂丹司琼(5-HT3 拮抗剂)、普萘洛尔(β受体阻滞剂)、沙美特罗(β激动剂)、华法林(抗凝剂)、氯吡格雷,被生物激活(抗血小板)、2-氧代氯吡格雷、奥美拉唑(质子泵抑制剂)、那格列奈(抗糖尿病药)、甲氧丙胺、孟鲁司特(白三烯受体拮抗剂)、vilaprisan(选择性黄体酮受体调节剂)、血管紧张素 II 受体阻滞剂、氯沙坦(敏感底物) 3 CYP3A4对于疾病的影响 在疾病状态下,CYP3A4介导的药物代谢的固有变异性可能会因许多因素而加剧,包括肝脏血液动力学、肝细胞功能、营养、循环激素以及药物相互作用的改变 。[2,3] 人们也越来越认识到,与一系列疾病状态相关的炎症介质能够对 CYP3A4基因表达产生深远影响 。[2] 患有炎症的患者,尤其是急性期蛋白升高的患者,例如C反应蛋白(CRP),已在他们的身上观察到CYP3A4功能降低。[2] 这种发现在癌症患者中具有临床意义,因为肿瘤可能是全身循环细胞因子(cytokines)的来源 。[3] 急性全身性缺氧(例如,慢性呼吸或心功能不全)似乎会上调 CYP3A4活性。[9] 4 CYP3A4抑制剂药物的发展 1 CYP3A4抑制剂在药物-药物作用中的影响 尽管CYP3A4诱导剂也是药物发展的一个领域,但涉及CYP3A4药物的开发却绝大多数集中在它的抑制剂上。CYP3A4抑制剂的研究,显然是药物-药物相互作用(DDI, Drug-drug interactions)领域内的一个重要课题。药物-药物相互作用很重要,因此是向患者推进新化学实体(NCE, new chemical entity)药物的主要问题。一项研究发现,与药物有关的死亡占医院环境中所有死亡人数的 7%。[10] 在这方面,药物相互作用是一个重要问题。尽管涉及一些药效学问题,但很大一部分药物相互作用本质上是药代动力学的。 药物转化为产物,通常称为代谢物。相对于母体药物分子,代谢物的药理活性可能未改变,也可能失去部分或全部药理活性,甚至更具活性或有毒。在两种药物的相互作用中,一种有时被称为“肇事者”,另一种被称为“受害者”(图 2)。竞争性抑制剂和不可逆的抑制剂会减弱药物代谢,从而产生特定的影响。
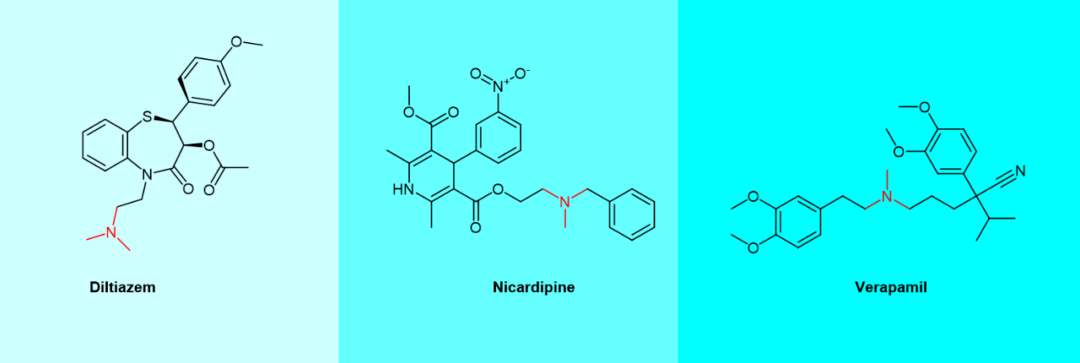
图2. 肇事者药物与受害者药物之间的药物-药物相互作用。 了解CYP酶诱导的药物-药物作用,对于增加药物安全性来说非常重要。不利的药物-药物作用应该进行充分调查并避免。但这篇文章中,我们更关注的是通过抑制CYP3A4来实现某些治疗目的的手段,即将治疗剂的角色赋予CYP3A4抑制剂。 2 CYP3A4抑制剂种类 酶抑制剂主要有两类:可逆和不可逆抑制剂。可逆酶抑制剂可分为竞争性、非竞争性或混合抑制剂。将可逆酶抑制剂药物分为这三组取决于这些抑制剂与酶结合的位点,以及它相对于底物的结合顺序。竞争性抑制剂与底物竞争酶的活性位点;非竞争性抑制剂在另一个位点而不是活性位点与酶结合,不与天然底物竞争活性位点;在混合抑制的情况下,抑制剂和底物可以同时结合到酶的活性位点。 许多药物正是基于CYP3A4 抑制剂的机制发挥其药理学作用的。其中不可逆 CYP3A4 抑制剂药物及其相关机制,对于合理使用治疗药物非常重要。[11] 基于机制的 CYP3A4 抑制可以降低药物在肝脏和肠道中的首过清除率,从而极大地改变药代动力学行为。 迄今为止,已确定的具有临床重要作用机制的CYP3A4抑制剂主要包括: 大环内酯类抗生素(如克拉霉素clarithromycin、红霉素erythromycin等) 抗HIV药物(如利托那韦ritonavir、地拉韦定delavirdine) 抗抑郁药(如氟西汀fluoxetine、氟伏沙明fluvoxamine) 钙通道阻滞剂(如维拉帕米verapamil和地尔硫卓diltiazem等) 类固醇及其调节剂(例如孕二烯酮gestodene和米非司酮mifepristone) 大环内酯类抗生素(如克拉霉素clarithromycin、红霉素erythromycin等) 抗HIV药物(如利托那韦ritonavir、地拉韦定delavirdine) 抗抑郁药(如氟西汀fluoxetine、氟伏沙明fluvoxamine) 钙通道阻滞剂(如维拉帕米verapamil和地尔硫卓diltiazem等) 类固醇及其调节剂(例如孕二烯酮gestodene和米非司酮mifepristone) 大量含乙炔基的化合物,特别是孕二烯酮gestodene、炔诺酮norethisterone、炔雌醇ethinyl estradiol和炔诺孕酮norgestrel等合成类固醇(图3),会导CYP 失活。[12] 大多数使CYP失活致的炔烃是端基乙炔。 图3. 炔基类固醇CYP3A4抑制剂化学结构。 三种格列酮:曲格列酮troglitazone、罗格列酮rosiglitazone和吡格列酮pioglitazone,也是 CYP3A4 抑制剂。在分子结构上,三种格列酮都具有 2,4-噻唑烷二酮结构单元(图4)。 图4. 格列酮类CYP3A4抑制剂化学结构。 3 CYP3A4抑制剂作用机理 很多CYP3A4 抑制剂的作用机理在于他们与CYP3A4之间的不可逆作用,形成活性代谢中间体(MI, metabolic intermediates)。有些活性MI的产生机理已经研究清除,例如地尔硫卓(diltiazem)、尼卡地平(nicardipine)和维拉帕米(verapamil)。他们都是钙通道阻滞剂,都含有叔胺官能团。这些叔胺可以与CYP3A4受体上的活性结合点,通过N-脱烷基化作用,从而形成活性代谢中间体。[13]
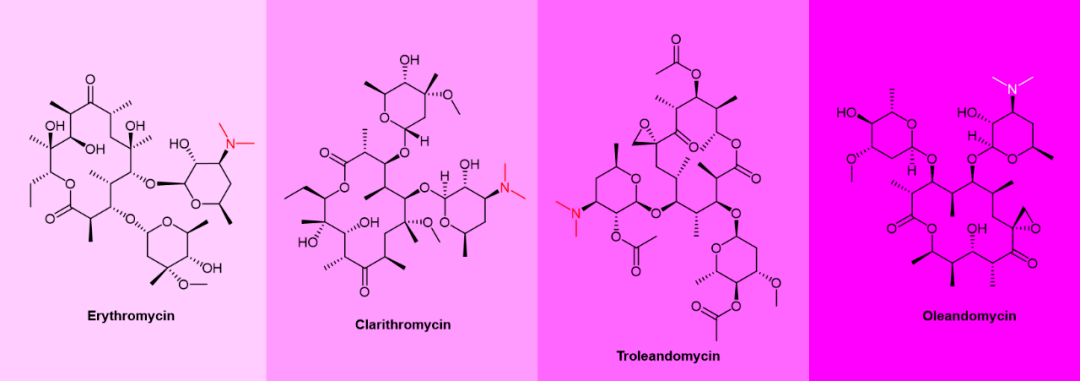
图5. 含叔胺基团的钙通道阻滞剂化学结构。 具有14元环的红霉素(erythromycin)、克拉霉素(clarithromycin)、醋竹桃霉素(troleandomycin)和竹桃霉素(oleandomycin)等大环内酯类药物(图6)可被CYP3A4代谢,通过N-去甲基化形成反应性亚硝基化合物,与CYP相互作用产生MI复合物。[14]
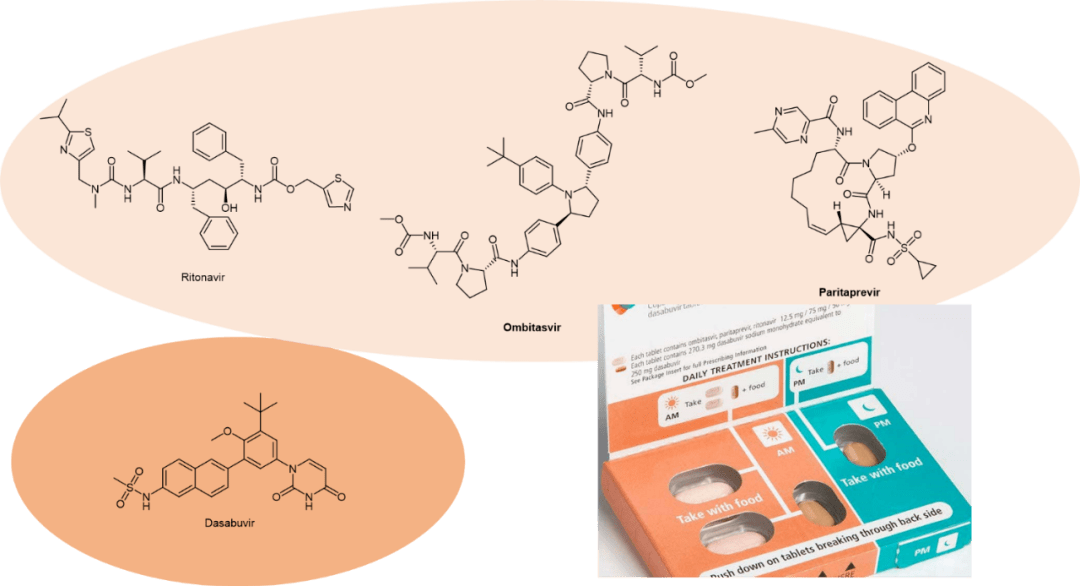
图6. 含N,N-二甲基结构的大环内酯类药物化学结构。 然而,对于大多数已知的 CYP3A4 抑制剂,它们的活性 MI、生物活化和灭活途径,在很大程度上是未知的。CYP3A4 介导的几种蛋白酶抑制剂的代谢会产生未知的反应性代谢物,然后使 CYP3A4 失活。 5 CYP3A4抑制剂药物 1 Ritonavir 图7. Ritonavir化学结构。 Ritonavir(图7)是一种 HIV 蛋白酶抑制剂。虽然它最初是作为一种独立的抗病毒药物开发的,但现在更常用作其他蛋白酶抑制剂的增强剂,例如Paxlovid中作为nirmatrelvir的增强剂。又如,ritonavir不是针对丙型肝炎病毒(HCV) 感染的活性抗病毒剂,但它被添加到联合疗法中作为增强剂用于治疗HCV感染。 Ritonavir是肠道和肝脏中的CYP3A4的有效抑制剂。它是一种II型配体,完全适合CYP3A4活性位点空腔,并通过分子结构中噻唑环上的氮原子不可逆地与血红素铁结合,从而降低蛋白质的氧化还原电位,并阻止其被它的氧化还原伙伴细胞色素P450还原酶(cytochrome P450 reductase)的还原 。[15] 简单地说,ritonavir以一己之力破坏了CYP3A4的氧化能力,因此阻止了它对于其它抗病毒蛋白酶抑制剂药物的氧化代谢。除了抑制CYP3A4这种机理之外,ritonavir还可能通过P-糖蛋白和MRP外排通道限制细胞转运和其他蛋白酶抑制剂的外排发挥作用。[16] 因此Ritonavir可增加其他蛋白酶抑制剂(如Paritaprevir)的血浆药物峰浓度和谷浓度,以及总体药物暴露量。 美国肝病研究协会(AASLD) 和美国传染病学会(IDSA) 指南推荐ritonavir增强联合疗法作为肝硬化基因1a/b型 HCV患者的一线疗法。 Ritonavir与Ombitasvir、Dasabuvir和Paritaprevir 一起存在于固定剂量组合(FDC, fix-dose combination)产品Viekira Pak(图8)。Viekira Pak于2014 年12月首次获得批准,适用于治疗无肝硬化或有代偿期肝硬化的基因1b型HCV,与利巴韦林(Ribavirin)联合用于治疗无肝硬化或有代偿期肝硬化的基因1a型 HCV。
图8. Viekira Pak ® 活性成分化学结构。 2 Cobicistat
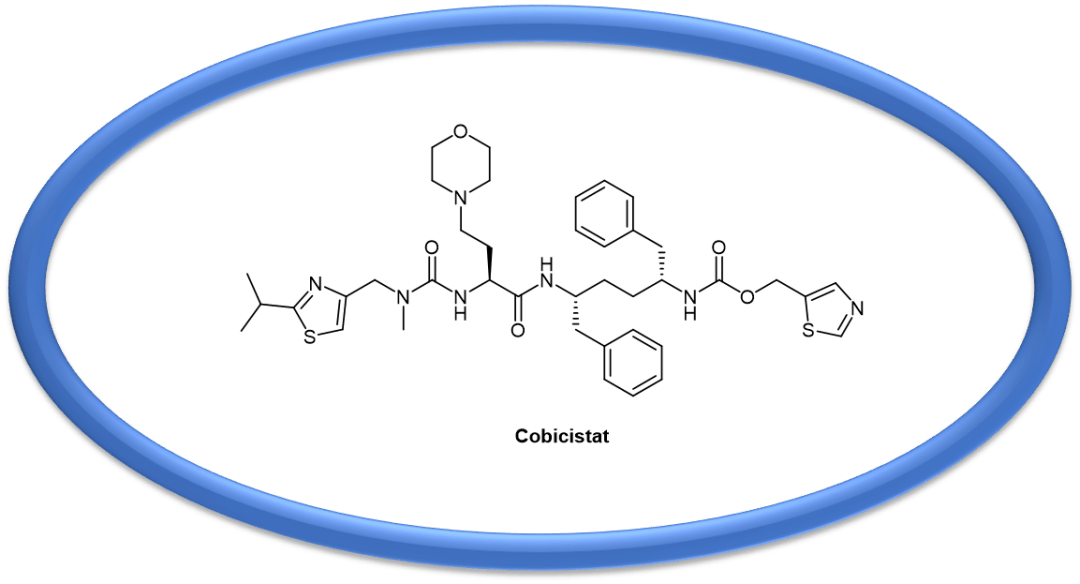
Cobicistat是一种CYP3A抑制剂,用于增加atazanavir或darunavir与其他抗逆转录病毒药物联合治疗HIV-1感染时的全身暴露。
Cobicistat以商品名Tybost ® 销售,适用于治疗HIV 感染。虽然它没有任何抗 HIV 活性,但cobicistat通过抑制CYP3A充当药代动力学增强剂,因此增加了共同给药的药物的全身暴露。Cobicistat用于增加阿扎那韦 (atazanavir)或地瑞那韦(darunavir)(每日一次给药方案)与其他抗逆转录病毒药物(ARVs, anti-retrovirals)联合治疗 HIV-1 感染的全身暴露。在不增加剂量的情况下增加抗逆转录病毒药物(ARV)的全身暴露量,可实现更好的治疗效果并减少副作用。 — 总结 — 广泛的底物选择性使CYP3A4易受各种药物可逆或不可逆(基于机制)抑制。当某些治疗药物被CYP酶转化为能够与CYP3A4蛋白或血红素部分共价结合的反应性代谢物时,由于酶失活或络合,会发生不可逆的CYP3A4抑制。许多治疗药物已被确定为基于机制的CYP3A4抑制剂。 因此在药物研发中,涉及CYP影响的药物-药物作用(DDI)一直都是受到高度关注的研究内容。然而Paxlovid的问世却有一些反其道而行之的意味,刻意去寻求CYP3A4的抑制,这种策略可以算得上是一步险棋,稍有疏忽就有可能踏入DDI的雷区。 因此有目的地抑制CYP3A4的战略,多发生在抗HIV病毒这样的艰巨挑战中。而如今对抗Covid-19危局中,ritonavir与nirmatrelvir的联合治疗,也算得上非常情况下的险中求胜。人们还需要进行更多的药物警戒(PV, Pharmacovigilance,亦称药物安全监视)研究和数据获取,以加深了解CYP3A4抑制剂有可能造成的药物不良反应(ADR,Adverse Drug Reactions)。 然而随着人们在这个领域研究的不断加深,趋利避害地利用CYP3A4抑制(甚至是活化),将会为药物的开发开辟出一片新的广阔天地。 参考文献:(上下滑动查看更多) [1] (a) Rendic S, Ci Carlo FJ. Human cytochrome P450 enzymes: a status report summarizing their reactions, substrates, inducers, and inhibitors. Drug Metab Rev 1997;29:413-580. [2] United States Food and Drug Administration. Guidance for Industry. Drug Interaction Studies - Study Design, Data Analysis, and Implications for Dosing and Labeling. September 2006. Clinical Pharmacology. [3] Ohno Y, Hisaka A, Suzuki H. General framework for the quantitative prediction of CYP3A4-mediated oral drug interactions based on the AUC increase by coadministration of standard drugs. Clin Pharmacokinet 2007;46:681-96. [4] Rendic S, Ci Carlo FJ. Human cytochrome P450 enzymes: a status report summarizing their reactions, substrates, inducers, and inhibitors. Drug Metab Rev 1997;29:413-580. [5] Ince I, Knibbe CA, Danhof M, et al. 2013. Developmental changes in the expression and function of cytochrome P450 3A isoforms: evidence from in vitro and in vivo investigations. Clinical Pharmacokinetics 52: 333–345. [6] Harayama S, Kok M, Neidle EL. Functional and evolutionary relationships among diverse oxygenases. Annu. Rev. Microbiol. 1992, 46: 565–601. [7] EntrezGene 1576. [8] Wikipedia, CYP3A4. [9] du Souich P, Fradette C. 2011. The effect and clinical consequences of hypoxia on cytochrome P450, membrane carrier proteins activity and expression. Expert Opinion on Drug Metabolism and Toxicology 7: 1083–1100. [10] Montané, E., Arellano, A. L., Sanz, Y., Roca, J. and Farre, M. (2018) Drug-related deaths in hospital inpatients: a retrospective cohort study. Br. J. Clin. Pharmacol. 84, 542-552. [11] Watanabe, A.; Nakamura, K.; Okudaira, N.; Okazaki, O. and Sudo, K. I. (2007) Drug Metab. Dispos., 35(7), 1232-1238. [12] Guengerich, F. P. (1990) Chem. Res. Toxicol., 3(4), 363-371. [13] Bensoussan, C.; Delaforge, M. and Mansuy, D. (1995) Biochem. Pharmacol., 49(5), 591-602. [14] Periti, P.; Mazzei, T.; Mini, E. and Novelli, A. (1992) Clin. Pharmacokinet., 23(2), 106-131. [15] Sevrioukova IF, Poulos TL: Structure and mechanism of the complex between cytochrome P4503A4 and ritonavir. Proc Natl Acad Sci U S A. 2010 Oct 26;107(43):18422-7. [16] Hull MW, Montaner JS: Ritonavir-boosted protease inhibitors in HIV therapy. Ann Med. 2011 Aug;43(5):375-88. 更多优质内容,欢迎关注 ↓↓ ↓返回搜狐,查看更多 |
【本文地址】