| 干货:反义lncRNA分子模型及实验方法 | 您所在的位置:网站首页 › cerna实验 › 干货:反义lncRNA分子模型及实验方法 |
干货:反义lncRNA分子模型及实验方法
|
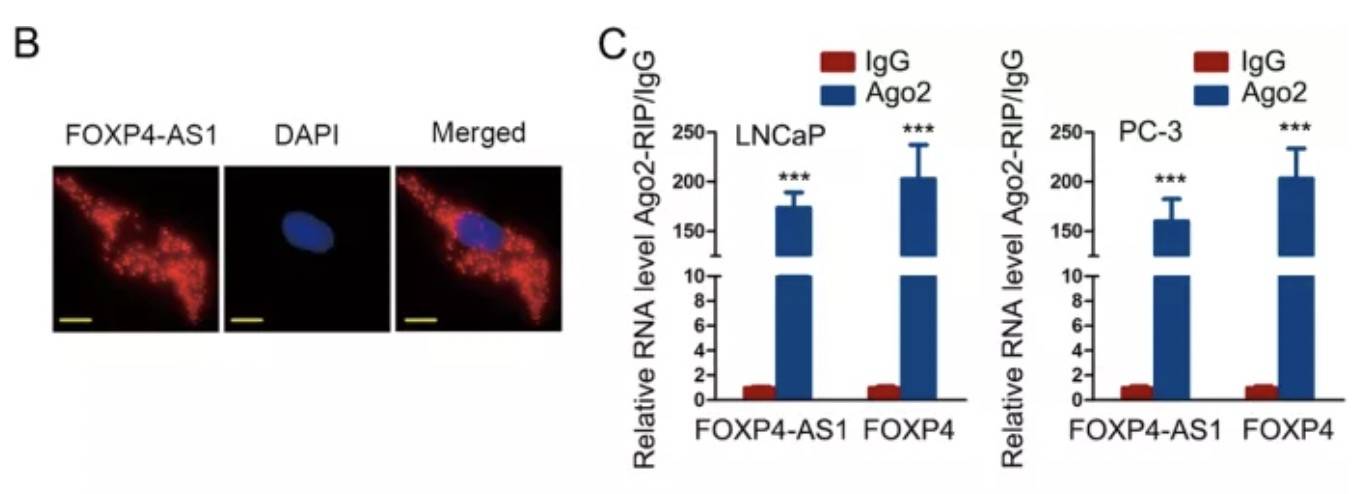
为了研究FOXP4-AS1在PCa中的调控模式,通过FISH实验确认了FOXP4-AS1主要位于细胞质,因此,FOXP4-AS1应该是转录后调控。ceRNA是lncRNA的常见转录后调控模式, FOXP4-AS1是否具有miRNA结合能力呢?接下来,进行Ago2-RIP分析(Ago2是miRNA结合蛋白,Ago2能沉淀下lncRNA,说明miRNA可以与lncRNA结合),发现FOXP4-AS1与FOXP4均有miRNA结合潜力:
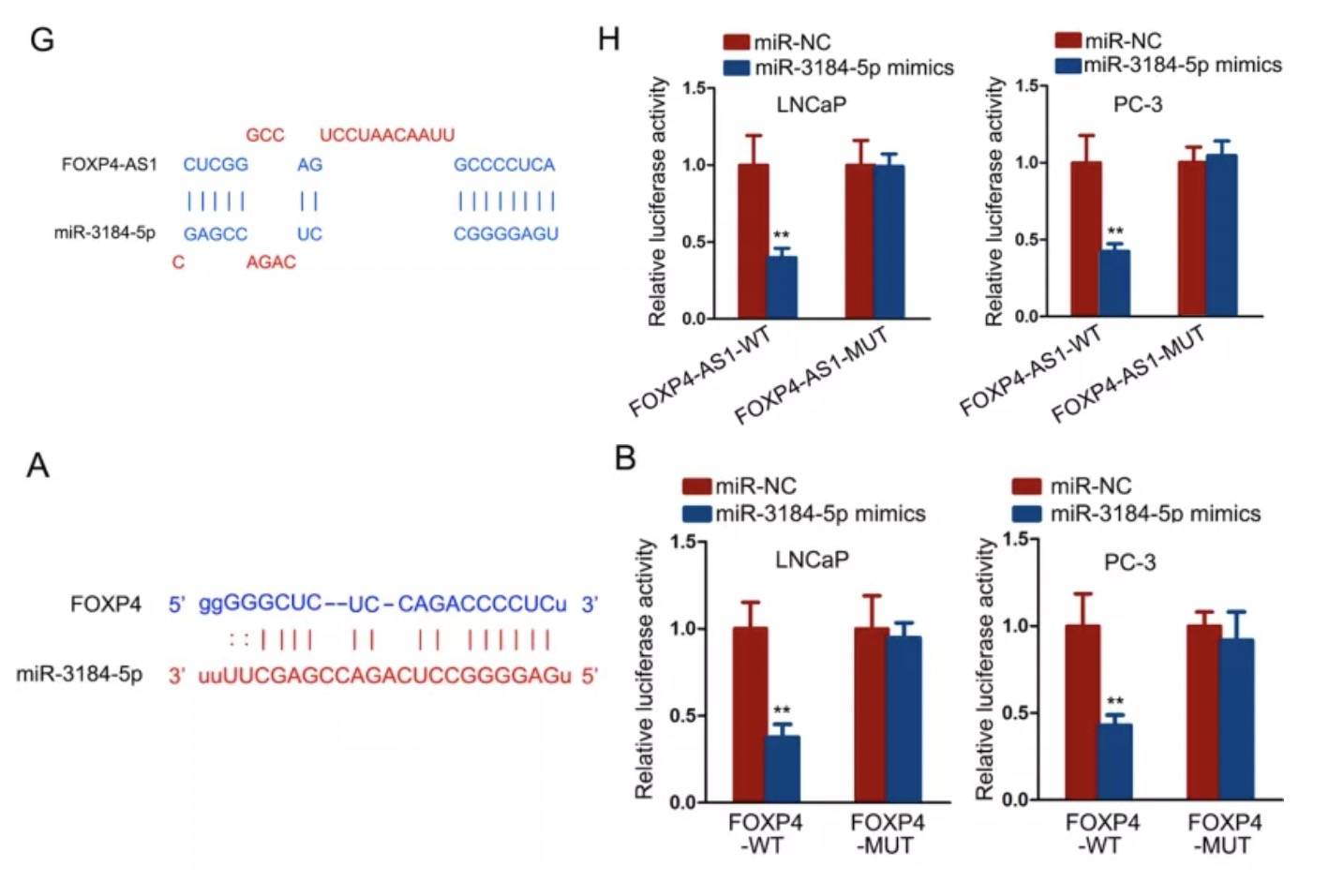
进一步运用starbase数据库,筛选出五个可能与FOXP4-AS1和FOXP4结合的miRNA,并通过双荧光素酶实验证明了miR-3184-5p与两者的结合:
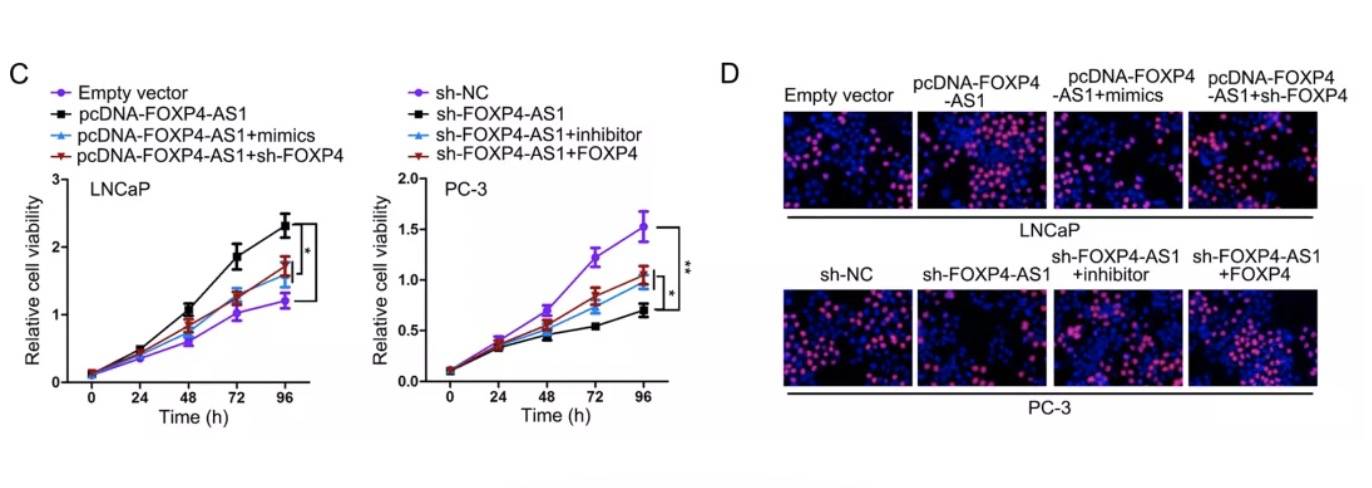
在两个PCa细胞中进行了拯救试验(是为了说明三者存在竞争结合)。细胞增殖测定表明,miR-3184-5p上调或FOXP4下调逆转了FOXP4-AS1过表达对LNCaP细胞增殖的影响。此外,抑制miR-3184-5p的表达或抑制FOXP4的过度表达可减弱sh-FOXP4-AS1对PC-3细胞增殖的影响,这就说明lncRNA是通过调控另外两者而影响细胞表型。
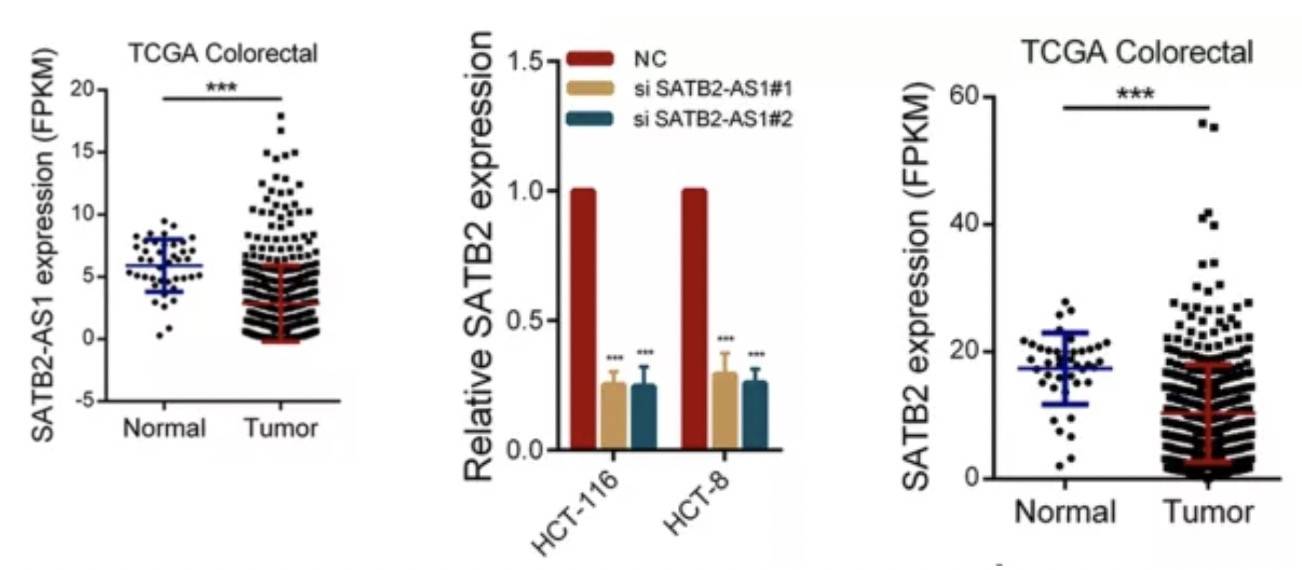
SATB2-AS1在结直肠组织中特异性表达,并在结直肠癌(CRC)中下调。生存分析表明,SATB2-AS1表达降低与生存能力差有关。
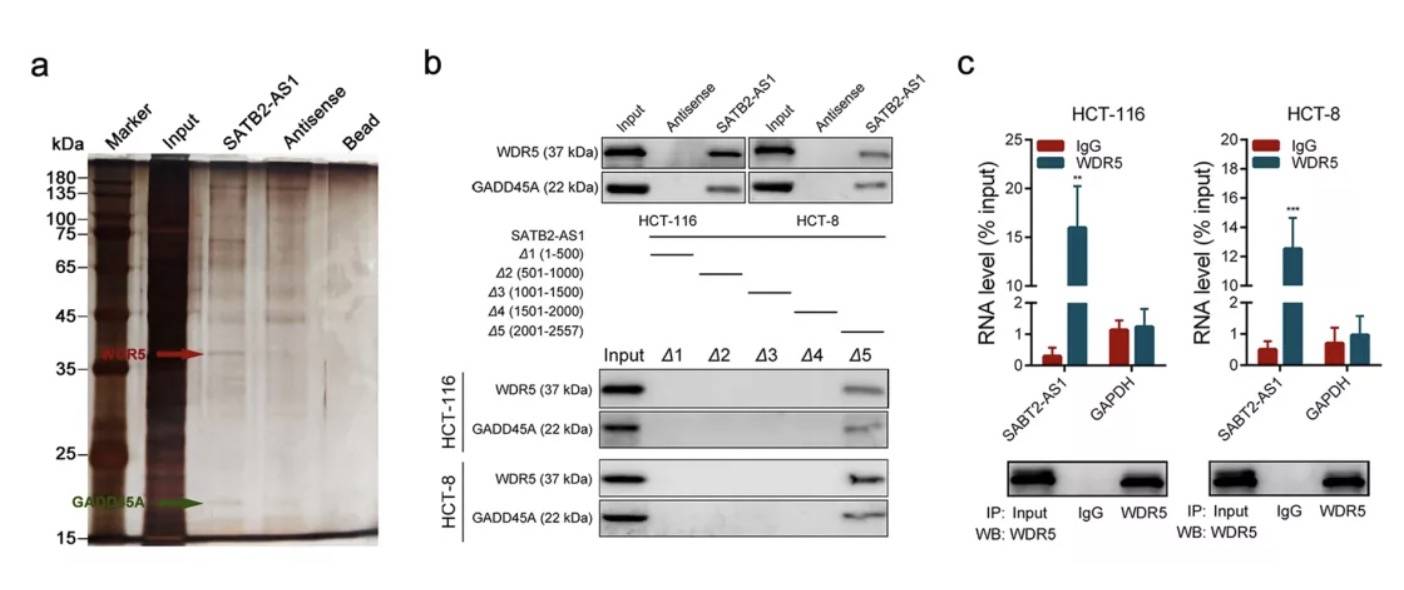
通过pull down,将下拉产物进行质谱分析,获得了与lncRNA结合的分子为WDR5和GADD45A,前者是组蛋白H3K4甲基转移酶复合物的核心亚基,而后者参与维持基因组稳定性和DNA修复,并且在DNA脱甲基激活中起关键作用,两个蛋白都是染色质调节因子。
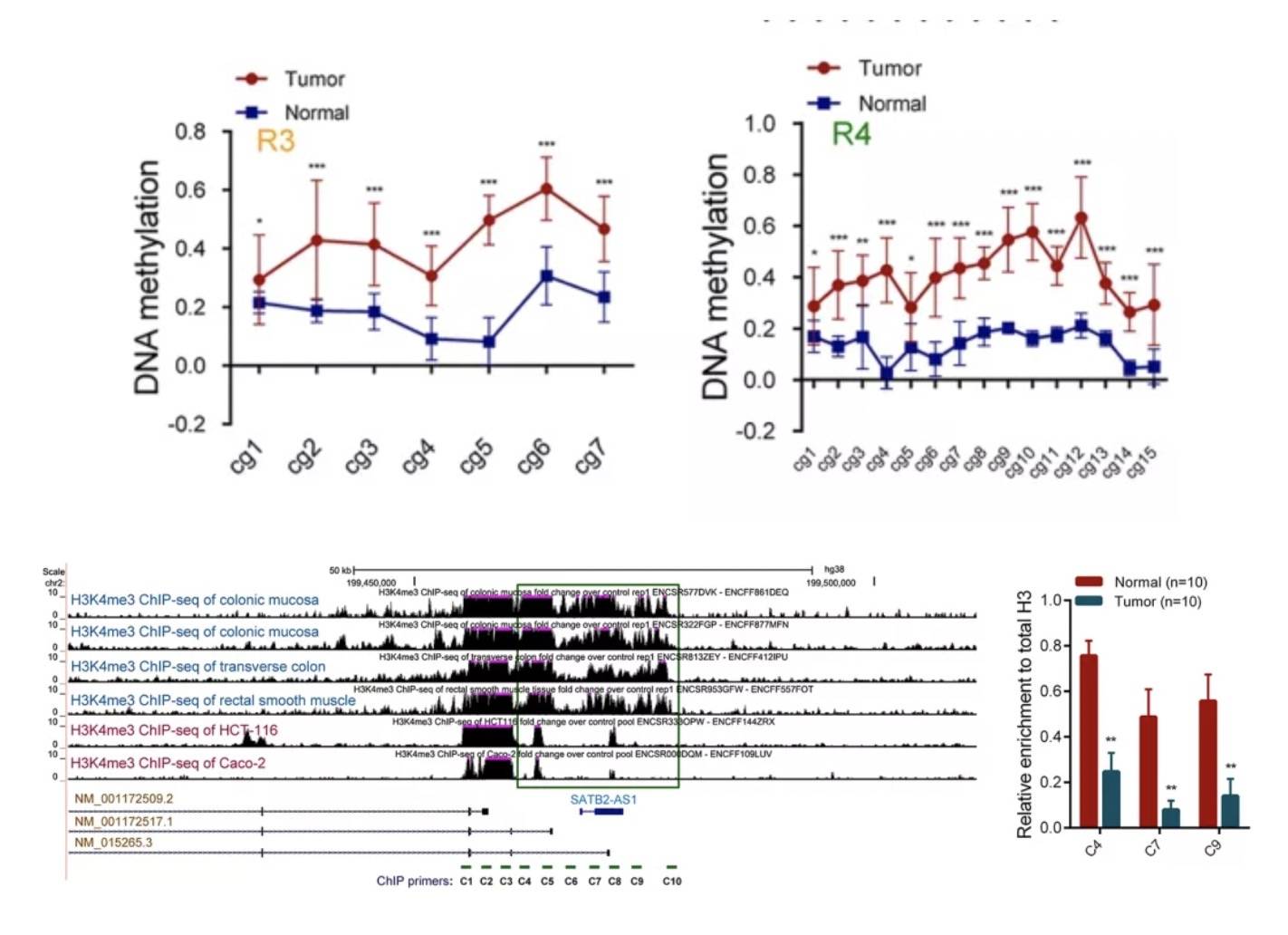
因为下拉的蛋白与甲基化有关,所以针对SATB2启动子区域进行亚硫酸氢盐测序以及H3K4me3 -chip,以检测CRC和正常组织中的CpG岛甲基化状态。发现R3和R4区两个区域甲基化存在差异,从而导致了SATB2基因表达变化。
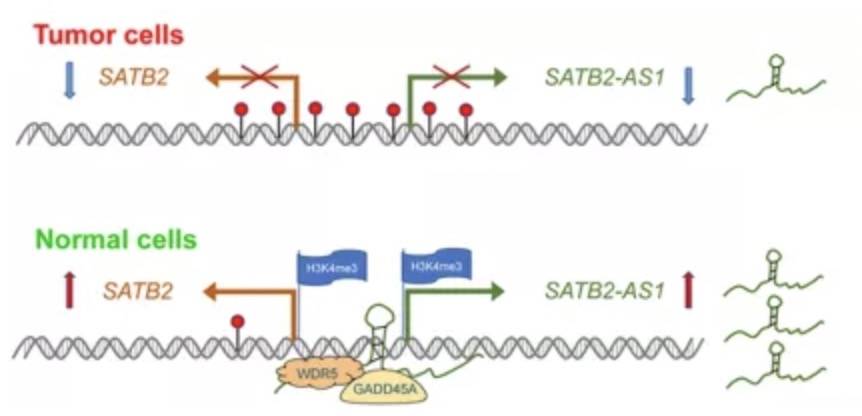
因此,SATB2-AS1通过调节SATB2启动子的DNA去甲基化和H3K4me3富集达到促表达的效果。
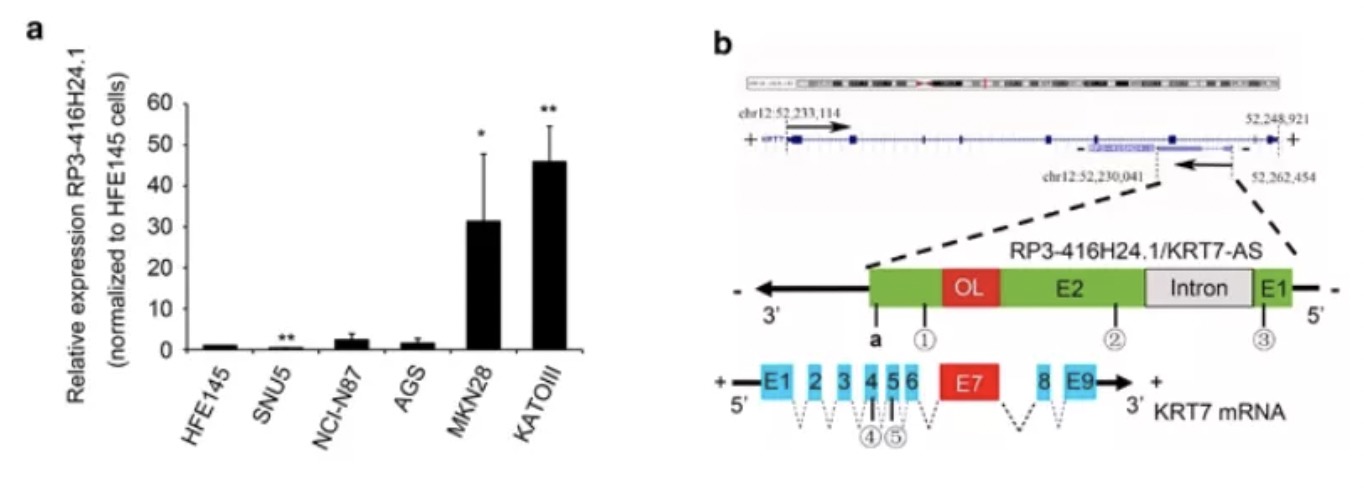
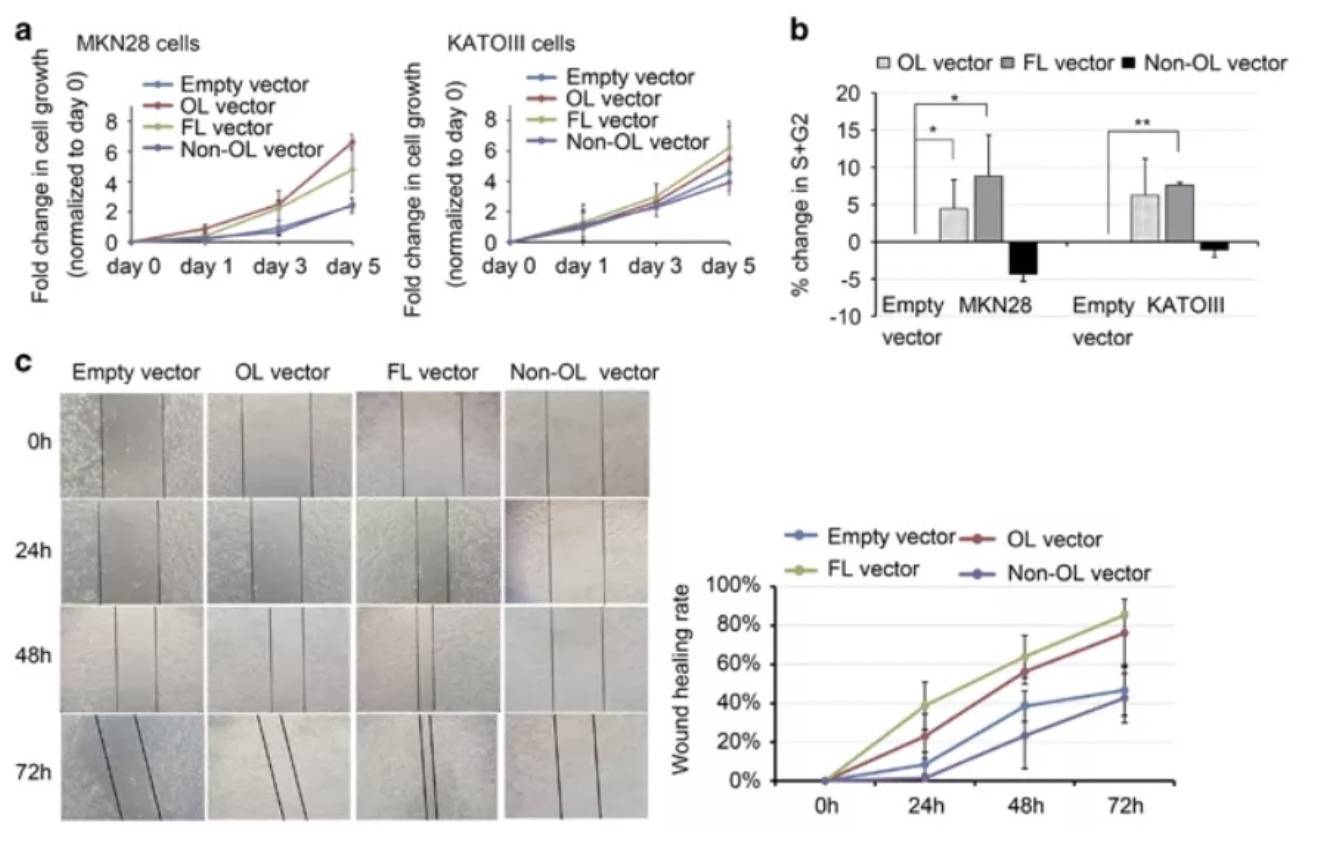
CRC中SATB2-AS1的拟议机制示意图 AS-lncRNA通过直接互作 改变mRNA的半衰期针对五个胃癌(GC)细胞系和正常组织进行RNA测序,筛选到MKN28和KATOIII这两个KRT7-AS表达升高。该lncRNA在基因座上与KRT7 mRNA中的第七外显子含有213bp的重叠区(OL):
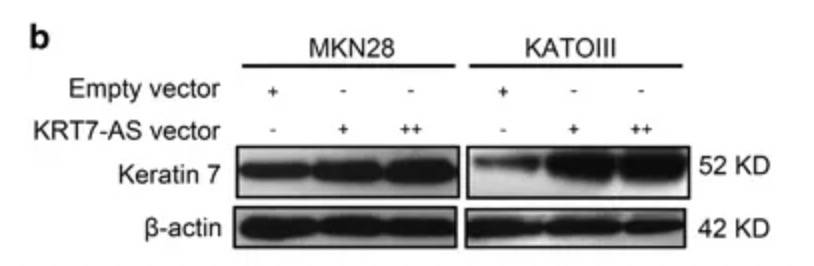
将KRT7-AS过表达后,KRT7蛋白表达量有明显的提升:
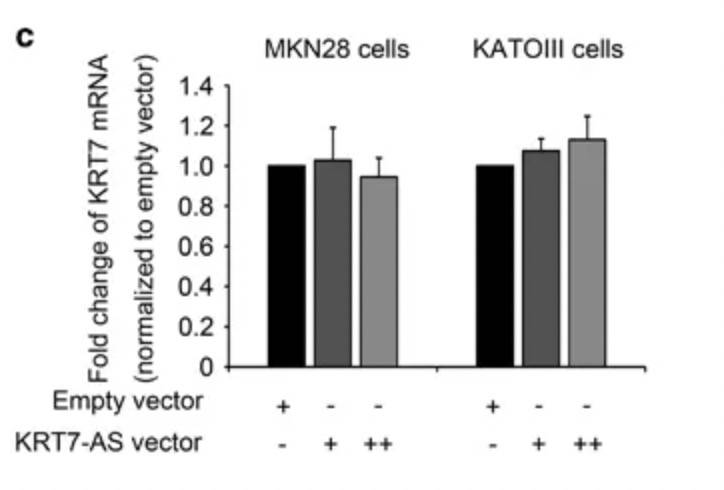
但是,KRT7的mRNA水平没有明显变化:
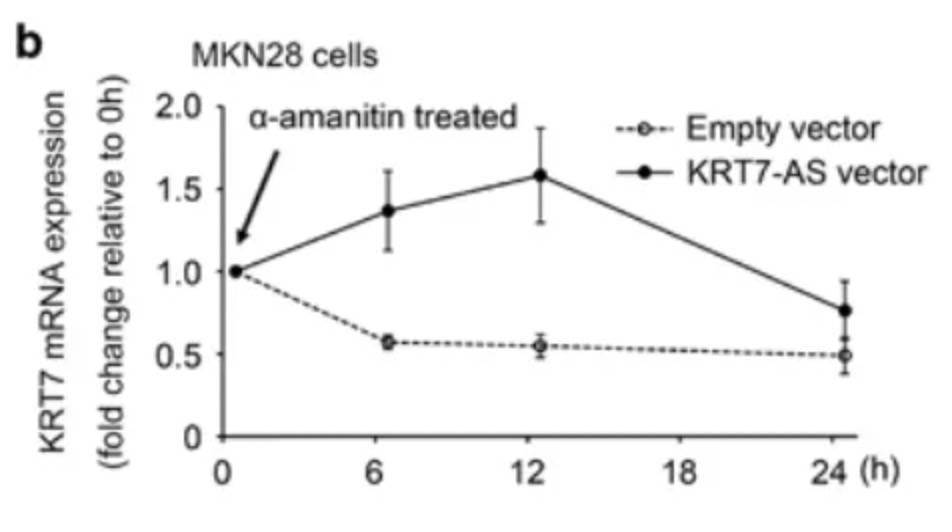
上述实验说明,lncRNA不是作用于转录前的作用,也就排除启动子、增强子等机制。作者进一步验证了RNA的半衰期,通过使用α-amanitin阻断新的RNA合成,检测KRT7的mRNA半衰期,发现,过表达KRT7-AS之后,KRT7的mRNA降解速度减缓:
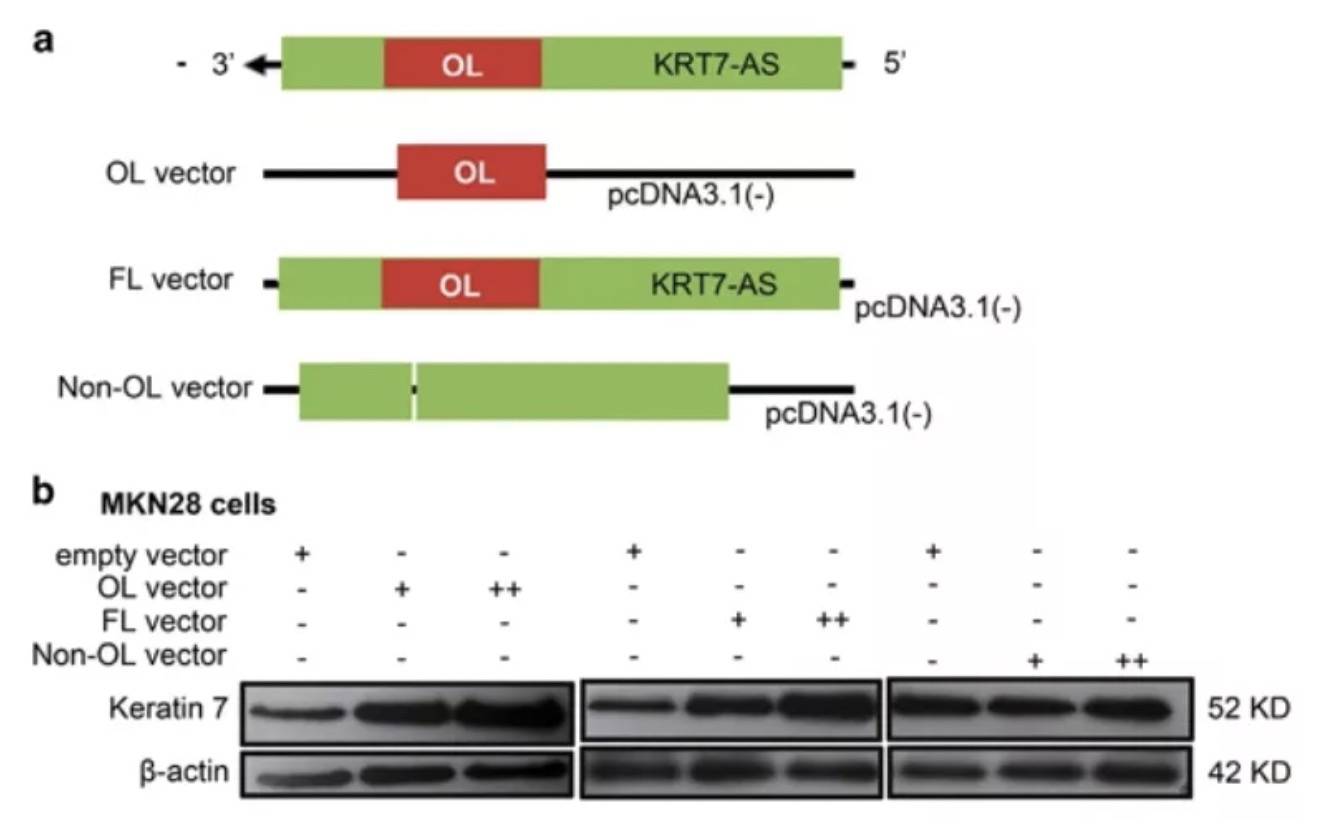
那反义RNA是如何延长mRNA的半衰期的呢?作者将目光转移至重叠区(OL),通过构建lncRNA全长、仅包含OL、去除OL的三种类型,在目的细胞分别过表达:
得出,OL增加了KRT7蛋白表达量,是lncRNA的最短功能区。也就是KRT7-AS通过与KRT7形成RNA-RNA双链形式,增加了后者的半衰期,从而增加了蛋白表达量。进一步将上述质粒进行细胞学功能验证,也发现同等结果,即OL过表达促进了GC细胞的增殖和迁移。
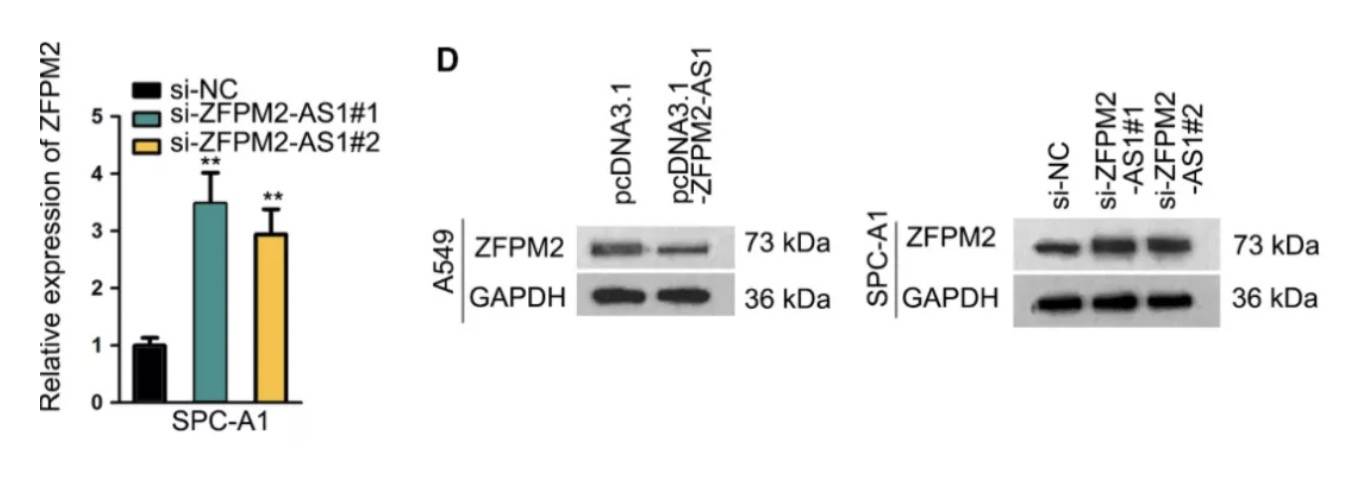
肺腺癌(LUAD)是非小细胞肺癌的组织学子类别,占全球与癌症相关的死亡的很大一部分。ZFPM2-AS1可以促进LUAD细胞的增殖,侵袭和上皮间质转化,是如何实现其分子机制的呢? 首先在LUAD细胞中ZFPM2-AS1过表达和敲低后,ZFPM2表达呈现相反的现象:
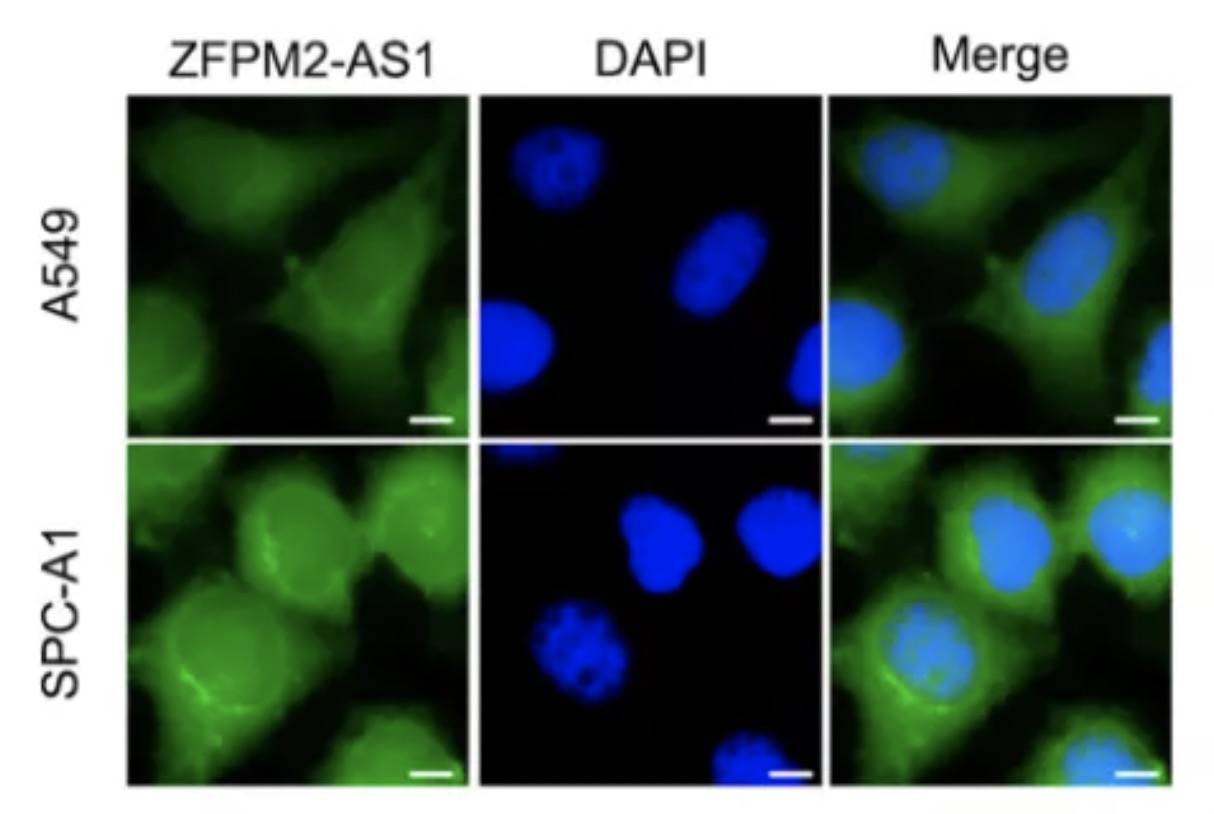
通过FISH实验,确认了lncRNA定位胞浆中:
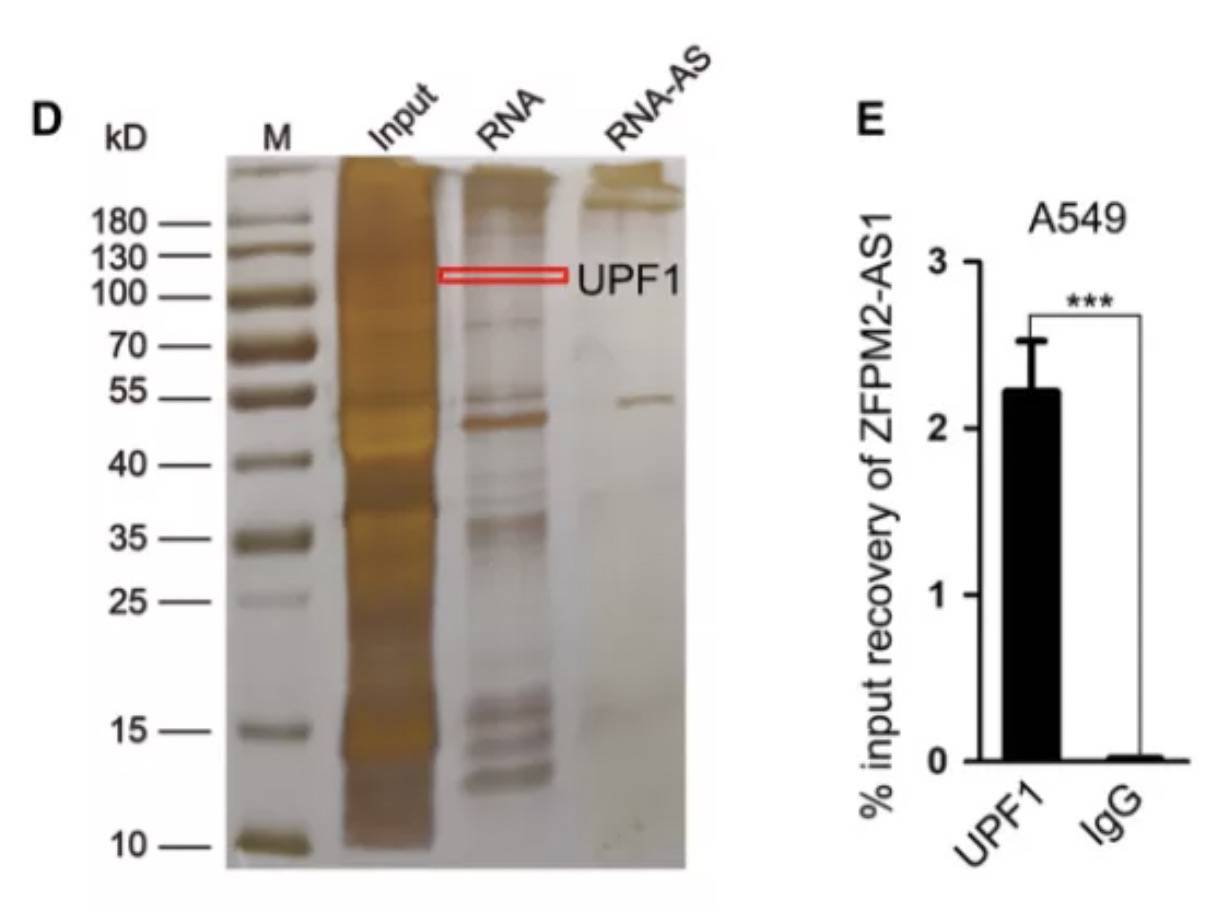
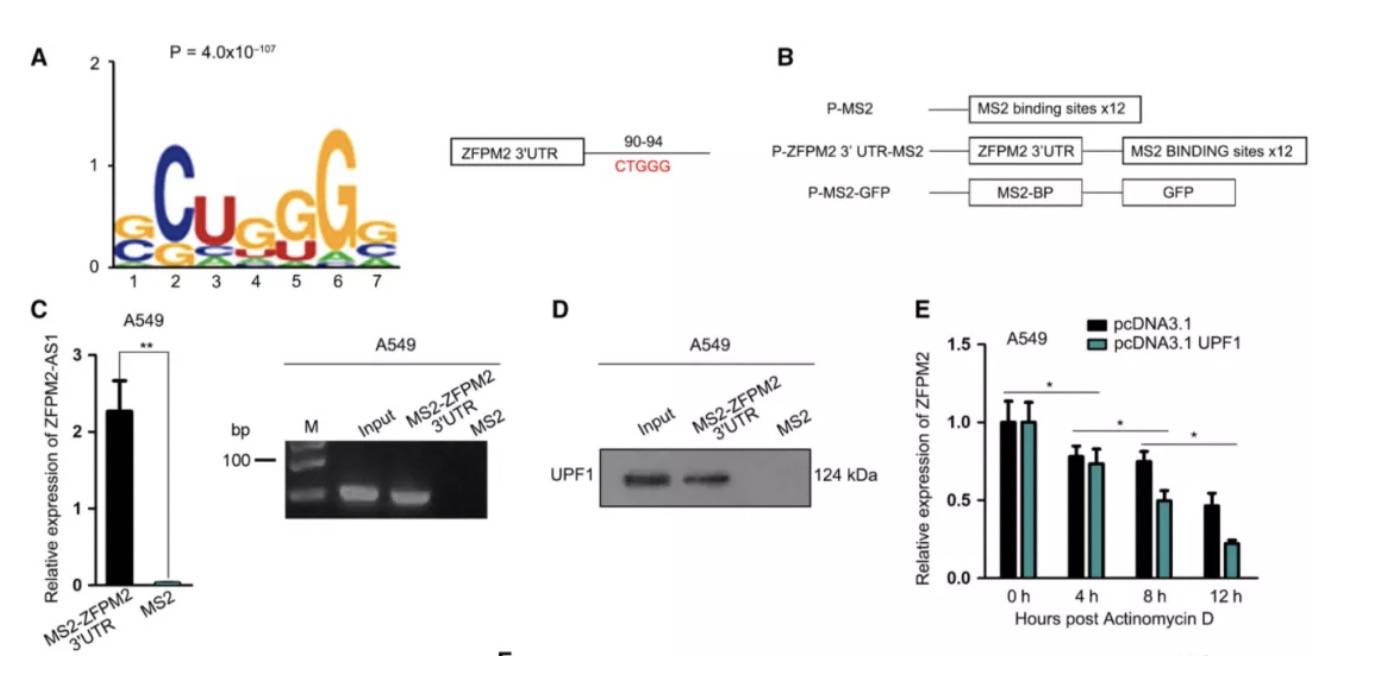
下拉实验,通过质谱分析与ZFPM2-AS1互作的蛋白质。发现了UPF1(UPF1是RNA降解途径中的关键调控因子,可诱导mRNA衰变)。
那么ZFPM2-AS1对ZFPM2的负反馈调节,是否是因为前者吸附了UPF1,导致后者降解效应解除呢? 通过Starbase,确定了UPF1的3'非翻译区(3UTR)上的潜在结合位点。然后,将3UTR区插入MS2质粒中进行了MS2-RIP。分析证实UPF1和ZFPM2-AS1与ZFPM2 mRNA在3'UTR区域的预测位点的相互作用。此外,加入放线菌素D来阻断mRNA的产生,每隔4小时检测ZFPM2 mRNA的水平。结果表明过表达UPF1或ZFPM2-AS1会缩短ZFPM2 mRNA的半衰期。
这些结果表明ZFPM2-AS1与UPF1协同作用来破坏ZFPM2 mRNA的稳定性。
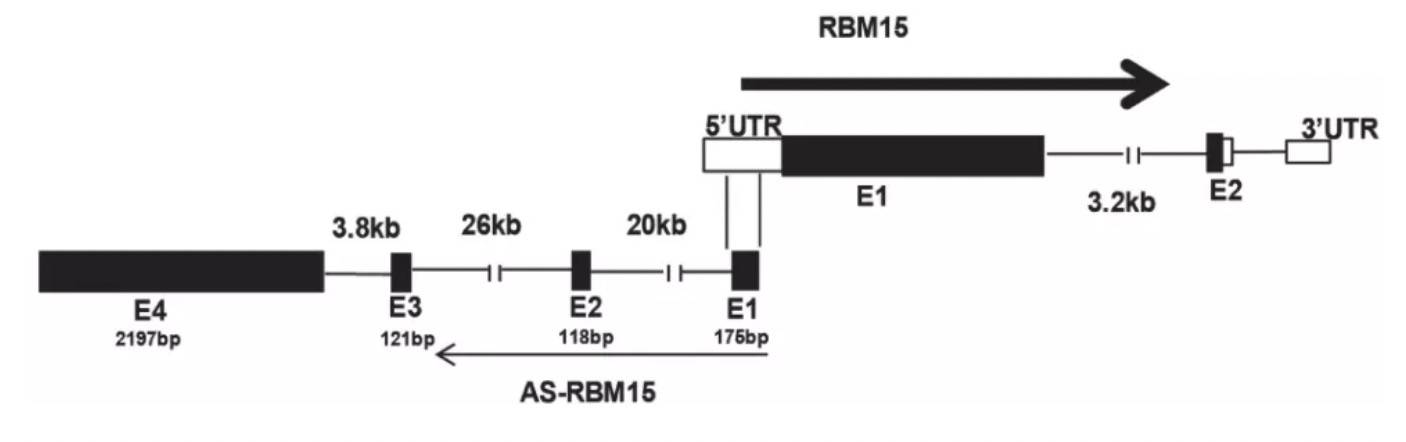
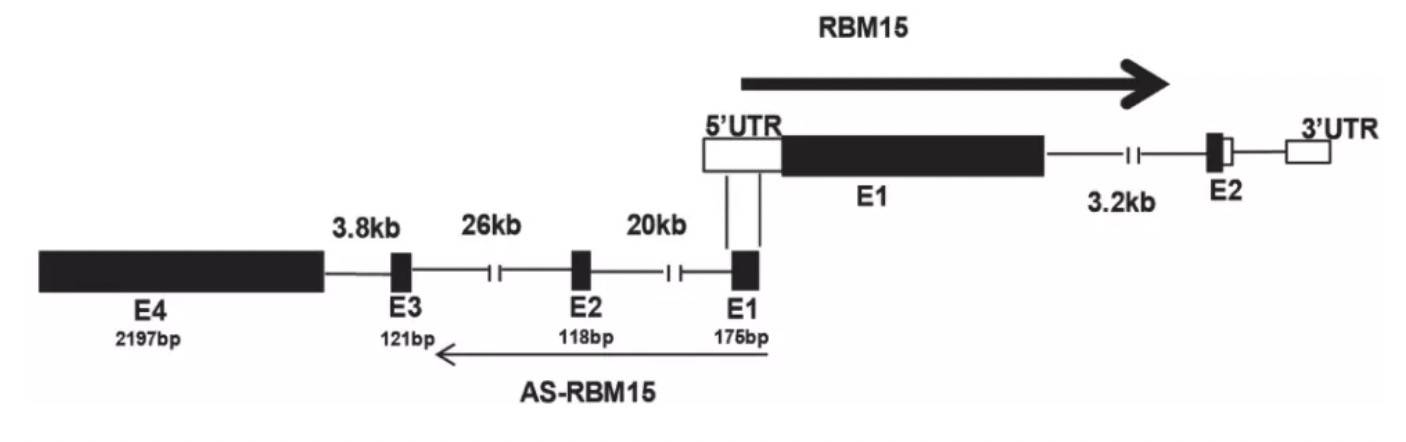
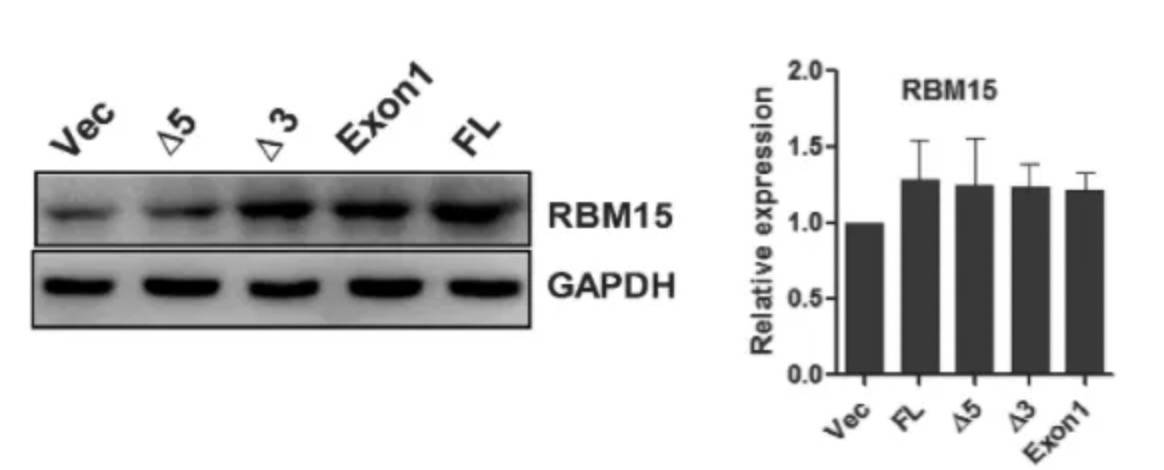
RBM15是巨核细胞(MK)分化的调节剂,其上调增强MK末端分化,而RBM15-AS1敲低则减弱了MK末端分化。为了阐明内在机制,作者首先分析两者的序列,发现RBM15-AS1的外显子1跟RBM15的5UTR是重合的:
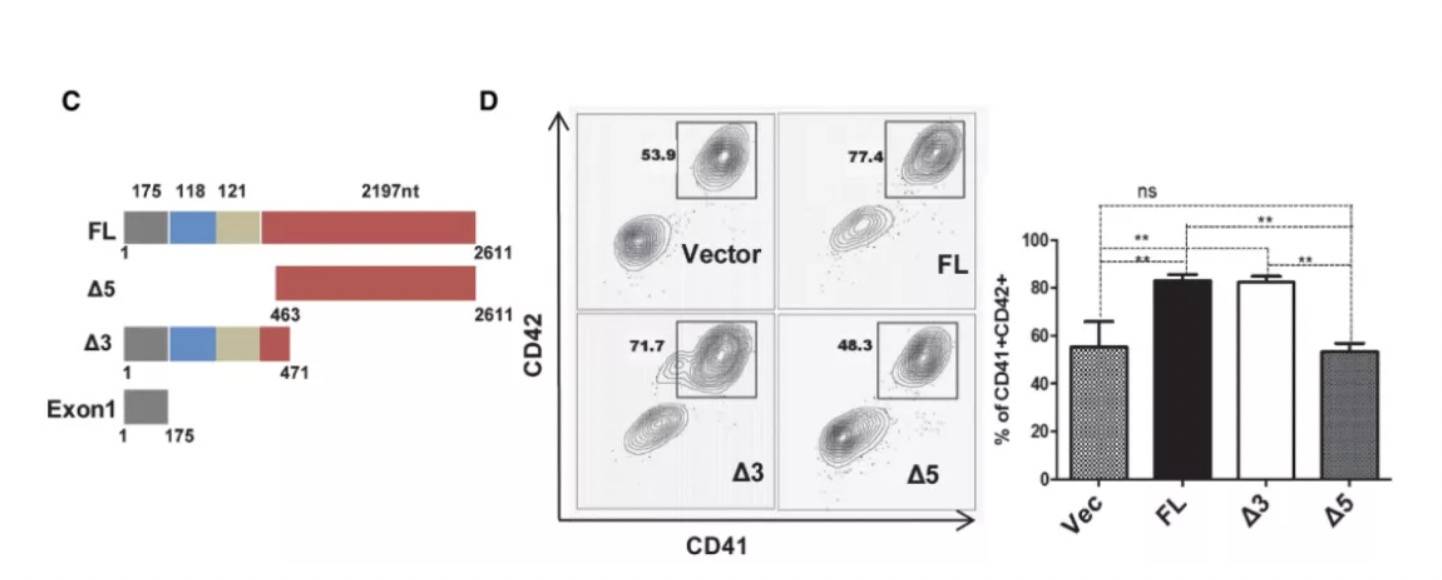
进一步寻找lncRNA的主要功能区,构建全长以及多个截断型,发现5端是主要功能区,可促进分化:
再验证RBM15-AS1与RBM15的关系,表明前者的最短功能区外显子1可引发后者翻译水平的提升,但是mRNA水平没有明显变化,这点跟前述半衰期是类似的。
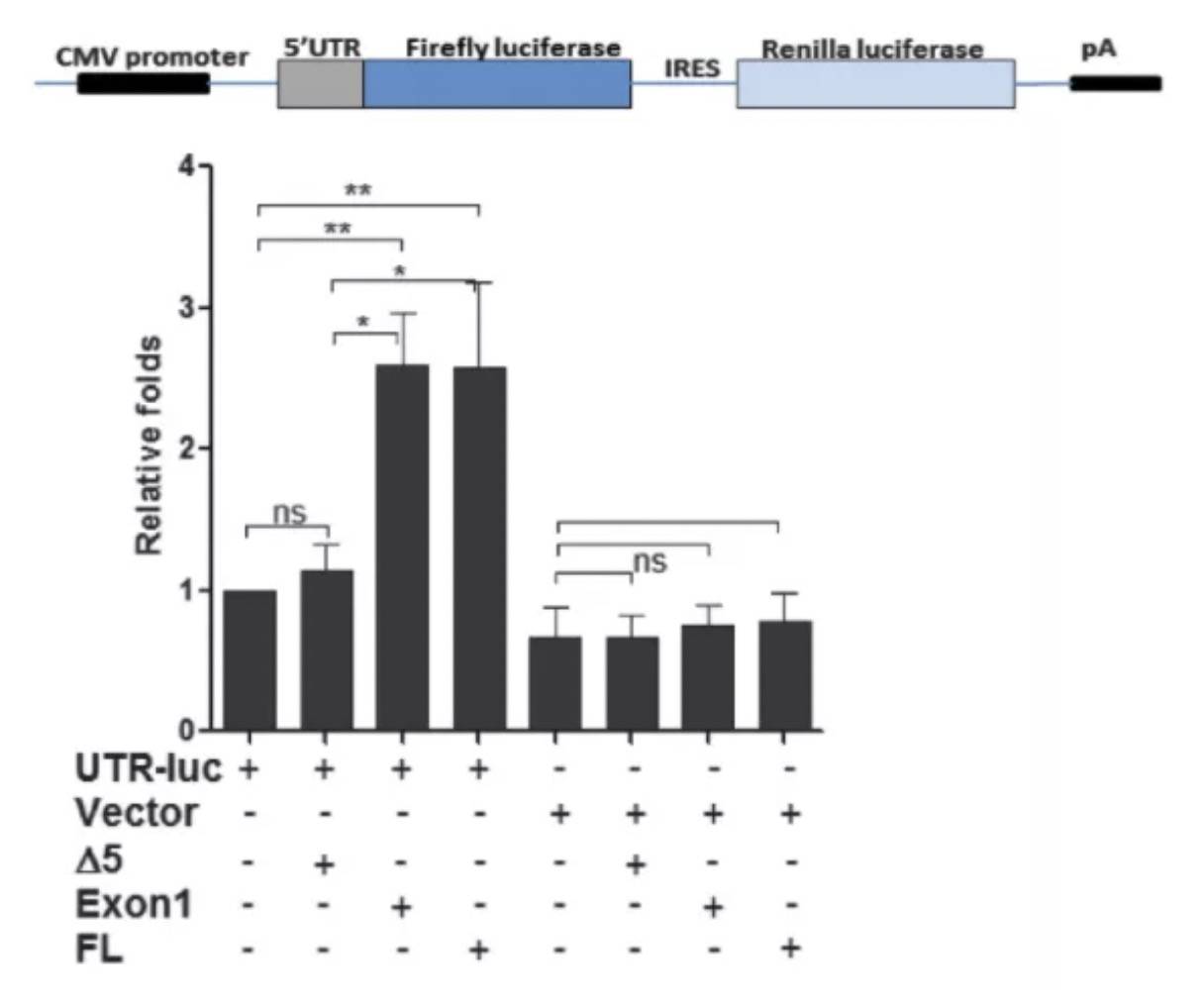
通过将RBM15的5UTR构建双荧光素酶报告系统,再跟lncRNA不同截断型共表达,确认了重叠区对翻译的促进作用:
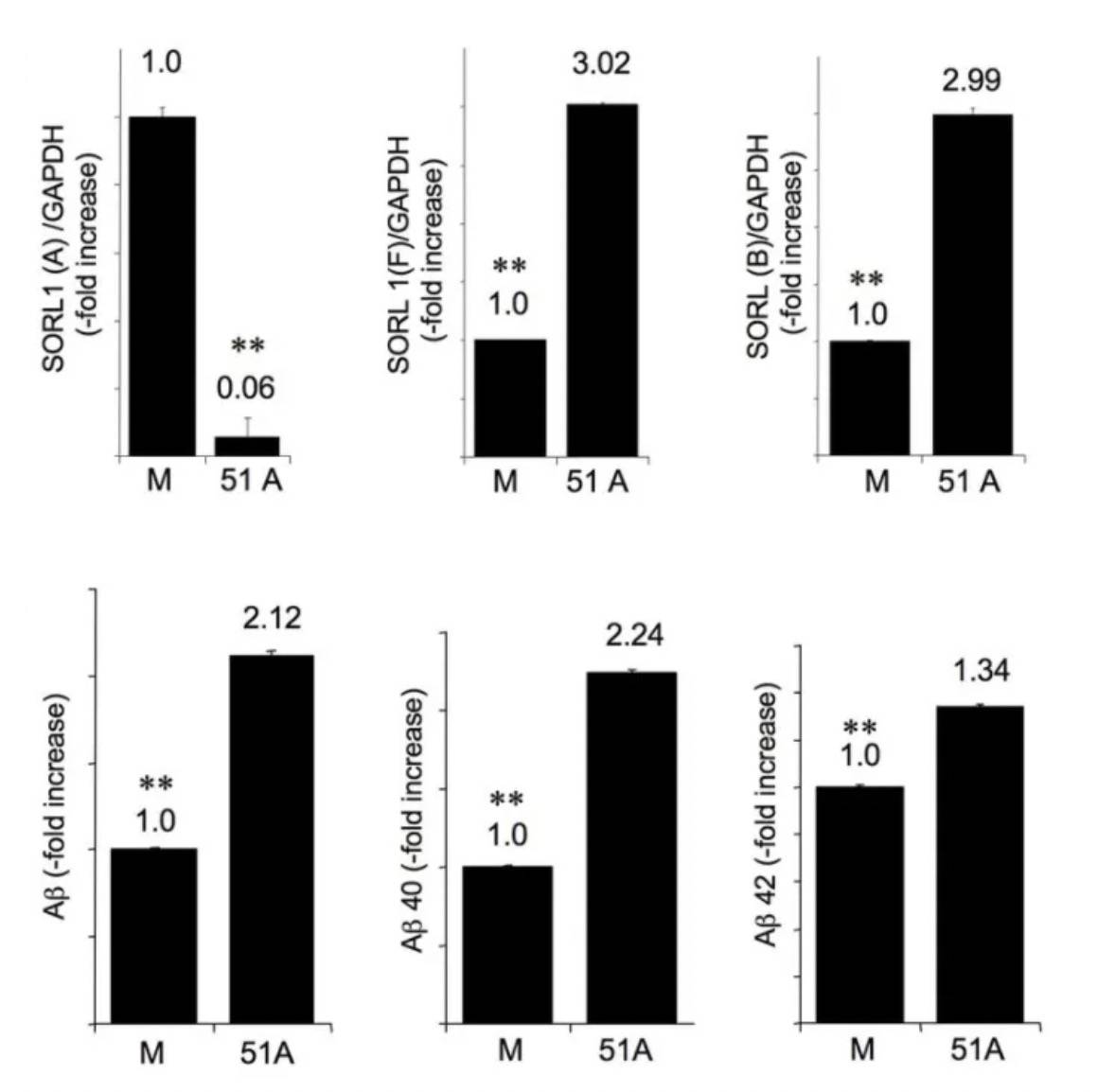
5UTR的双链RNA结构增强翻译是受SINEB2元件(上调翻译的SINE元件),这一点AS‐Uchl1以不依赖于CAP的方式调控Uchl1的翻译已经论述过,所以本文没有赘述。 AS-lncRNA调控转录剪接脑组织中SORL1变体A表达降低,会促进神经毒性β-淀粉样肽(Aβ)形成的增加,从而导致阿尔茨海默氏病(AD)。研究发现,该过程与SORL1内含子1的非编码反义lncRNA- 51A相关。51A的高表达干扰SORL1 pre-mRNA剪切,减少对变体A的表达,而增加了其他同工型的数量。
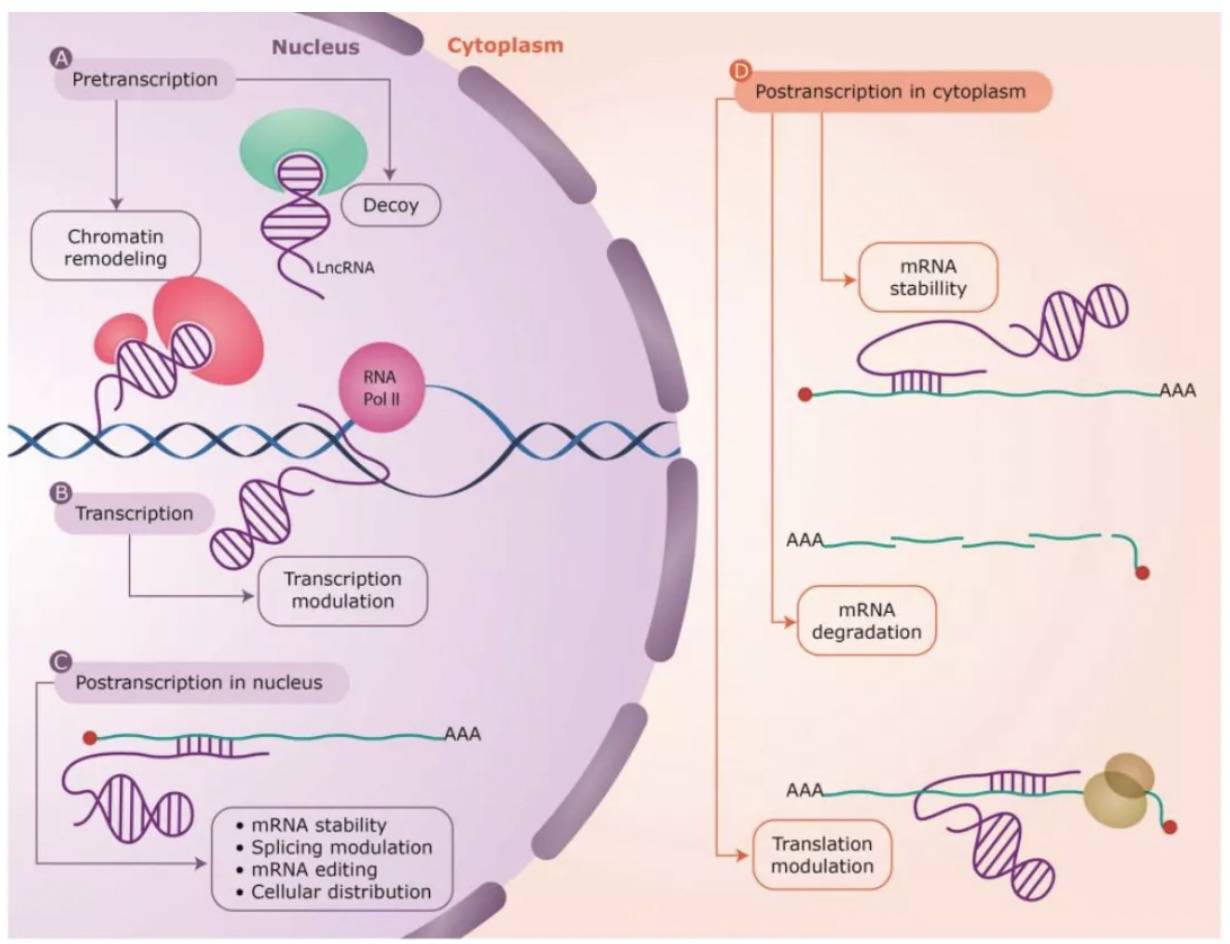
M为对照,51A是过表达lncRNA组;上图为SORL1不同变体的表达量,下图为对应的Aβ表达量 LncRNA-51A通过与SORL1 pre-mRNA碱基配对而掩盖了剪接位点,从而导致变体A减少(更多实验由于篇幅有限,实验策略基本同前述研究,感兴趣请看原文)。 总 结AS-lncRNA涉及的功能模型 由此可见,AS-lncRNA与相邻的编码基因功能密切相关,可以以多种方式调节亲本基因的表达。对于AS-lncRNA的实验研究:高通量测序、过表达、敲低、体外转录、质谱分析等实验内容,吉凯基因可以一站式解决,助力科研工作者对AS-lncRNA的研究,快来咨询吧!!!
欢迎添加微信:GENECHEM_H,获取免费的学习资料和直播课 【参考文献】 1.Neighboring Gene Regulation by Antisense Long Non-Coding RNAs 2.The patterns of antisense long non-coding RNAs regulating corresponding sense genes in human cancers 3.LncRNA FOXP4-AS1 is activated by PAX5 and promotes the growth of prostate cancer by sequestering miR-3184-5p to upregulate FOXP4 4.LncRNA SATB2-AS1 inhibits tumor metastasis and affects the tumor immune cell microenvironment in colorectal cancer by regulating SATB2 5.Long non-coding antisense RNA KRT7-AS is activated in gastric cancers and supports cancer cell progression by increasing KRT7 expression 6.LncRNA ZFPM2‐AS1 promotes lung adenocarcinoma progression by interacting with UPF1 to destabilize ZFPM2 7.The AS‐RBM15 lncRNA enhances RBM15 protein translation during megakaryocyte differentiation 8.An intronic ncRNA-dependent regulation of SORL1 expression affecting Aβ formation is upregulated in post-mortem Alzheimer's disease brain samples返回搜狐,查看更多 |
【本文地址】