| EN | 您所在的位置:网站首页 › btb培养基以什么为唯一氮源 › EN |
EN
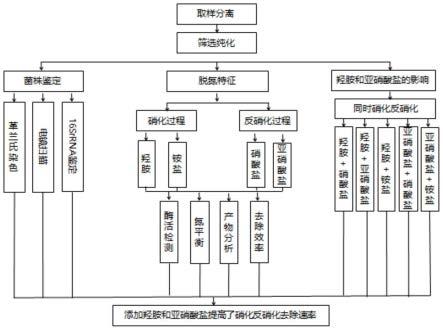 0.1g/l nano2、1.5-2g/l c6h5na3o7·2h2o、3-4g/l k2hpo4、1-2g/l kh2po4、0.03-0.07g/l mgso4、0.01-0.02g/l cacl2和0.005-0.1g/l fe2(so4)3。14.可选地,所述富集培养基ph为7.2,包括0.0496g/l honh3cl、0.0986g/l nano2、1.836g/l c6h5na3o7·2h2o、3.5g/l k2hpo4、1.5g/l kh2po4、0.04g/l mgso4、0.014g/l cacl2和0.009g/l fe2(so4)3。15.可选地,所述溴酚蓝固体培养基包括:btb试剂、(nh4)2so4、柠檬酸钠、kh2po4、feso4·7h2o、cacl2、mgso4和琼脂。16.可选地,所述溴酚蓝固体培养基的ph为7-7.4,包括0.8-1.5ml/l btb试剂、0.2-0.3g/l(nh4)2so4、2-3g/l柠檬酸钠、0.8-1.5g/l kh2po4、0.5-1g/l feso4·7h2o、0.05-0.1g/l cacl2、0.3-0.8g/l mgso4和15-20g/l琼脂。17.可选地,所述溴酚蓝固体培养基的ph为7.2,包括1ml/l btb试剂、0.236g/l(nh4)2so4、2.45g/l柠檬酸钠、1g/l kh2po4、0.592g/l feso4·7h2o、0.094g/l cacl2、0.488g/l mgso4和18g/l琼脂。18.本发明还提供如上所述菌株在含氮污水处理中的应用。19.本发明的有益效果在于:20.(1)本发明的菌株en-j1具有优异的脱氮能力。21.(2)羟胺和亚硝酸盐能够增强菌株en-j1的hn-ad能力。22.(3)本发明的菌株en-j1在混合氮污染污水处理中表现出潜在的应用价值。附图说明23.图1为菌株筛选过程;24.图2为菌落形态;25.图3为en-j1菌株基于16s rrna基因序列和其他相关菌株序列构建的邻接系统发育树;26.图4为en-f2菌株的异养硝化特性,其中4a为以铵为唯一氮源时的检测结果;4b为以羟胺为唯一氮源时的检测结果;27.图5为en-f2菌株的异养硝化特性,其中5a为以硝酸盐为唯一氮源时的检测结果;5b为以亚硝酸盐为唯一氮源时的检测结果,其中,检测值是三个重复的平均值±sd(误差棒);28.图6为羟胺对hn-ad过程的影响结果图,其中,6a为对硝酸盐的影响结果图;6b为对亚硝酸盐的影响结果图;6c为对铵盐的影响结果图;29.图7为亚硝酸盐对hn-ad过程的影响结果图,其中,7a为添加高浓度亚硝酸盐对硝酸盐的影响结果图;7b为添加亚硝酸盐和铵盐作为混合氮源时的影响结果图。具体实施方式30.所举实施例是为了更好地对本发明的内容进行说明,但并不是本发明的内容仅限于所举实施例。所以熟悉本领域的技术人员根据上述 0.1g/l nano2、1.5-2g/l c6h5na3o7·2h2o、3-4g/l k2hpo4、1-2g/l kh2po4、0.03-0.07g/l mgso4、0.01-0.02g/l cacl2和0.005-0.1g/l fe2(so4)3。14.可选地,所述富集培养基ph为7.2,包括0.0496g/l honh3cl、0.0986g/l nano2、1.836g/l c6h5na3o7·2h2o、3.5g/l k2hpo4、1.5g/l kh2po4、0.04g/l mgso4、0.014g/l cacl2和0.009g/l fe2(so4)3。15.可选地,所述溴酚蓝固体培养基包括:btb试剂、(nh4)2so4、柠檬酸钠、kh2po4、feso4·7h2o、cacl2、mgso4和琼脂。16.可选地,所述溴酚蓝固体培养基的ph为7-7.4,包括0.8-1.5ml/l btb试剂、0.2-0.3g/l(nh4)2so4、2-3g/l柠檬酸钠、0.8-1.5g/l kh2po4、0.5-1g/l feso4·7h2o、0.05-0.1g/l cacl2、0.3-0.8g/l mgso4和15-20g/l琼脂。17.可选地,所述溴酚蓝固体培养基的ph为7.2,包括1ml/l btb试剂、0.236g/l(nh4)2so4、2.45g/l柠檬酸钠、1g/l kh2po4、0.592g/l feso4·7h2o、0.094g/l cacl2、0.488g/l mgso4和18g/l琼脂。18.本发明还提供如上所述菌株在含氮污水处理中的应用。19.本发明的有益效果在于:20.(1)本发明的菌株en-j1具有优异的脱氮能力。21.(2)羟胺和亚硝酸盐能够增强菌株en-j1的hn-ad能力。22.(3)本发明的菌株en-j1在混合氮污染污水处理中表现出潜在的应用价值。附图说明23.图1为菌株筛选过程;24.图2为菌落形态;25.图3为en-j1菌株基于16s rrna基因序列和其他相关菌株序列构建的邻接系统发育树;26.图4为en-f2菌株的异养硝化特性,其中4a为以铵为唯一氮源时的检测结果;4b为以羟胺为唯一氮源时的检测结果;27.图5为en-f2菌株的异养硝化特性,其中5a为以硝酸盐为唯一氮源时的检测结果;5b为以亚硝酸盐为唯一氮源时的检测结果,其中,检测值是三个重复的平均值±sd(误差棒);28.图6为羟胺对hn-ad过程的影响结果图,其中,6a为对硝酸盐的影响结果图;6b为对亚硝酸盐的影响结果图;6c为对铵盐的影响结果图;29.图7为亚硝酸盐对hn-ad过程的影响结果图,其中,7a为添加高浓度亚硝酸盐对硝酸盐的影响结果图;7b为添加亚硝酸盐和铵盐作为混合氮源时的影响结果图。具体实施方式30.所举实施例是为了更好地对本发明的内容进行说明,但并不是本发明的内容仅限于所举实施例。所以熟悉本领域的技术人员根据上述技术实现要素:对实施方案进行非本质的改进和调整,仍属于本发明的保护范围。31.(1)细菌分离筛选32.所用土壤样品取自黔东南锦屏县蔬菜地土壤。为初步筛选对混合羟胺和亚硝酸盐去除速率较高的hn-ad菌株,将1g土壤样品添加到富集培养基中,该培养基的ph为7.2,其组成为(每升):honh3cl0.0496g、nano20.0986g、c6h5na3o7·2h2o1.836g、k2hpo4 3.5g、kh2po41.5g、mgso40.04g、cacl20.014g和fe2(so4)30.009g,并以4天的间隔转移3次至新鲜培养基中(150rpm,25℃)。分别抽取富集培养基5、10、15μl溴百里酚蓝(btb)固体培养基(每升,ph=7.0)上划线纯化,该培养基的ph=7.0,其组成为(每升):btb[1.5g溴百里酚蓝溶于100ml无水乙醇]1ml、(nh4)2so4 0.236g、柠檬酸钠sodium citrate 2.45g、kh2po4 1g、feso4.7h2o 0.592g、cacl2 0.094g、mgso4 0.488g和琼脂agar 18g。挑选出能使btb培养基变蓝且对羟胺和亚硝酸盐去除效率均达80%以上的细菌作为候选菌株。[0033]从候选菌中筛选出在羟胺和亚硝酸盐存在条件下均可促进异氧硝化-好养反硝化能力的菌株即得目标菌株,具体步骤如下。[0034]将候选菌株储存于-20℃的30%甘油中,并将候选菌株分别转移到基础培养基中以评价目标菌株的hn-ad能力,基础培养基的ph=7.2,其包括(每升):kh2po41.5g、k2hpo43.5g、fe2(so4)30.009g、mgso40.04g、cacl20.014g和c6h5na3o7·2h2o 3.064g。[0035]将(nh4)2so40.236g、honh3cl 0.0992g、kno30.361g和nano20.246g分别转移到基础培养基中,采用吲哚酚蓝紫外分光光度法(步骤:取0.5ml经离心(6500rpm、5min)的上清液培养基于50ml比色管中→用去离子水(18.2)稀释至30ml→加5ml苯酚溶液、次氯酸钠溶液→放置1h→加入1ml掩蔽剂→定容至50ml→于可见光625nm波长处测定吸光度od值)、8-羟基喹啉紫外分光光度法(取1ml上清液培养基于10ml比色管中→加1ml磷酸缓冲液并定容至5ml→加入0.2ml三氯乙酸→加1ml 8-羟基喹啉→摇匀→加1ml的碳酸钠摇匀→沸水浴1min(产生绿色)→静置15min后于750nm波长处测定吸光度od值)、紫外分光光度法(步骤:取1ml上清液培养基在25ml比色管中→用去离子水定容至25ml→在波长为220nm以及275nm条件下测定吸光度od值,然后用220nm波长处的od值-2倍275nm波长的od值)、n-(1-萘基)-乙二胺紫外分光光度法(步骤:取1ml上清液培养基于50ml比色管中→加1ml显色剂→静置20min→在540nm波长处检测其吸光od值)和碱性过硫酸钾消解-紫外分光光度法(步骤:取1ml培养基于25ml比色管中→去离子水(18.2)稀释至10ml→加5ml碱性过硫酸钾(需重结晶)→121℃消煮30min→冷却后加1ml稀释盐酸(盐酸:水=1:9)→用水稀释至25ml→分别于220和275nm处测定吸光度od值,然后用220nm波长处的od值-2倍275nm波长的od值)(guo,l.y.,chen,q.k.,fang,f.,hu,z.x.,wu,j.,miao,a.j.,xiao,l.,chen,x.f.,yang,l.y.2013.application potential of a newly isolated indigenous aerobic denitrifier for nitrate and ammonium removal of eutrophic lake water.biosource technology.142,45-51)分别测定铵盐、羟胺、硝酸盐、亚硝酸盐和总氮od值,将od值带入预先利用外标法测得的标曲中,从而得到氮浓度。无机氮去除效率的计算公式为ec=[(f1-f2)/f1]×100%,其中ec代表去除效率,f1代表初始氮浓度,f2为最终氮浓度;去除速率计算公式为ef=(r1-r2)/h,式中ef、r1、r2和h分别代表无机氮去除速率、在一定时间内的初始氮浓度、最终氮浓度和时间间隔。根据菌株en-j1对这几种氮源的去除效率以及速率来评估hn-ad能力强弱,当以羟胺为单一氮源时,将碳源含量更改为c6h5na3o7·2h2o 1.225g。[0036]为研究羟胺对hn-ad的影响,将羟胺分别与含铵盐、亚硝酸盐和硝酸盐的培养基共同培养作为混合氮源,通过观察及检测羟胺和铵盐/亚硝酸盐/硝酸盐/的去除效率及速率进而评估羟胺对hn-ad的影响(促进或抑制),其中羟胺、铵盐、亚硝酸盐和硝酸盐的检测分方法分别为8-羟基喹啉紫外分光光度法、吲哚酚蓝紫外分光光度法、n-(1-萘基)-乙二胺紫外分光光度法和紫外分光光度法,培养基各成分含量为(每升,ph=7.20)honh3cl(0.0496g)、kno30.361g/(此处的斜线即为“或者”的意思)nano20.246g/(nh4)2so40.236g、mgso40.04g,k2hpo43.5g、cacl20.014g、fe2(so4)30.009g、kh2po41.5g、c6h5na3o7·2h2o 3.676g。[0037]同样,培养基组成为nano20.246、kno30.361g/(nh4)2so40.236g、mgso40.04g、k2hpo43.5g、cacl20.014g、fe2(so4)30.009g、kh2po41.5g、c6h5na3o7·2h2o 6.127g,通过观察及检测亚硝酸盐和铵盐/硝酸盐的去除效率及速率进而评估亚硝酸盐对hn-ad的影响(促进或抑制),亚硝酸盐、铵盐、硝酸盐的检测方法分别用n-(1-萘基)-乙二胺紫外分光光度法(步骤:取1ml上清液培养基于50ml比色管中→加1ml显色剂→静置20min→在540nm波长处检测其吸光值)、吲哚酚蓝紫外分光光度法(步骤:取0.5ml经离心(6500rpm、5min)的上清液培养基于50ml比色管中→用去离子水(18.2)稀释至30ml→加5ml苯酚溶液、次氯酸钠溶液→放置1h→加入1ml掩蔽剂→定容至50ml→于可见光625nm波长处测定吸光度od值)和紫外分光光度法(步骤:取1ml上清液培养基在25ml比色管中→用去离子水定容至25ml→在波长为220nm以及275nm条件下测定吸光度od值,然后用220nm波长处的od值-2倍275nm波长的od值),再将od值带入预先利用外标法测得的标曲中,从而得到氮浓度。再带入公式ec=[(f1-f2)/f1]×100%,其中ec代表去除效率,f1代表初始氮浓度,f2为最终氮浓度;去除速率计算公式为ef=(r1-r2)/h,式中ef、r1、r2和h分别代表无机氮去除速率、在一定时间内的初始氮浓度、最终氮浓度和时间间隔。(guo,l.y.,chen,q.k.,fang,f.,hu,z.x.,wu,j.,miao,a.j.,xiao,l.,chen,x.f.,yang,l.y.2013.application potential of a newly isolated indigenous aerobic denitrifier for nitrate and ammonium removal of eutrophic lake water.biosource technology.142,45-51)。[0038]在随后的所有实验中,使用nacl(10.0g)、胰蛋白胨(10.0g)、酵母提取物(5.0g)的lb培养基进行细菌培养。所有培养基均在121℃、0.11mpa条件下灭菌30min。(按照以上步骤即可筛得目标菌株en-j1)[0039]具体筛选过程如图1所示。[0040](2)细菌分子鉴定[0041]将所得菌株en-j1(筛选步骤:从蔬菜地土壤中称1g土于富集培养基中进行初步筛选,培养三天后取1ml液体至新鲜富集培养基中,如此操作重复三次,接着将菌液涂布于lb和btb培养基上,选择能在两种培养基长起来的菌株,然后将菌株分别接种至含铵盐、羟胺、亚硝酸盐和硝酸盐培养基中进行复筛,通过菌株对各无机氮和总氮的去除效率和速率进而评估所选菌株的hn-ad能力,最后再用羟胺和铵盐/亚硝酸盐/硝酸盐混合作为氮源研究羟胺对hn-ad的影响,亚硝酸盐对hn-ad的影响亦然,通过以上层层筛选,最后得到能促进hn-ad能力的目标菌株en-j1)细菌悬液涂布在lb平板上并在25℃下培养直至菌落形成。通过su8100扫描电子显微镜(日立,日本)观察菌落形态。为了鉴定革兰氏染色,选择olympus bx53-dic光学显微镜(东京,日本)来观察细菌细胞(如图2所示)。[0042]由图2可知,菌株en-j1的菌落形态特征为黄色圆形、湿润且光滑的表面、规则边缘、凸面(图1a、b)。菌株en-j1革兰氏染色呈阴性,扫描电镜下呈短棒状,无鞭毛(图1c、d)。[0043]使用dna提取试剂盒(magen)从菌株en-j1中提取基因组dna,作为模板扩增(条件:12.5μl 2×tap plus master mix ll、1μl primer1、1μl primer 2、0.5μl dna、10μl无菌水;pcr条件为94℃变性5min,每分钟30个循环,55.5℃温度下退火30s,72℃延伸10min)16s rrna基因序列。聚合酶链式反应(pcr)16s rrna基因扩增(25μl反应体系)采用通用引物27f和1492r(其中,f27通用引物的核苷酸序列为5’‑agagtttgatcctggctcag-3’,r1492通用引物的核苷酸序列为5’‑ggttaccttgttacgactt-3’),pcr产物由生工生物(中国上海)检测。之后,将从生工生物测序返回的16s rrna基因序列提交给美国国家生物技术信息中心(ncbi)以获得菌株登录号(on076880)。经blast比对后,用mega 7.0软件建立反映菌株en-j1亲缘关系的系统发育树,结果如图3所示。[0044]由图3可知,菌株en-j1与acinetobacter johnsonii atcc的基因序列高度相似(99.23%)(图2)。将菌株菌株en-j1保藏于中国典型培养物保藏中心,保藏号为cctcc no:m2022702。acinetobacter johnsonii对羟胺和亚硝酸盐的脱氮能力及其对hn-ad过程的影响尚未见报道。[0045](3)菌株en-j1的hn-ad能力评估以及羟胺和亚硝酸盐对hn-ad影响分析[0046]为评估所选菌株en-j1的hn-ad能力,将菌株en-j1(甘油保存)接种在lb液体培养基中,在25℃下以150rpm的振荡速度培养24h,然后在6500rpm的条件下离心5分钟,再用无菌超纯水洗涤3次,得到纯菌悬液。将细菌光密度(od600)值为0.2的细菌接种到100ml培养基中,该培养基分别含有约50mg/l的铵、50mg/l硝酸盐和50mg/l亚硝酸盐,将od600为0.5的细菌接种到20mg/l羟胺培养基中。研究羟胺或亚硝酸盐对hn-ad影响的程序与上述步骤(1)分析方法类似,不同之处在于使用的碳源含量和氮源种类不同(不同之处已在培养基成分中显示)。在此过程中,以未添加菌株的培养基用作对照处理组。每6小时从培养物中收集6ml培养基上清液,测量ph值、od600和不同无机氮(含铵、羟胺、硝酸盐和亚硝酸盐)及总氮的浓度。无机氮的去除速率由下式计算:ev=(c1-c2)/δt,其中ev代表去除速率,c1、c2和δt分别表示初始氮浓度、最终氮浓度和时间间隔。该结果用于进一步分析菌株en-j1的氮转化特性,结果如图4和图5所示。[0047]由图4a可知,菌株en-j1在接种12h后迅速生长,od600值达到最高水平0.97。在最初的6h内铵的含量从53.99显著下降到11.25mg/l,当反应时间延长至12h时,99.28%的铵被转化。在铵氧化的过程中,最大降解速率7.12mg/l/h出现在0-6h之间。与以往报道的菌株相比,本研究铵的去除速率明显高于pseudomonas stutzeri yzn-001的5.53mg/l/h(xia et al.,“heterotrophic nitrification and aerobic denitrification by a novel acinetobacter sp.nd7 isolated from municipal activated sludge”,biosource technology,301,122749)、bacillus thuringiensis wxn-23的3.70mg/l/h(xu et al.,“biological nitrogen removal capability and pathways analysis of a novel low c/n ratio heterotrophic nitrifying and aerobic denitrifying bacterium(bacillus thuringiensis strain wxn-23)”,environmental research,2021,195,110797),streptomyces mediolani em-b2的3.46mg/l/h(he et al.,“new insight into the nitrogen removal capacity and mechanism of streptomyces mediolani em-b2”,biosource technology,2022,348,126819)和vibrio diabolicus sf16的2.29mg/l/h(duan et al.,“characterization of a halophilic heterotrophic nitrification-aerobic denitrification bacterium and its application on treatment of saline wastewater”,biosource technology,2015,179,421-428)。同时,总氮消耗效率为92.95%,对应的最大消耗速率为6.42mg/l/h,说明大部分铵态氮被转化为气态氮。连续培养18h后,由于死细胞的分解,铵浓度有升高的趋势(li et al.,“removal of nitrogen by heterotrophic nitrification-aerobic denitrification of a phosphate accumulating bacterium pseudomonas stutzeri yg-24”,biosource technology,2015,182,18-25),铵的积累降低了总氮的去除效率(84.72%)。在整个实验过程中,没有观察到羟胺和硝酸盐的积累,但在6h时检测到0.05mg/l的亚硝酸盐且培养12h后被耗尽,这种现象与菌株em-b2在硝化过程中检测到2.56mg/l的硝酸盐而不是亚硝酸盐的事实形成对比(he et al.,“new insight into the nitrogen removal capacity and mechanism of streptomyces mediolani em-b2”,biosource technology,2022,348,126819)。此外,ph值一直呈上升趋势(7.18→9.00),表明当en-j1仅使用铵态氮进行硝化时,也可以进行以亚硝酸盐为氮源的反硝化作用,这种现象与菌株en-f2的报道一致,其中en-f2在培养6小时后能检测到0.11mg/l的亚硝酸盐且在12小时后被耗尽(zhang et al.,“ammonium and hydroxylamine can be preferentially removed during simultaneous nitrification and denitrification by pseudomonas taiwanensis en-f2”,biosource technology,2022,350,126912)。总体而言,菌株en-j1在没有中间产物积累的情况下表现出优异的铵和总氮转化率,并高效地将大量铵转化为气态氮。菌株en-j1的这种短程铵转化途径有利于铵污染污水的彻底处理。[0048]由图4b可知,在最初接种的6小时内,没有观察到羟胺的下降趋势。反应18h后,菌株去除了初始浓度为22.73mg/l的羟胺11.30mg/l。随着反应时间延长至30小时,菌株en-j1消耗了99.96%的羟胺。羟胺的最大消除速率在18-24h之间达到1.22mg/l/h,虽然此速率低于pseudomonas taiwanensisen-f2的2.12mg/l/h(zhang et al.,“ammonium and hydroxylamine can be preferentially removed during simultaneous nitrification and denitrification by pseudomonas taiwanensis en-f2”,biosource technology,2022,350,126912)。但与报道的可以去除羟胺的hn-ad菌株中比较,例如glutamicibacter arilaitensis em-h8(chen et al.,“efficient hydroxylamine removal through heterotrophic nitrification by novel bacterium glutamicibacter arilaitensis em-h8”,chemosphere,2022,288(pt 1),132475)的0.21mg/l/h和photobacterium sp.nna4的0.7mmol/l/h(liu et al.,“photobacterium sp.nna4,an efficient hydroxylamine-transforming heterotrophic nitrifier/aerobic denitrifier”,journal of bioscience;bioengineering,2019,128(1),64-71)发现菌株en-j1能更高效地降解羟胺。在整个实验过程中,ph值和od600值基本保持稳定,总氮从22.44略微下降到20.66mg/l。此外,还观察到硝酸盐(4.06mg/l)和铵(1.86mg/l)的积累。同时,亚硝酸盐的产生在30h达到峰值13.62mg/l,说明菌株en-j1将大部分羟胺转化为亚硝酸盐而不是气态氮。这种现象与pseudomonas putida y-9菌株一致,但与acinetobacter calcoaceticus hnr不同(zhao et al.,“heterotrophic nitrogen removal by a newly isolated acinetobacter calcoaceticus hnr”,biosource technology,2010,101(14),5194-5200)。and aerobic denitrification by pseudomonas tolaasii y-11 without nitrite accumulation during nitrogen conversion”,biosource technology,2016,,200(1),493-499),pseudomonas putida y-12(3.25mg/l/h)(ye et al.,“heterotrophic nitrification-aerobic denitrification performance of strain y-12 under low temperature and high concentration of inorganic nitrogen conditions”,water,2017,9(11),835)和ochrobactrum anthropic lj81(4.12mg/l/h)(lei et al.,“simultaneous nitrification and denitrification without nitrite accumulation by a novel isolated ochrobactrum anthropic lj81”,biosource technology,2019,272,442-450)。同时,菌株en-j1以6.52mg/l/h的最大速率去除了86.84%的总氮,远高于上述所述的hn-ad菌株。此外,在亚硝酸盐还原过程中,铵的含量在30h时达到峰值4.42mg/l,铵的积累降低了总氮的去除效率(86.84%→75.88%),这种现象与streptomyces mediolani em-b2菌株相似(he et al.,“simultaneous nitrification and denitrification of hypersaline wastewater by a robust bacterium halomonas salifodinae from a repeated-batch acclimation”,biosource technology,2021b,341,125818.),这个过程没有检测到硝酸盐。随着细胞生长和亚硝酸盐的去除,ph从7.19持续增加至9.03,这进一步证实了菌株en-j1能够有效地执行反硝化过程。[0051](4)羟胺对hn-ad过程的影响研究[0052]为研究羟胺对hn-ad过程和菌株en-j1细胞生长的影响(研究羟胺对hn-ad的影响具体步骤见具体实施方式(3),对细胞生长的影响既可通过观察od600值的增长情况),将10mg/l的羟胺分别添加到含有硝酸盐、亚硝酸盐和铵盐的含氮培养基中(培养基组成:(每升,ph=7.20)honh3cl(0.0496g)、kno3 0.361g/nano2 0.246g/(nh4)2so4 0.236g、mgso4 0.04g,k2hpo4 3.5g、cacl2 0.014g、fe2(so4)3 0.009g、kh2po4 1.5g、c6h5na3o7·2h2o 3.676g),结果如图6所示。[0053]由图6a可知,当向硝酸盐培养基中加入羟胺时,在接种的最初12小时,羟胺从11.93下降到0mg/l,去除效率为100%,最大羟胺消耗速率可被计算为1.11mg/l/h,这与单一的羟胺去除系统获得的结果(1.22mg/l/h)接近,这些结果表明硝酸盐的存在对羟胺的去除几乎没有影响。由于羟胺氧化,硝酸盐浓度在12h内略微升高了2.07mg/l,然后在羟胺完全耗尽后迅速下降至6.20mg/l,这表明菌株en-j1优先进行以羟胺为氮源的硝化反应。菌株接种30h后,硝酸盐消耗率为89.56%,最大降解速率为7.78mg/l/h,明显优于单一硝酸盐去除系统的4.34mg/l/h。同时,菌株en-j1的细胞生长量为0.49-1.15,也高于单一硝酸盐反应体系。由此可以得出结论,当补充羟胺时,硝酸盐的最大速率被促进了3.44mg/l/h,od600值提高了0.48。羟胺对硝酸盐的积极作用与低剂量羟胺促进硝酸盐转化的结论一致(zhang et al.,“enhancement of nitrite production via addition of hydroxylamine to partial denitrification(pd)biomass:functional genes dynamics and enzymatic activities”,biosource technology,2020,318,124274)。随着羟胺和硝酸盐的消耗,ph值升高至9.11。总氮从72.09显着降低到18.20mg/l,对应的最大转化效率和速率分别为74.75%和8.50mg/l/h。tn去除速率也显着高于单一硝酸盐(5.41mg/l/h)和羟胺(0.60mg/l/h)。在整个实验过程中,仅观察到3.26mg/l的亚硝酸盐和3.53mg/l的铵盐积累。所有结果表明羟胺对硝酸盐和tn的去除表现出积极作用。[0054]由图6b可知,当使用羟胺和亚硝酸盐作为混合氮源时,首先可观察到菌株en-j1的停滞期,并且od600值在24小时内保持在0.45左右,随后在30小时迅速增加到1.18。与单独的亚硝酸盐去除系统相比,细胞od600被促进了0.51。ph从7.18增加到8.79。在此期间,初始含量为15.14mg/l的羟胺降解效率和最大去除速率分别为100%和1.01mg/l/h。该速率略低于单独使用羟胺时的速率(1.22mg/l/h),这表明亚硝酸盐对羟胺的消耗速率具有负面影响。尽管如此,亚硝酸盐对羟胺转化效率没有影响,这与pseudomonas taiwanensis en-f2的结果相同(zhang et al.,“ammonium and hydroxylamine can be preferentially removed during simultaneous nitrification and denitrification by pseudomonas taiwanensis en-f2”,biosource technology,2022,350,126912)。与混合羟胺和硝酸盐的现象相似,亚硝酸盐在24小时内随着羟胺的消耗而增加约4.0mg/l,然后在羟胺耗尽后降至2.54mg/l。亚硝酸盐的去除效率和最大降解速率分别达到95.22%和9.11mg/l/h。值得注意的是,添加羟胺后亚硝酸盐的去除速率(9.11mg/l/)远高于单一亚硝酸盐作为氮源的6.75mg/l/h。补充羟胺后亚硝酸盐转化速率提高了2.36mg/l/h,这与羟胺阻断亚硝酸盐消耗的报道相反(noophan et al.,“nitrite oxidation inhibition by hydroxylamine:experimental and model evaluation”,water science and technology:a journal of the international association on water pollution research,2004,50(6),295-304)。在脱氮过程中,仅积累了1.06mg/l的铵,而不是硝酸盐。总氮的最大消耗速率为8.69mg/l/h,补充羟胺可提高2.17mg/l/h。以上结果表明,羟胺的存在可以促进细胞生长、亚硝酸盐和总氮去除速率。[0055]由图6c可知,将大约10mg/l的羟胺添加到含铵培养基中。菌株en-j1在接种6小时后迅速增殖并进入对数期。od600的峰值在混合培养基中达到1.23,远远高于单一铵盐处理系统的峰值(0.87)。表明加入羟胺后,od600值被提高了0.36,在yu的研究中也发现了这一点(yu et al.,“in situ mature leachate treatment with hydroxylamine addition in the aerobic-anaerobic recirculation landfill”,science of the total environment,2019,696,134084)。羟胺耗尽,其最大速率达到1.54mg/l/h。由此可看出铵在羟胺去除过程中起到了促进的作用。同时,铵在前6h开始从48.19下降到35.11mg/l,然后又延迟至12h才能完全去除35.11mg/l的铵,最大降解速率为5.85mg/l/h。显然,与单独的铵盐降解(7.12mg/l/h)相比,添加羟胺降低了铵的去除速率,这意味着羟胺延缓了铵的转化。即便如此,铵仍然能在12小时被菌株完全去除。经仔细观察,在此过程中硝酸盐从0.53降至0mg/l,亚硝酸盐在6h时累积达到峰值7.06mg/l,然后降至0.28mg/l,ph增加到9.04,这暗示菌株en-j1在硝化过程中也进行了反硝化作用。此外,82.34%的总氮被去除,最大去除速率为6.34mg/l/h,接近于单一铵盐去除的6.42mg/l/h。这些结果表明羟胺对总氮去除没有负面影响,这与低水平羟胺可以促进tn去除效率的研究存在差异(zekker et al.,“accelerating effect of hydroxylamine and hydrazine on nitrogen removal rate in moving bed biofilm reactor”,biodegradatio,2012,23(5),739-749)。总体而言,羟胺的添加对铵和总氮的去除效率没有负面影响。[0056]综上,当在硝酸盐或亚硝酸盐培养基中添加低浓度羟胺(10mg/l)作为混合氮源时,菌株en-j1的细胞生长分别被提高了0.48和0.51。同时,硝酸盐和亚硝酸盐的降解速率分别提高了3.44和2.36mg/l/h,相应的总氮去除速率也被分别提高了3.09和2.1mg/l/h。然而,羟胺的存在对铵的去除效率没有影响。[0057](5)亚硝酸盐对hn-ad过程的影响研究[0058]为研究亚硝酸盐对hn-ad过程和菌株en-j1细胞生长的影响(方法见具体实施方案(3))。将55.97mg/l的亚硝酸盐添加到含有硝酸盐的含氮培养基中(培养及成分:nano2 0.246、kno3 0.361g/(nh4)2so4 0.236g、mgso4 0.04g、k2hpo4 3.5g、cacl2 0.014g、fe2(so4)3 0.009g、kh2po4 1.5g、c6h5na3o7·2h2o 6.127g),结果如图7a所示;[0059]为研究亚硝酸盐对hn-ad过程和菌株en-j1细胞生长的影响(方法见具体实施例(3)),将高比例的亚硝酸盐和铵作为混合氮源添加到含有硝酸盐的含氮培养基中(培养基:nano2 0.246、(nh4)2so4 0.236g、mgso4 0.04g、k2hpo4 3.5g、cacl2 0.014g、fe2(so4)3 0.009g、kh2po4 1.5g、c6h5na3o7·2h2o 6.127g),结果如图7b所示。[0060]由图7可知,在硝酸盐反应体系中加入高剂量亚硝酸盐(55.97mg/l)后。在最初的6小时内,亚硝酸盐在en-j1菌株存在下下降了3.51mg/l。亚硝酸盐和硝酸盐的降解速率分别在6-12小时之间达到峰值4.31和5.34mg/l/h。与单一硝酸盐处理系统相比,加入亚硝酸盐后硝酸盐去除速率提高了1.0mg/l/h,说明亚硝酸盐的存在促进了硝酸盐的消耗,这一结果与菌株pseudomonas taiwanensis en-f2(zhang et al.,“ammonium and hydroxylamine can be preferentially removed during simultaneous nitrification and denitrification by pseudomonas taiwanensis en-f2”,biosource technology,2022,350,126912)的报告相反,其中硝酸盐去除速率受到亚硝酸盐添加的抑制。然而,硝酸盐对亚硝酸盐表现出抑制作用,这与thauera sp.snd5的结果一致(wang and he.,“complete nitrogen removal via simultaneous nitrification and denitrification by a novel phosphate accumulating thauera sp.strain snd5”,water research,2020,185,116300)。伴随着亚硝酸盐和硝酸盐的去除,菌株en-j1生长迅速,接种30h后od600值达到峰值1.32。ph值从7.19直线上升到9.21。高浓度总氮被消耗64.52%,最高消耗速率为9.25mg/l/h,明显快于单一硝酸盐(5.41mg/l/h)或亚硝酸盐(6.52mg/l/h)处理系统。在整个实验过程中,仅发现低浓度的铵(3.12mg/l)积累。这些结果表明,添加亚硝酸盐可提高细胞生长、硝酸盐和总氮的最大转化速率。这一结论显然与先前大多数关于亚硝酸盐抑制氮去除过程的报道相矛盾。[0061]由图7b可知,将高比例的亚硝酸盐和铵作为混合氮源,在最初的6小时内铵被转化了98.50%。在铵态氮降解的过程中,随着细胞从0.22到0.57的生长,亚硝酸盐浓度增加了4.00mg/l,表明在这个混合体系中优先进行以铵为氮源的硝化作用且被转化为亚硝酸盐,这与报道的铵和亚硝酸盐可以被菌株retomyces mediolani em-b2一起降解的报道不同(he et al.,“new insight into the nitrogen removal capacity and mechanism of streptomyces mediolani em-b2”,biosource technology,2022,348,126819)。亚硝酸盐(4.00mg/l)的增加和消失表明菌株en-j1可以通过nh4+-n→no2-‑n→气体的途径去除铵。反应18h后,铵被耗尽,且最高速率为7.77mg/l/h。加入亚硝酸盐后,这部分的铵盐速率略微提高了0.65mg/l/h,这与菌株ochrobactrum anthropic lj81的结果相似(lei et al.,“simultaneous nitrification and denitrification without nitrite accumulation by a novel isolated ochrobactrum anthropic lj81”,biosource technology,2019,272,442-450)。亚硝酸盐大幅降低至29.54mg/l,在6至12h之间检测到相应的最大降解速率为4.54mg/l/h。与单一的亚硝酸盐去除系统(6.75mg/l/h)相比,在混合培养基中的去除速率较低。毫无疑问,在铵的存在下表现出对亚硝酸盐去除的抑制作用,这与he等人(2017)报道的arthrobacter arilaitensis y-10菌株形成对比。当用混合亚硝酸盐和铵培养时,菌株en-j1不产生硝酸盐。随着氮的去除,ph从7.18增加到9.32。此外,初始浓度为99.05mg/l的总氮去除率为56.15%,去除速率最高为5.49mg/l/h,低于单一铵(6.42mg/l/h)或亚硝酸盐(6.51mg/l/h)作为氮源的速率。以上结果表明,虽然总氮的去除率没有提高,但亚硝酸盐的添加促进了铵的去除速率和细胞生长。[0062]综上所述,额外添加50mg/l的亚硝酸盐,硝酸盐和铵盐的转化速率分别被提高了1和0.65mg/l/h,且观察到相应的细胞生长分别增加了0.65和0.5。因此,羟胺和亚硝酸盐的存在可以提高无机氮的去除速率,这对于污水的彻底处理具有很大的优势。[0063](6)氮平衡分析[0064]将菌液接种在lb培养基中于25℃、转速150rpm的条件下培养24h,分别接种至铵(nh4+-n)、羟胺(nh2oh)、硝酸盐(no3-‑n)和亚硝酸盐(no2-‑n)培养基中。接种开始时,将混合菌液(6ml)以6500rpm离心5min,然后在条件为300w功率和3s工作/间隔时间的scientz-iid超声波下破碎15min后得到悬液。然后用0.22mm滤膜过滤得到上清液,接着测定nh4+-n、nh2oh、no3-‑n和no2-‑n的含量和总氮(tn1)。nh4+-n、nh2oh、no3-‑n和no2-‑n培养12、30、18和18h后,收集新的上清液,重复上述测定无机氮和总氮(tn2)操作步骤。所有相关的氮含量计算如下:[0065](1)n-有机=tn2(破前)-胞外nh4+-胞外nh2oh-胞外no2-‑胞外no3-;[0066](2)n-胞内=tn2(破后)-胞外有机n-胞外无机氮;[0067](3)氮损失(%)=[(tn1-tn2)/tn1]×100%;[0068]结果如表1所示。[0069]表1 hn-ad的氮平衡结果[0070][0071][0072]由表1可知,铵、羟胺、亚硝酸盐和硝酸盐的氮平衡分析计算结果见表1。羟胺的初始总氮水平为28.31mg/l,铵、硝酸盐和亚硝酸盐的初始总氮浓度约为54mg/l。连续培养12h后,初始铵态氮损失75.55%,表明形成气态氮是en-j1菌株去除铵的主要途径。更重要的是,tn损失效率明显高于acinetobacter calcoaceticus hnr的40.20%(zhao et al.,“n2o and n2 production during heterotrophic nitrification by alcaligenes faecalis strain nr”,biosource technology,2010,116,379-385)和exiguobacterium mexicanum snd-01的27.11%(cui et al.,“a novel halophilic exiguobacterium mexicanum strain removes nitrogen from saline wastewater via heterotrophic nitrification and aerobic denitrification”,biosource technology,2021,333,125189)。在铵态氮氧化过程中,能检测到胞内氮(8.74±0.06)和有机氮(4.34±0.49),但没有观察到羟胺、亚硝酸盐和硝酸盐的积累,这与上述描述的单一铵态氮氧化步骤一致。同时,结合以铵为单一氮源时在6h能检测到亚硝酸盐,12h完被全消耗的现象,可进一步证明铵的氧化途径为nh4+-n→no2-‑n→气态氮。在羟胺氮平衡检测过程中,未观察到氮损失,因为培养30h后羟胺全部转化为其他氮形式,其中检测到1.43mg/l的铵,11.56mg/l的亚硝酸盐,1.62mg/l的硝酸盐。这些结果与菌株glutamicibacter arilaitensis em-h8(chen et al.,“efficient hydroxylamine removal through heterotrophic nitrification by novel bacterium glutamicibacter arilaitensis em-h8”,chemosphere,2022,288(pt 1),132475)和alcaligenes faecalis nr(zhao et al.,“n2o and n2 production during heterotrophic nitrification by alcaligenes faecalis strain nr”,biosource technolog,2012,116,379-385)不可观察到亚硝酸盐的报道相反。这些中间产物的积累进一步证明了羟胺氧化的途径是nh2oh→no2-‑n→no3-‑n。[0073]此外,用硝酸盐培养基培养菌株en-j1 18h后,初始总氮损失约55.17%,其中4.80mg/l转化为有机氮,说明菌株将大部分硝酸盐还原为气态氮,初始总氮的氮损失高于pseudomonas mendocina lyx(51.90%)(li et al.,“pseudomonas mendocina lyx:a novel aerobic bacterium with advantage of removing nitrate high effectively by assimilation and dissimilation simultaneously”,frontiers of environmental science;engineering,2020,15(4),57)和acinetobacter sp.yt03(28.33%)(li et al.,“a novel nitrite-base aerobic denitrifying bacterium acinetobacter sp.yt03 and its transcriptome analysis”,frontiers in microbiology,2019,10,2580)。通过中间产物的检测,发现硝酸盐还原过程积累了低浓度的铵(1.28mg/l)和亚硝酸盐(1.99mg/l),进一步证实硝酸盐还原途径为no3-‑n→no2-‑n→气态氮。同样,菌株en-j1可以将大部分亚硝酸盐转化为气态氮,氮损失达到60.77%。这明显高于streptomyces mediolani em-b2的38.88%的结果(he et al.,“new insight into the nitrogen removal capacity and mechanism of streptomyces mediolani em-b2”,biosource technology,2022,348,126819)。迄今为止,很少有研究报道hn-ad菌株具有将大量亚硝酸盐转化为气体的能力。此外,检测到3.16mg/l的有机氮和2.42mg/l的铵。根据以上结果,可以推断亚硝酸盐的去除途径为no2-‑n→气态氮。上述所有观察结果表明,铵、硝酸盐和亚硝酸盐主要通过菌株en-j1转化为气态氮,以实现高效的hn-ad过程。[0074](7)hn-ad酶活性检测[0075]在用单一的铵、羟胺、硝酸盐和亚硝酸盐培养基培养5、21、10和10(四个时间分别对应四个氮源的培养时间)小时后在6500rpm条件下离心5分钟收集菌株en-j1。bca细菌蛋白质测定试剂盒(solarbio)用于测定菌株en-j1粗提物中的蛋白质浓度。氨单加氧酶(amo)酶活性送至公司(wela)检测,亚硝酸盐还原酶(nir)由亚硝酸盐还原酶活性测定试剂盒(comin)测定。对于硝酸还原酶(nr)活性测定,反应体系(20ml)含有硝酸盐、酶提取物、tris-hcl和nadh。nr的酶活性通过在25℃条件下反应15min后硝酸盐的消失来评价。此外,含有酶提取物、羟胺、铁氰化钾、edta和tris-hcl的20ml反应混合物用于羟胺氧化酶(hao)活性评价,以降低羟胺含量作为检测hao活性的方法。以不添加酶提取物的体系设计为对照组。比活性(u/mg)计算为每分钟降解1μmol底物所需的酶量除以蛋白质浓度,结果如表2所示。[0076]数据处理[0077]本发明的所有实验数据为:使用波长为600nm的紫外分光光度计(metash uv-6000,中国)监测细菌溶液浓度。细菌经培养和离心后的获得的上清液分别采用碱性过硫酸钾消化-紫外分光光度法、靛酚蓝、8-羟基喹啉紫外分光光度法、紫外分光光度法、n-(1-萘基)-乙二胺光度法测定总氮、铵、羟胺、硝酸盐和亚硝酸盐的含量(guo et al.,“application potential of a newly isolated indigenous aerobic denitrifier for nitrate and ammonium removal of eutrophic lake water”,biosource technology2013,142,45-51)。ph值通过ph计(dds-307a,中国)测定。所有实验数据和图均通过spss statistics、excel、mega 7.0和origin2021软件进行处理,并以均值±标准差形式表示。[0078]表2 hn-ad的比活性[0079][0080]根据以往的报道,amo、hao、nr和nir的酶活性分别与铵和羟胺的氧化以及硝酸盐和亚硝酸盐的还原有关(ren et al.,“the characteristics of a novel heterotrophic nitrifying and aerobic denitrifying bacterium,acinetobacter junii yb”,biosource technology,2014,171,1-9)。因此,相关酶的成功表达可以验证细菌的hn-ad途径。目前,尚未见关于acinetobacter johnsonii hn-ad相关酶活性的报道。由表2可知,amo、hao、nr和nir的比活性分别被成功检测为0.54、0.15、0.14和0.01u/mg proteins(表2)。相比之下,amo酶表现出最高的比活性,这进一步证实了铵的最大降解速率(7.12mg/l/h)。更重要的是,这些酶在en-j1菌株中的比活性明显高于先前报道的菌株。例如,尽管菌株em-b2(0.12u/mg protein)的nr活性与en-j1显示出近似值(0.15u/mg protein),但amo(0.43u/mg protein)和nir(0.005u/mg protein)活性显著低于en-j1(he et al.,“new insight into the nitrogen removal capacity and mechanism of streptomyces mediolani em-b2”,biosource technology,2022,348,126819)。pseudomonas taiwanensisj488的hao和nr酶活性较低,分别为0.049和0.091u/mg proteins(he et al.,“nitrous oxide produced directly from ammonium,nitrate and nitrite during nitrification and denitrification”,journal of hazardous materials,2020,388,122114)。从pseudomonas putida np5(yang et al.,“simultaneous removal of nitrogen and phosphorous by heterotrophic nitrification-aerobic denitrification of a metal resistant bacterium pseudomonas putida strain np5”,biosource technology,2019,285,121360)中仅获得了hao和nr的0.039和0.021u/mg proteins,从halomonas salifodinae中获得了amo、hao和nr的0.053、0.051和0.023u/mg proteins(hu et al.,“simultaneous nitrification and denitrification of hypersaline wastewater by a robust bacterium halomonas salifodinae from a repeated-batch acclimation”,biosource technology,2021,341,125818.)。amo、hao、nr和nir酶的高活性进一步证实了菌株en-j1优异的hn-ad能力。[0081]综上,菌株acinetobacter johnsoniien-j1具有优异的脱氮能力。铵、羟胺、硝酸盐和亚硝酸盐的最大转化速率分别高达7.12、1.22、4.34和6.75mg/l/h。更重要的是,羟胺和亚硝酸盐的添加能增强菌株en-j1的hn-ad能力。添加10mg/l羟胺后,硝酸盐和亚硝酸盐的去除速率分别提高了3.44和2.36mg/l/h,添加50mg/l亚硝酸盐,硝酸盐和铵盐的转换速率分别增加了1和0.65mg/l/h。此外,成功检测到hn-ad中涉及的相关酶,分别为0.54、0.15、0.14和0.01u/mgproteins。氮平衡结果表明,当污水中含有铵、硝酸盐或亚硝酸盐时,超过55%的初始tn可以被转化为气态氮。总之,菌株en-j1在混合氮污染污水处理中表现出潜在的应用价值。[0082]此外,应当理解,虽然本说明书按照实施方式加以描述,但并非每个实施方式仅包含一个独立的技术方案,说明书的这种叙述方式仅仅是为清楚起见,本领域技术人员应当将说明书作为一个整体,各实施例中的技术方案也可以经适当组合,形成本领域技术人员可以理解的其他实施方式。 |
【本文地址】