| 这 42 个新药,获批临床了 | 您所在的位置:网站首页 › PG-011凝胶普祺 › 这 42 个新药,获批临床了 |
这 42 个新药,获批临床了
|
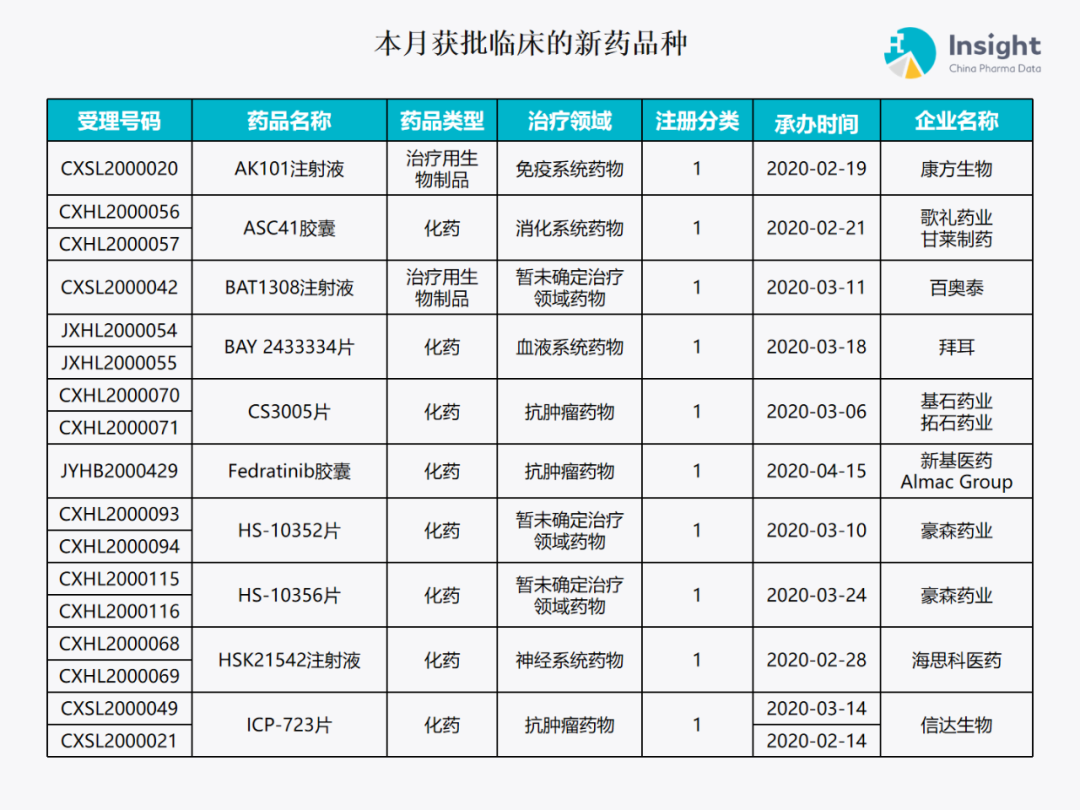
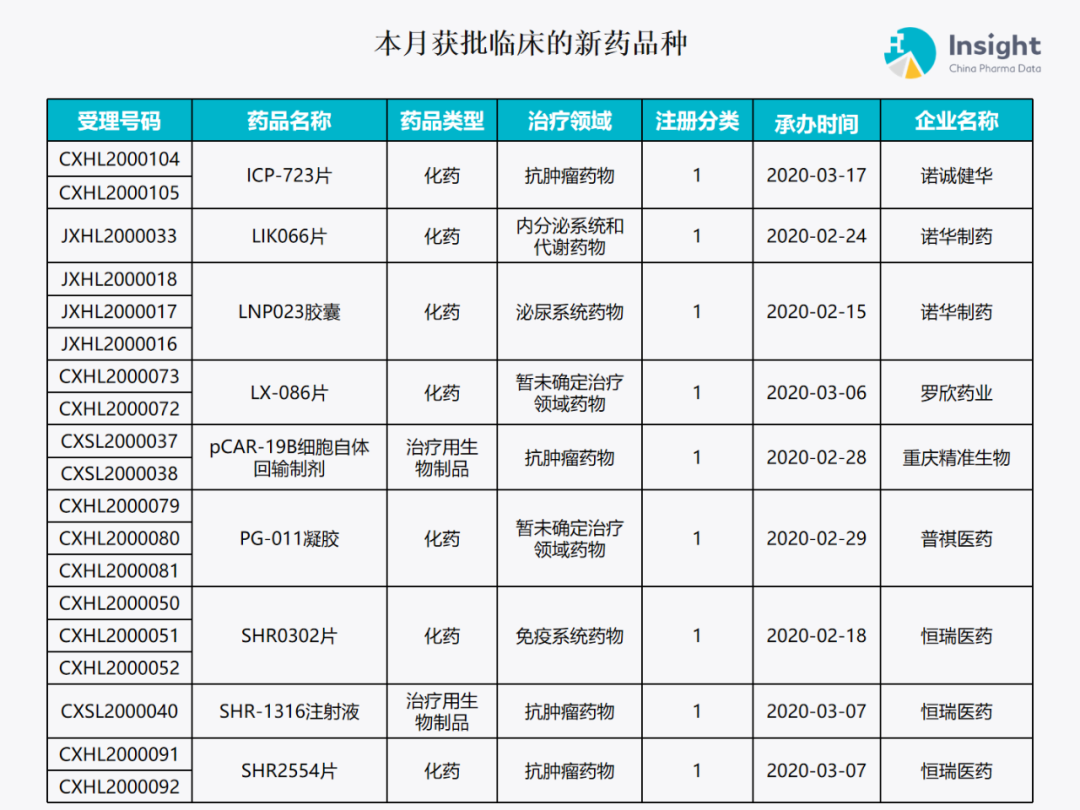
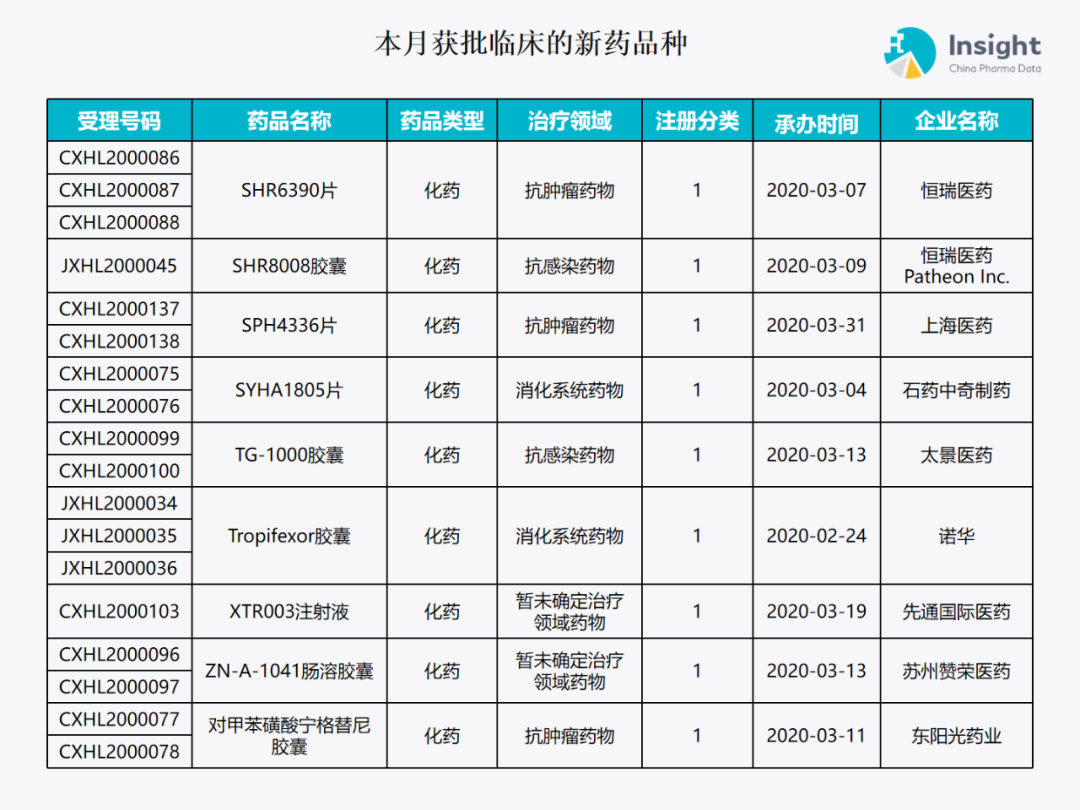
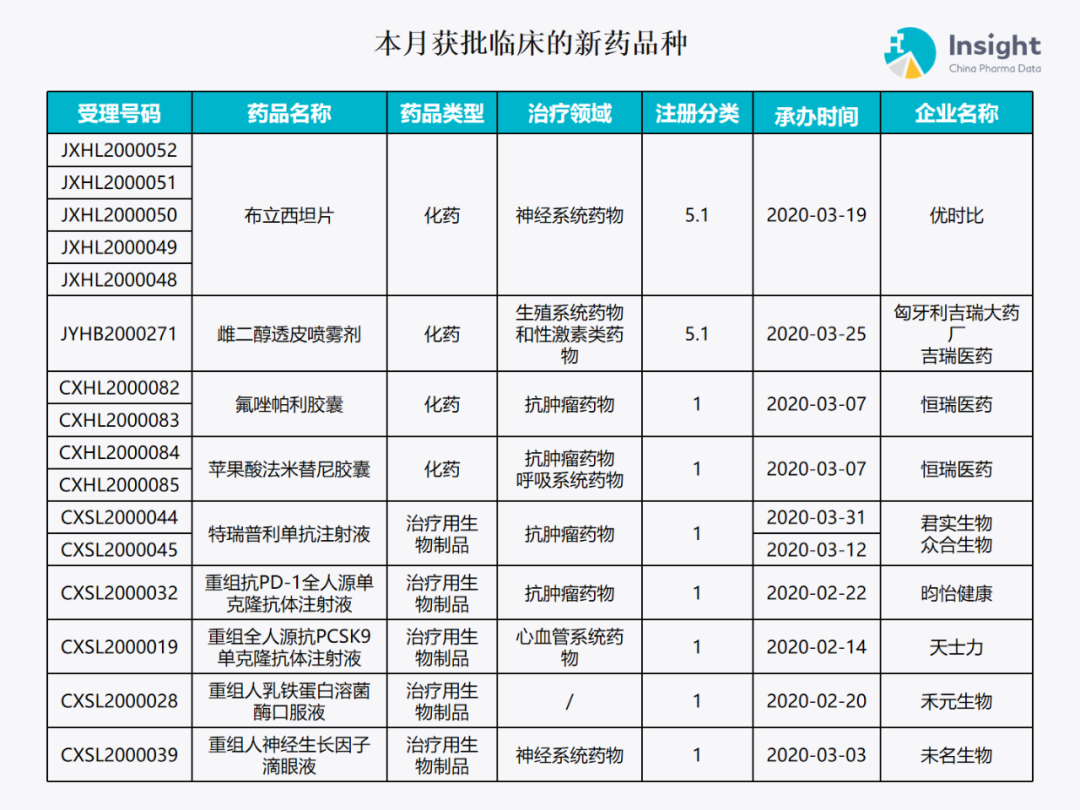
5 月份获批临床报告 ◆ 5 月获批临床的新药共有 79 个受理号,涉及 42 个品种(附名单) 本报告数据来源:Insight 数据库、CDE 药物临床试验登记与信息公示
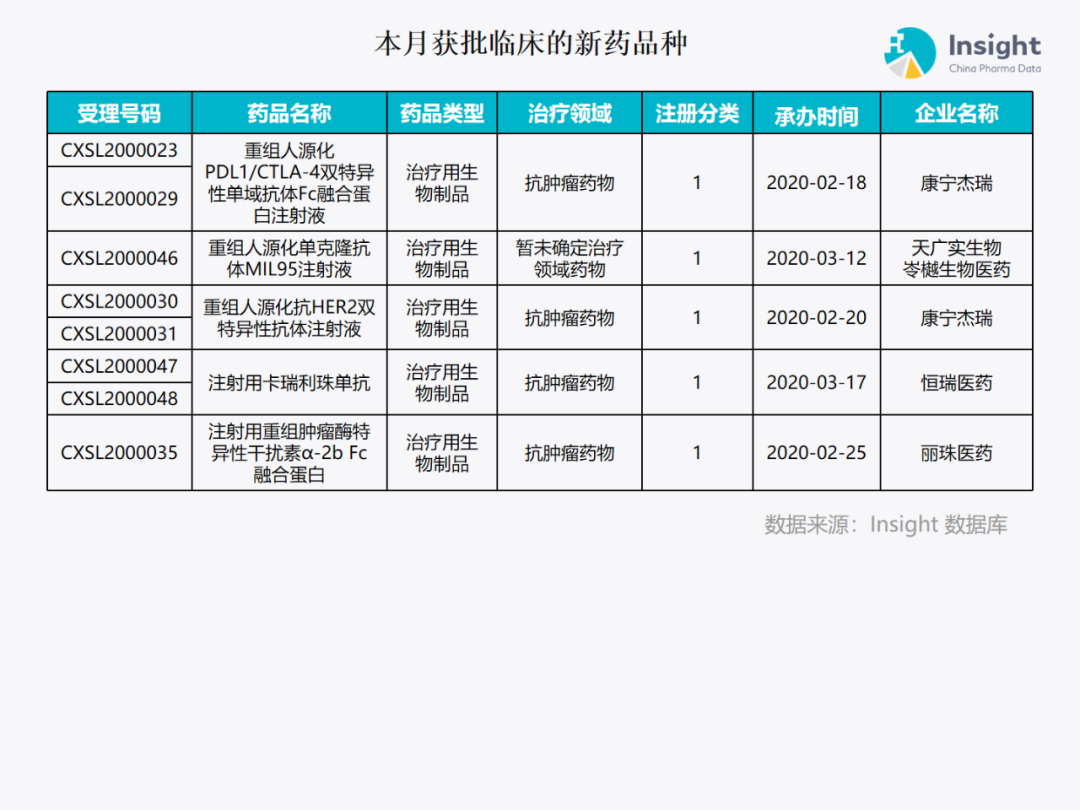
本月获批临床新药品种 Insight 数据库(https://db.dxy.cn)申报进度库显示,2020 年 5 月获批临床的新药共有 79 个受理号,涉及 42 个品种,下图为具体名单: ↓点击查看大图
下面是本月获批临床批准的 42 个品种的具体介绍,介绍顺序和图表一致,文章略长,可选择性阅读哟。
获批临床新药具体介绍 药品名称:AK101 注射液 企业名称:康方生物 AK101 注射液是康方自主研发国内首个用于治疗银屑病、溃疡性结肠炎和其他自身免疫性疾病的抗 IL12/IL23p40 单克隆抗体新药。IL-12 和 IL-23 在免疫介导的炎症性疾病中发挥了关键作用。AK101 通过阻断细胞因子 IL-12 和 IL-23 的生物学活性,以达到临床治疗自身免疫性疾病的作用。目前该药已完成中重度斑块型銀屑病的 I/II 期临床研究,正在进行剂量范围 IIb 期临床研究。本次获批适应症为:溃疡性结肠炎。 药品名称:ASC41 胶囊 企业名称:歌礼药业、甘莱制药 ASC41 胶囊是歌礼研发的一款口服甲状腺激素β受体(THR-beta)激动剂,本次获批适应症为:非酒精性脂肪性肝炎。 药品名称:BAT1308 注射液 企业名称:百奥泰生物 BAT1308 是百奥泰生物的第二款在研 PD-1 单抗,本次获批适应症为:肝癌、肺癌等实体瘤。 药品名称:BAY 2433334 片 企业名称:拜耳医药 BAY 2433334 片是拜尔的一款 Factor XIa(FXLa) 抑制剂,尚未在任何国家和地区获批上市。FXLa 被认为是抗凝药物研究的重要靶点,目前 BAY 2433334 片在全球范围开展 3 项 2 期临床研究,涉及的适应症包括急性心肌梗塞、急性非心源性缺血性中风、房颤。本次获批适应症为:急性非心源性梗塞型脑卒中后患者的卒中二级预防。 药品名称:CS3005 片 企业名称:基石药业、拓石药业 CS3005 是基石药业开发的一种腺苷 A2a 受体拮抗剂,属于肿瘤免疫微环境调节剂。CS3005 可通过阻断腺苷和其腺苷 A2a 受体结合,进而逆转腺苷的免疫抑制作用,激活免疫反应并提高对免疫检查点抑制剂的响应率。本次获批适应症为:联合其他药物(如抗 PD-1 单抗、蛋白酶体抑制剂等)用于多种晚期实体瘤的治疗。 药品名称:Fedratinib 胶囊 企业名称:新基医药、Almac Group Fedratinib 胶囊(Inrebic)是新基医药的一种高度特异性 JAK2 抑制剂。本次获批适应症为:骨髓纤维化。 药品名称:HS-10352 片 企业名称:豪森药业、翰森生物 HS-10352 片是豪森药业开发的一款化学 1 类新药,本次获批适应症为:拟用于治疗磷脂酰肌醇 3 激酶α型突变阳性(PIK3CA+)、激素受体阳性(HR+)、人表皮生长因子受体 2 阴性(HER2-)的晚期乳腺癌。 药品名称:HS-10356 片 企业名称:豪森药业、翰森生物 HS-10356 片是豪森药业的 1 类新药。本次获批适应症为:拟用于治疗非酒精性脂肪性肝炎 (NASH)。 药品名称:HSK21542 注射液 企业名称:海思科医药 HSK21542 注射液是海思科开发的 1 类新药,拟用于急慢性疼痛和瘙痒症治疗。该药为外周 kappa 受体的选择性激动剂,具有强效的抑制瘙痒作用,且不易透过血脑屏障,在发挥外周止痒药效的同时,能避免中枢阿片类药物相关副作用,如致幻、成瘾、呼吸抑制等。此次获批适应症为:瘙痒症。 药品名称:IBI112 企业名称:信达生物 IBI112 是信达生物的 IL-23 单抗,此前该药已获批开展克罗恩病、溃疡性结肠炎等自身免疫性疾病临床试验。本次获批适应症为:银屑病。 药品名称:ICP-723 片 企业名称:诺诚健华医药 ICP-723 是第二代泛 TRK 小分子抑制剂,用于治疗不同肿瘤类型的 NTRK 融合阳性癌症患者,以及由于第一代 TRK 抑制剂治疗的获得性耐药患者。本次获批适应症为:用于携带 NTRK 融合基因的晚期或转移性实体瘤的治疗。 药品名称:LIK066 片 企业名称:诺华制药 LIK066(licogliflozin)是一种 SGLT1/2 抑制剂。本次获批适应症为:与 Tropifexor 胶囊联合治疗非酒精性脂肪性肝炎(NASH)。 药品名称:LNP023 胶囊 企业名称:诺华制药 LNP023 是诺华一款口服、特异性「first-in-class」补体因子 B 抑制剂,可通过靶向补体替代信号通路,阻断血管内和血管间溶血。本次获批适应症为:特发性膜性肾病(IMN)。 药品名称:LX-086 片 企业名称:罗欣药业 LX-086 片是罗欣药业的 PI3Kα选择性抑制剂,通过抑制 PI3K-Akt-mTOR 信号通路,进而抑制肿瘤细胞的过度增殖,达到治疗各种实体肿瘤的目的,同时还能避免影响 PI3K 蛋白其它亚基的正常功能,从而减少药物安全性风险。本次获批适应症为:拟用于晚期实体瘤的治疗。 药品名称:pCAR-19B 细胞自体回输制剂 企业名称:重庆精准生物 pCAR-19B 细胞自体回输制剂由重庆精准生物自主研发,针对 CD19 阳性 B 细胞起源的恶性血液系统疾病的细胞免疫治疗产品。本次获批适应症为:适用于治疗 22-70 岁患有 CD19 阳性复发/难治性 B 细胞急性淋巴细胞白血病患者;适用于 75 岁及以下复发/难治性 CD19 阳性弥漫大 B 细胞淋巴瘤、滤泡性淋巴瘤和套细胞淋巴瘤患者。 药品名称:PG-011 凝胶 企业名称:普祺医药 暂未查到该品种详细信息。本次获批适应症为:特应性皮炎。 药品名称:SHR0302 片 企业名称:恒瑞医药 SHR0302 为恒瑞的小分子 JAK 激酶选择性抑制剂。本次获批适应症为:治疗传统合成缓解病情抗风湿药物(csDMARDs)反应不佳的中重度活动性类风湿性关节炎(RA)。 药品名称:SHR-1316 注射液 企业名称:恒瑞医药、盛迪亚生物 SHR-1316 注射液是一款人源化抗 PD-L1 单克隆抗体,主要用于恶性肿瘤的治疗,目前,恒瑞在国内开展了分别用于小细胞肺癌、广泛期小细胞肺癌及晚期恶性肿瘤的临床研究。本次获批适应症为:联合氟唑帕利胶囊及替莫唑胺胶囊治疗复发性小细胞肺癌。 药品名称:SHR2554 片 企业名称:恒瑞医药 SHR2554 是恒瑞医药开发的新型、高效、选择性的口服 EZH2 抑制剂,拟被应用于恶性肿瘤的治疗。本次获批适应症为:联合卡瑞利珠单抗、苹果酸法米替尼用于晚期恶性肿瘤患者。 药品名称:SHR6390 片 企业名称:恒瑞医药 SHR6390 是恒瑞医药研发一种高选择性小分子 CDK4/6 抑制剂,用于恶性肿瘤的治疗。主要通过抑制 CDK4/6 的活性,使细胞周期阻滞于 G0/G1 期,从而发挥抗肿瘤作用。本次获批适应症为:用于 HR 阳性、HER2 阴性局部晚期或晚期转移性乳腺癌女性患者。 药品名称:SHR8008 胶囊 企业名称:恒瑞医药、Patheon Inc. SHR8008 胶囊是恒瑞去年花近 1.1 亿美元从美国 Mycovia 公司引进的新药,用于治疗和预防多种真菌感染,包括复发性外阴阴道念珠菌病、侵袭性真菌感染和甲真菌病等疾病。本次获批适应症为:用于治疗复发性外阴阴道假丝酵母菌病(RVVC)。 药品名称:SPH4336 片 企业名称:上海医药集团 SPH4336 片是上海医药自主研发的化药 1 类小分子创新药,临床前研究表明该药物具有更优的体内外抗肿瘤活性和更好的安全性。本次获批适应症为:晚期实体瘤。 药品名称:SYHA1805 片 企业名称:石药集团中奇制药 SYHA1805 片是一种新型小分子激动剂,目前全球尚无同类产品上市。临床前研究显示,该产品药效靶点选择性高,可显着改善肝纤维化。本次获批适应症为:拟用于非酒精性脂肪性肝炎(NASH)。 药品名称:TG-1000 胶囊 企业名称:太景医药 TG-1000 胶囊是太景医药研发的抗流感新药,属于抢帽机制抑制剂 (Cap-Snatching inhibitor),可有效对抗 A 型,B 型流感及禽流感;且不受 48 小时内服药黄金期之限制,在症状出现 72 小时后服药仍然有效;也不易受到流感病毒变异的影响而产生抗药性。临床前试验的结果显示,TG-1000 胶囊效果远优于罗氏的(Oseltamivir,Tamiflu®),并且与日本盐野义的(Baloxavir,Xofluza®)抑制效果相当。本次获批适应症为;成人甲型和乙型流感。 药品名称:Tropifexor 胶囊 企业名称:诺华(中国)生物医学研究 Tropifexor 是一款法尼醇 X 受体(FXR)激动剂,在临床试验中能够剂量依赖性降低患者肝脏脂肪水平,血清转氨酶水平以及患者体重。本次获批适应症为:与 LIK066 片联合用于非酒精性脂肪性肝炎的治疗。 药品名称:XTR003 注射液 企业名称:北京先通国际医药 暂未查到该药详信息。本次细获批适应症为:冠状动脉疾病和左心室功能不全的 PET 显像。 药品名称:ZN-A-1041 肠溶胶囊 企业名称:赞荣医药 小分子靶向药 ZN-A-1041 是赞荣医药开发的化学 1 类新药,本次获批适应症为:拟用于治疗 HER2 阳性晚期实体瘤。 药品名称:对甲苯磺酸宁格替尼胶囊 企业名称:东阳光药业 对甲苯磺酸宁格替尼 (CT053) 是东阳光药业自主研发的多靶点小分子激酶抑制剂,既可直接抑制肿瘤生长,又可通过阻断肿瘤新生血管的形成而间接抑制肿瘤细胞的生长。本次获批适应症为:拟与重组人源化 PD-L1/CTLA-4 双特异性抗体 KN046 联合用于晚期肝细胞癌和非小细胞肺癌。 药品名称:布立西坦片 企业名称:优时比制药 布立西坦片是优时比的突触小泡蛋白 2A(SV2A),本次获批适应症为:适用于成人及≥16 岁青少年癫痫患者伴有或不伴有继发性全面性发作的部分性发作的联合治疗。 药品名称:雌二醇透皮喷雾剂 企业名称:匈牙利吉瑞大药厂、吉瑞医药(中国) 该药是雌二醇的定量透皮喷雾剂。本次获批适应症为;用于绝经后妇女(最后一次月经后至少 6 个月或采取手术绝经(有或没有子宫)雌激素缺乏症状的激素替代治疗(HRT)。 药品名称:氟唑帕利胶囊 企业名称:恒瑞医药 氟唑帕利是恒瑞医药研发的一种新型口服 PARP 抑制剂,可特异性杀伤 BRCA 突变的肿瘤细胞,目前恒瑞已启动关于氟唑帕利的 13 项不同阶段临床研究,涉及晚期实体瘤、晚期胃癌、晚期胰腺癌、复发性卵巢癌等多个瘤种。本次获批适应症为:联合替莫唑胺±抗 PD-L1 抗体 SHR-1316 治疗复发性小细胞肺癌。 药品名称:苹果酸法米替尼胶囊 企业名称:恒瑞医药 苹果酸法米替尼胶囊是恒瑞自主研发的小分子多靶点酪氨酸激酶抑制剂,对多种受体酪氨酸激酶有很好的抑制活性。本次获批适应症为:联合 SHR6390 治疗晚期实体瘤患者。 药品名称:特瑞普利单抗注射液 企业名称:君实生物、众合生物 特瑞普利单抗注射液是我国首个自主研发的 PD-1 单抗,由君实生物研发。本次获批适应症为:用于治疗既往接受过治疗的局部进展或转移性尿路上皮癌(UC)。 药品名称:重组抗 PD-1 全人源单克隆抗体注射液 企业名称:昀怡健康 本品是昀怡健康旗下的重组抗 PD-1 全人源单克隆抗体。本次获批适应症为:恶性肿瘤。 药品名称:重组全人源抗 PCSK9 单克隆抗体注射液 企业名称:天士力生物 天士力生物研发的重组全人源抗 PCSK9 单克隆抗体注射液能特异性结合 PCSK9(Proprotein Convertase Subtilisin /Kexin Type 9,前蛋白转化酶枯草溶菌素 9),有效抑制 PCSK9 的功能、降低血浆中低密度脂蛋白胆固醇(LDL-C)水平,解决他汀类药物副作用以及患者已接受最大剂量他汀类药物治疗但 LDL-C 仍未达标的问题,从而显著降低动脉粥样硬化性心血管疾病(ASCVD)的发病及死亡风险。本次获批适应症为:治疗高胆固醇血症。 药品名称:重组人乳铁蛋白溶菌酶口服液 企业名称:禾元生物 重组人乳铁蛋白溶菌酶口服液(HY1002 项目)是禾元生物利用 OryzHiExp 和纯化技术平台 OryzPur,研发的适用于治疗轮状病毒引起的儿童感染性腹泻、并具有抗细菌感染引起腹泻的重组蛋白质药物,是业内首个对因治疗病毒性腹泻的创新生物药。本次获批适应症为:用于轮状病毒引起的儿童感染性腹泻。 药品名称:重组人神经生长因子滴眼液 企业名称:未名生物 神经生长因子(NGF)是一种对神经细胞起营养作用的蛋白分子,NGF 由人体自然产生,在神经细胞的生长发育、递质的合成、轴突的生长及细胞的凋亡等阶段起着重要作用。本次获批适应症为:干眼症。 药品名称:重组人源化 PDL1/CTLA-4 双特异性单域抗体 Fc 融合蛋白注射液 企业名称:康宁杰瑞生物 该款双抗由康宁杰瑞采用自主知识产权的 Fc 异二聚体平台技术和共同轻链开发,该抗体在完整保留 Fc 功能的同时,可有效识别两个不同的 HER2 表位。与罗氏的 Herceptin + Perjeta 联合用药相比,临床前药效研究显示 KN026 具有优效或等效的作用,对 Her2 低表达和 Herceptin 抗性肿瘤株也有抑制效果。本次获批适应症为:联合重组人源化抗 HER2 双特异性抗体注射液用于 HER2 阳性或表达实体瘤,包括但不限于 HER2 阳性或表达乳腺癌、胃癌、食管癌、结直肠癌、胰腺癌、胆管癌、卵巢癌、尿路上皮癌、肺癌的治疗。 药品名称:重组人源化单克隆抗体 MIL95 注射液 企业名称:天广实生物、华放天实生物制药、岺樾生物医药 暂未查到该药详细信息。本次获批适应症为:淋巴瘤、急性髓系白血病、晚期结直肠癌、卵巢癌等。 药品名称:重组人源化抗 HER2 双特异性抗体注射液 企业名称:康宁杰瑞生物 本次获批适应症为:联合重组人源化 PDL1/CTLA-4 双特异性单域抗体 Fc 融合蛋白注射液用于 HER2 阳性或表达实体瘤,包括但不限于 HER2 阳性或表达乳腺癌、胃癌、食管癌、结直肠癌、胰腺癌、胆管癌、卵巢癌、尿路上皮癌、肺癌的治疗。 药品名称:注射用卡瑞利珠单抗 企业名称:恒瑞医药、盛迪亚生物 注射用卡瑞利珠单抗是我国自主原研的 PD-1 单抗,由恒瑞医药研发,可与人 PD-1 受体结合并阻断 PD-1/PD-L1 通路,恢复机体的抗肿瘤免疫力,从而形成癌症免疫治疗基础。目前已获批治疗复发或难治性经典型霍奇金淋巴瘤、肝细胞癌、非鳞非小细胞肺癌和食管鳞癌等。本次获批适应症为:联合 SHR2554 片及苹果酸法米替尼胶囊治疗晚期恶性肿瘤;联合放化疗治疗不可手术切除的局部晚期食管鳞癌;联合甲磺酸阿帕替尼片治疗晚期肝细胞癌。 药品名称:注射用重组肿瘤酶特异性干扰素α-2b Fc 融合蛋白 企业名称:丽珠医药 本品为干扰素α-2b Fc 融合蛋白,暂未查到该药详细信息。本次获批适应症为:晚期实体瘤。 ▲以上数据来源于 Insight 申报进度数据库 本报告在每月 11 号左右定期发布,敬请期待。以上品种介绍根据企业公开披露信息整理。
推荐阅读 ◆ 2020 年 4 月获批临床新药报告 ◆ 2020 年 3 月获批临床新药报告 ◆ 2020 年 2 月获批临床新药报告 ◆ 2020 年 1 月获批临床新药报告 ◆ 2019 年 12 月获批临床新药报告 ◆ 2019 年 10 月获批临床新药报告 ◆ 2019 年 9 月获批临床新药报告 ◆ 2019 年 8 月获批临床新药报告 ◆ 2019 年 7 月获批临床新药报告 ◆ 2019 年 6 月获批临床新药报告 ◆ 2019 年 5 月获批临床新药报告 ◆ 2019 年 4 月获批临床新药报告
Insight KOL(Key Opinion Leader)报告服务,以全球主要临床试验数据库为基础,整合参与临床试验项目的 KOL 信息,帮助您快速筛选国内外临床试验基地 服务主要内容 基本信息:KOL 教育背景及所在机构等 临床试验:参与的临床试验项目,所在临床试验基地,追踪试验药品从申报到上市的整个流程 药品活动:出席的药品宣传活动、药品临床数据解读等 学术活动:学术文章、主编指南发表,学术会议参与情况 如何获得报告服务: 1. 点击下方阅读原文,或者复制链接在浏览器打开 http://survey.dxy.cn/106854,填写您的报告需求 2. 或致电报告服务热线:400-6571-918 点击免费获取 获取行业 KOL 报告
|
【本文地址】