| L | 您所在的位置:网站首页 › L-棕榈酸的酯化方法还可以有哪些 › L |
L
|
李 红,陶 静,李 颖 (郑州轻工业学院食品与生物工程学院,河南郑州 450002) L-抗坏血酸棕榈酸酯的酶法合成 李 红,陶 静,李 颖 (郑州轻工业学院食品与生物工程学院,河南郑州 450002) 详细研究了脂肪酶在有机溶剂中催化合成L-抗坏血酸棕榈酸酯的反应,并且对影响产物浓度的几种主要因素进行讨论(如脂肪酶、溶剂、温度、底物比、添加剂),首次通过加入相转移剂提高反应产物浓度,确定了合成L-抗坏血酸棕榈酸酯的最适反应条件:3mL叔戊醇为溶剂,催化剂为Novozyme435,其最佳用量为0.05g,底物棕榈酸与抗坏血酸摩尔比3∶1,0.3g 4A分子筛作为吸水剂,0.3g四丁基溴化铵作为相转移剂,反应温度50℃,反应时间72h,得到产物浓度为16.6mg/mL。 L-抗坏血酸棕榈酸酯,Novozyme435,叔戊醇,四丁基溴化铵 随着人们生活水平的提高,人们对食品和食品添加剂的安全性越来越重视。L-抗坏血酸棕榈酸酯(图1)是近年来发现的一种新型“绿色”、多功能抗氧化剂。研究已表明,其安全性、稳定性和抗氧化性均优于目前常用的合成抗氧化剂BHA、BHT等,是世界卫生组织、食品药品联合委员会认可的营养型抗氧化剂,并为英国、美国药典收载,已被广泛应用于食品、医药、化妆品和纸制品等领域[1-4]。目前,L-抗坏血酸棕榈酸酯合成方法主要有直接酯化法[5-6]、酯交换反应法[7-8]、酰卤酯化法[9]及酶催化合成法[10-13],其中,酶催化合成法由于具有选择性高、副反应少、反应条件温和、产品下游分离操作相对简单、对设备要求不高等优点,符合清洁生产、绿色化工的发展趋势,越来越受到人们的重视[10-13]。国内汤鲁宏[14]等研究了叔戊醇中NOVO 435催化下L-抗坏血酸棕榈酸酯的合成,产物浓度仅12.5g/L。于是,通过改变反应条件,提高产物浓度,成为酶法合成L-抗坏血酸棕榈酸酯研究热点之一。本文针对该反应为可逆反应,考虑通过加入一定量的吸水剂调节反应体系中的水分含量,使反应向正方向进行,此外,水分含量的不同,将影响到反应体系中的酶活力,进而影响反应产物浓度;同时,因原料中棕榈酸为脂溶性,而L-抗坏血酸为水溶性的溶解性特点,于是设想能否通过加入一定量的相转移剂增加有机相中L-抗坏血酸的量来促进反应进行,实现对酶法合成L-抗坏血酸棕榈酸酯工艺的优化。
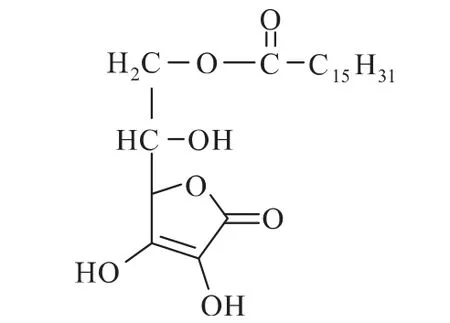
图1 L-抗坏血酸棕榈酸酯 1 材料与方法1.1 材料与仪器 NOVO 435脂肪酶、LIPOLASE脂肪酶、TLIM脂肪酶 河南工业大学油脂化学研究室赠送;棕榈酸、L-抗坏血酸、叔戊醇、己烷、氨水、氯化铵、浓盐酸、钼酸铵、硅酸钠、4A分子筛、四丁基溴化铵、无水硫酸钠 均为分析纯。 BS200S型电子天平 北京赛多利斯天平有限公司;85-2型恒温磁力搅拌器 江苏中大仪器厂;754型紫外可见分光光度计 上海第三分析仪器厂;HG101-1B电热鼓风干燥箱 南京实验仪器厂;WC-1型显微熔点仪 温度未校正,上海光学仪器厂;Bruker VEC-TOR22型红外光谱仪 德国布鲁克公司;Agilent LC/MSD Trap XCT质谱仪 美国Agilent公司。 1.2 L-抗坏血酸脂肪酸酯的合成方法 在由0.5mmol(0.088g)抗坏血酸和1.5mmol(0.384g)棕榈酸,3m L溶剂组成的反应体系中,分别加入0.05g脂肪酶、0.3g吸水剂、0.3g相转移剂四丁基溴化铵,在50℃的恒温水浴中反应,控制转速200 r/m in,反应72h后产物浓度用硅钼兰分光光度法[15]测定。 1.2.1 脂肪酶的选择 在25m L具塞长试管中分别加入0.088g(0.5mmol)抗坏血酸、0.384g(1.5mmol)的棕榈酸、0.05g脂肪酶(NOVO435、LIPOLASE和TLIM)、3m L叔戊醇,将试管放入转速为200 r/m in、温度为50℃的恒温磁力加热搅拌器中反应,72h后取样检测。 1.2.2 加酶量的选择 在温度为50℃,200 r/m in,3m L叔戊醇体系,棕榈酸与L-抗坏血酸的摩尔比为3∶1,加入0.3g吸水剂、0.3g相转移剂四丁基溴化铵条件下,分别加入 0.01、0.02、0.03、0.04、0.05、0.06g 脂肪酶NOVO435,反应72h后取样检测。 1.3 L-抗坏血酸脂肪酸酯的红外光谱测定 红外光谱用Bruker VEC-TOR22型红外光谱仪测定,KBr压片,扫描范围 4000~500cm-1。 1.4 L-抗坏血酸脂肪酸酯的质谱测定条件 质谱由Agilent LC/MSD Trap XCT质谱仪测定,采用电喷雾ESI离子源;电子能量70eV;传输线温度275℃;离子源温度200℃;采用负离子模式,母离子m/z 413;激活电压1.5V;质量扫描范围m/z 0~650。 2 结果与讨论2.1 脂肪酶的选择 考察了NOVO 435,LIPOLASE,TLIM三种脂肪酶对L-抗坏血酸棕榈酸酯合成反应的催化效果,结果见图2。
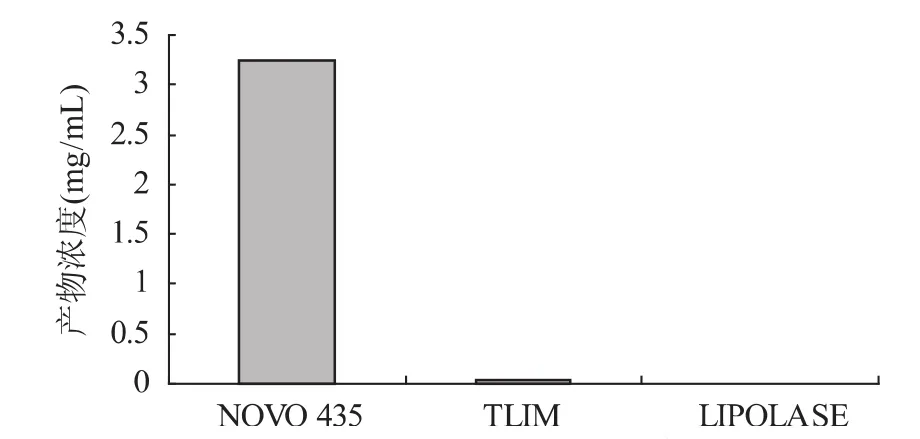
图2 脂肪酶对酯化反应产物浓度的影响 由图2可以看出,LIPOLASE脂肪酶几乎不存在催化此反应的功能,TLIM催化效果也比较差,72h后,产物浓度仅0.04mg/m L,NOVO 435催化此反应的效果最好,72h之后,产物浓度可达3.24mg/m L,因此,选择NOVO 435作为酯化反应的催化剂。 2.2 吸水剂对酯化反应产物浓度的影响 由于L-抗坏血酸棕榈酸酯合成反应是可逆反应,而且产物中有水生成,因此,考虑将反应体系中加入一定量的吸水剂,促使反应向正方向进行;此外,水分活度的不同,也将影响到反应体系中的酶活力,进而影响反应产物浓度,于是我们考察了无水Na2SO4及活化的4A分子筛对反应产物浓度的影响,结果见图3。 从图3可以看出,吸水剂无水Na2SO4及4A分子筛的加入可以明显地促进反应的进行,且加入4A分子筛要比加入无水Na2SO4效果更好,一方面是因为吸水剂的加入有助于反应向生成产物的方向进行;另一方面可能是因为吸水剂的加入调整了反应体系的水分活度,更适于脂肪酶作用。因此,我们选择加入4A分子筛作为吸水剂。
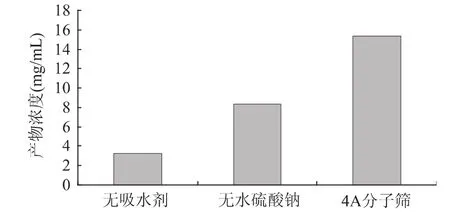
图3 吸水剂对酯化反应产物浓度的影响 2.3 反应溶剂的选择 反应溶剂作为酶反应的介质直接影响酶的催化活性和稳定性。不仅如此,溶剂还能改变酶的特异性。酶在不同的有机溶剂中活力差别很大,酶活力和溶剂之间可能存在着某种定量关系模型。而且,L-抗坏血酸棕榈酸酯的合成反应与一般的有机相合成反应有所不同,其底物是由L-抗坏血酸和棕榈酸组成,而L-抗坏血酸极性很强,棕榈酸非极性很强,因此要获得高浓度的产物,就要求反应结束时,L-抗坏血酸和棕榈酸的浓度都非常高,该反应需选择一种亲水性溶剂,即有一定极性,对抗坏血酸有一定溶解性,以保证从理论上获得的产物浓度较高,同时极性又不宜太强,否则将造成酶的失活。于是研究了分别以水、叔戊醇、正己烷作为反应溶剂,结果见图4。
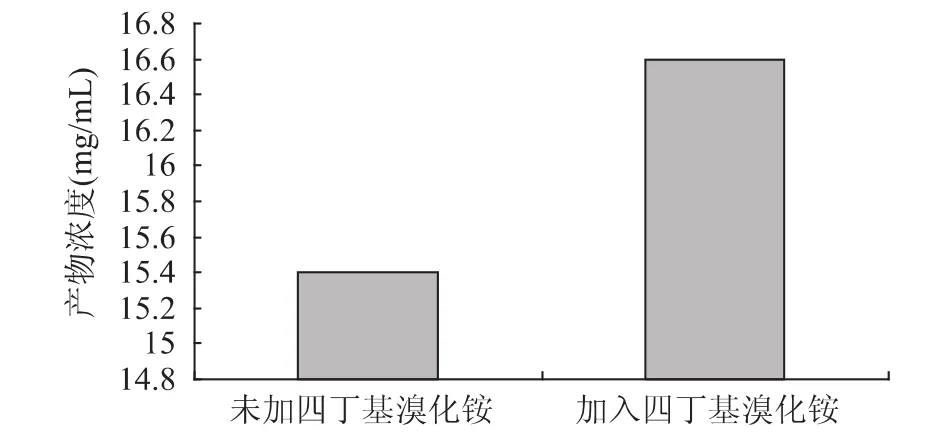
图4 溶剂对酯化反应产物浓度的影响 从图4看来,水不适合作为此反应的介质。当反应在非极性较强的正己烷中反应时,可能由于溶解度的原因,虽然很适合酶的催化反应,但对抗坏血酸的溶解性较差,导致产物浓度依然很低。于是选择极性处于两者之间的叔戊醇,得到的产物浓度最高。 2.4 相转移剂对酯化反应产物浓度影响 在L-抗坏血酸与棕榈酸的酯化反应中,L-抗坏血酸是水溶性的,而棕榈酸是脂溶性的,两种反应物处在不同的相中,反应不容易进行。于是考虑通过加入一定量的相转移剂—四丁基溴化铵,增加L-抗坏血酸在叔戊醇相中的溶解度,加速反应,结果见图5。由图5可以看出,加入四丁基溴化铵后,产物浓度有所提高,因此,我们选择加入一定量的相转移剂四丁基溴化铵。
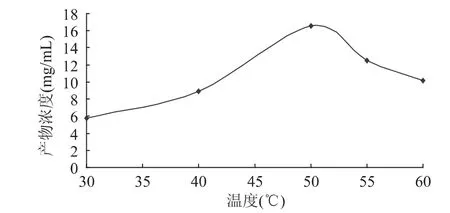
图5 相转移催化剂对酯化反应产物浓度的影响 2.5 反应温度对酯化反应产物浓度的影响 温度对NOVO 435酶催化L-抗坏血酸与棕榈酸的酯化反应的影响如图6所示。
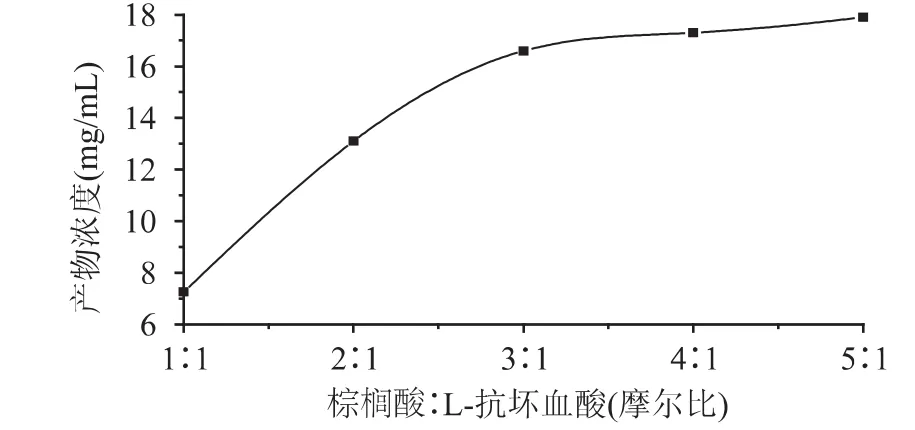
图6 温度对酯化反应产物浓度的影响 由图6可见,温度对L-抗坏血酸棕榈酸酯的合成有较大的影响,温度升高有利于该反应进行。当温度在30~50℃时产物浓度迅速上升,在温度为50℃时产物浓度达到最高。但温度超过50℃时,随着温度的继续升高,L-抗坏血酸棕榈酸酯的产物浓度反而有所下降,主要是因为温度过高使脂肪酶NOVO435逐渐失活,此外,温度过高也会破坏抗坏血酸的结构,进而影响产物浓度。于是将反应温度控制在50℃为宜。 2.6 底物比的选择 脂肪酶催化该酯化反应是L-抗坏血酸和棕榈酸反应生成酯和水的反应。要使反应彻底,就必须使反应物过量,或在反应中除去某产物,由于L-抗坏血酸微溶于叔戊醇,且反应结束后,仍有部分固态L-抗坏血酸,它在反应中的浓度可视为定值,因此,可以通过增加棕榈酸的量促使反应进行。本实验通过改变棕榈酸与L-抗坏血酸的摩尔比,考察对产物浓度产生的影响,结果如图7所示。
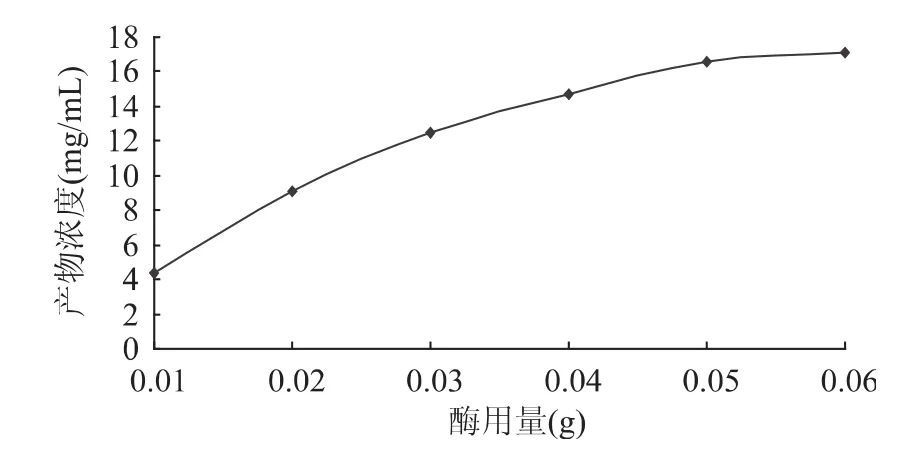
图7 底物摩尔比对酯化反应产物浓度的影响 由图7可见,体系中L-抗坏血酸棕榈酸酯的浓度随着棕榈酸和L-抗坏血酸的摩尔比增大而增大,但当摩尔比超过3∶1时,反应产物浓度变化已经不明显,说明此时酶已经被底物饱和,体系中过量的棕榈酸对反应影响较小,因此,选择最适棕榈酸和L-抗坏血酸的摩尔比为3∶1。 2.7 体系中加酶量的选择 脂肪酶固体颗粒直接悬浮于有机溶剂中,酶的加入量对于反应进程有相当大的影响。结果如图8所示。 由图8可知,体系中L-抗坏血酸棕榈酸酯的质量浓度随酶NOVO 435量的增大而增加,当加酶量达到0.05g时,继续增加脂肪酶的用量,反应产物的质量浓度增加缓慢,说明,此时酶已经相对底物过剩。因此,体系中最适的加酶量为0.05g。
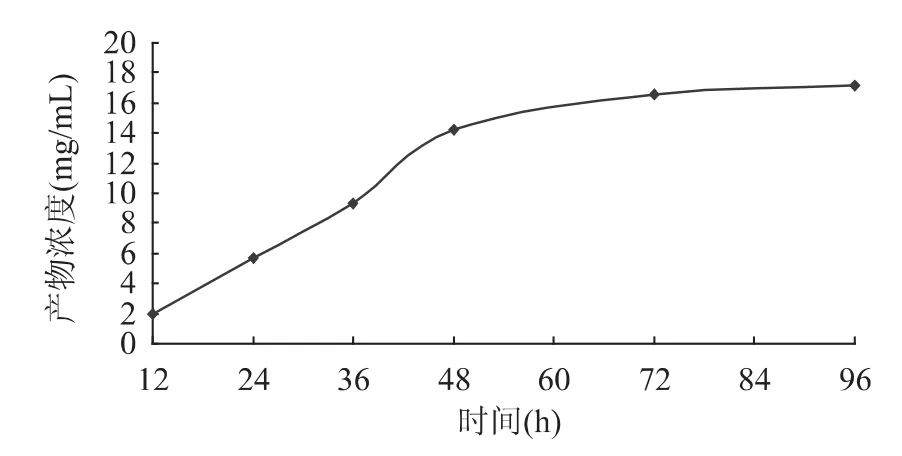
图8 酶浓度对酯化反应产物浓度的影响 2.8 反应时间对酯化反应产物浓度的影响 体系中L-抗坏血酸棕榈酸酯的质量浓度随时间的变化情况如图9所示。
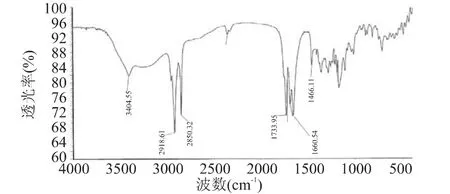
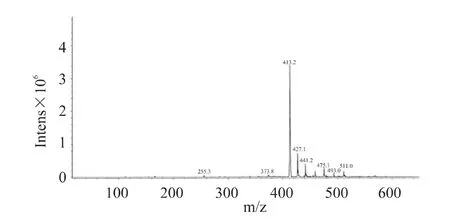
图9 时间对酯化反应产物浓度的影响 由图9可以看出,反应时间在72h内,L-抗坏血酸棕榈酸酯的浓度迅速上升,超过72h后,产物浓度升高缓慢,说明此时反应已经趋于平衡,再延长时间并不能有效增加体系中L-抗坏血酸棕榈酸酯的质量浓度,因此,选择最佳反应时间为72h。 2.9 产物的结构鉴定 由酶催化提纯得到的产品为白色粉末,用熔点仪测定其熔点为110~113℃,在文献报道的熔点范围内(107~117℃)。从红外光谱图(图10)中可以看出,在 3404cm-1处出现 OH 的吸收峰,在 2918、2850cm-1处出现 CH2的 C-H伸缩振动吸收峰,在1733cm-1处出现羧酸酯基伸缩振动吸收峰,1660cm-1附近的吸收峰为L-抗坏血酸中C=C双键的吸收峰;指纹区的吸收峰(1466、1300、719cm-1)进一步提供了佐证,符合L-抗坏血酸棕榈酸酯的结构特征。质谱图(图11)中的分子离子峰413.2(M-1)更加证实了产品即为L-抗坏血酸棕榈酸酯。
图10 L-抗坏血酸棕榈酸酯的红外光谱
图11 L-抗坏血酸棕榈酸酯的质谱图 3 结论本文研究了一种合成L-抗坏血酸棕榈酸酯的方法,通过对催化合成L-抗坏血酸棕榈酸酯反应的酶种类和介质进行筛选,发现在叔戊醇溶剂中用NOVO435催化L-抗坏血酸与棕榈酸的酯化反应得到的产物浓度最高;同时,对影响合成L-抗坏血酸棕榈酸酯的因素(温度、吸水剂、相转移剂、底物比、酶浓度、反应时间)进行探讨,得到了脂肪酶催化合成L-抗坏血酸棕榈酸酯的最佳反应条件为:3m L叔戊醇作为溶剂,棕榈酸与L-抗坏血酸的摩尔比为3∶1,酶NOVO435用量为0.05g,以0.3g 4A分子筛作为吸水剂,0.3g四丁基溴化铵作为相转移剂,在50℃下,反应72h,反应产物浓度可达16.6%。 [1]R K K Nippon.Antioxidant activity of ascorbic acid and ascorbyl palmitate[J].New Food Ind,1991,33(6):6-13. [2]耿志明.L-抗坏血酸棕榈酸酯特性和应用[J].江苏食品与发酵,1997(1):31-36. [3]D Gopinath,D Ravi,B R Rao.Ascorbyl palmitate vesicles(Aspasomes):formation,characterization and applications [J].International Journal of Pharmaceutics,2004,271:95-113. [4]刘长波,高瑞昶.L-抗坏血酸棕榈酸酯的合成研究进展[J].中国油脂,2003,28(10):46-49. [5]P A Seib,R C Cousins,R CHoseney.Method of synthesizing fatty acid esters of ascorbic acid[P].US:4151178,1979-04. [6]Gruetsmacher.Preparation of erythorbic acid and ascorbic acid 6-fatty acid esters[P].US:4289702,1981-09-15. [7]龚大春,周强,席祖江.L-抗坏血酸棕榈酸酯合成工艺研究[J].沈阳化工学院学报,2000,14(3):199-200. [8]蔡力创,吕积国,刘瑾,等.室温条件棕榈酸合成L-抗坏血酸棕榈酸酯的研究[J].江西科学,1999,17(4):215-219. [9]陆豫,甘利军,陈葆仁.L-抗坏血酸棕榈酸酯的合成[J].精细化工,1996,13(3):17-18. [10]CHumeau,M Girardin,B Rove,et al.Effect of the thermo dynamic water activity and the reaction medium hydrophobicity on the enzymatic synthesis of ascrobyl palmitate[J].Journal of Biotechnology,1998,63:1-8. [11]Y Yan,TB Uwe,R D Schmid.Lipase-catalyzed synthesis of vitaminC fatty acid esters [J].Biotechnology Letters,1999,21:1051-1054. [12]S Park,F Viklund,K Hult,et al.Vacuum-driven lipasecatalysed direct condensation of L-ascorbic acid and fatty acids in ionic liquids:synthesis of a natural surface active antioxidant[J].Green Chemistry,2003(5):715-719. [13]Q X Song,Y Zhao,W Q Xu,et al.Enzymatic synthesis of L-ascorbyl linoleate in organic media [J].Bioprocess Biosyst Eng,2006,28:211-215. [14]汤鲁宏,张浩.催化合成L-抗坏血酸棕榈酸酯的反应媒体和脂肪[J].无锡轻工大学学报,2000,19(2):157-159. [15]汤鲁宏,张浩.硅钼兰分光光度法测定微量L-抗坏血酸棕榈酸酯[J].中国粮油学报,2000,15(1):37-39. Synthesis of L-ascorbyl palmitate catalyzed by lipase LIHong,TAO Jing,LIYing (School of Food and Biological Engineering,Zhengzhou University of Light Industry,Zhengzhou 450002,China) The synthesis of L-ascorbyl palmitate catalyzed by lipase in organic phase was studied.The optimized process conditions,such as enzyme,solvent,temperature,reactants and additive were determined.In the presence of0.05g Novozyme 435 as catalyst,0.3g of 4A molecular sieve and 0.3g of n-Bu4NBr as additive in 3m Ltert-amyl alcohol at 50℃,16.6mg/m L of L-ascorbyl palmitate was obtained in the reaction of palm itic acid and VCwith the molar ratio of 3∶1 after 72h. L-ascorbyl palmitate;Novozyme 435;tert-am yl alcohol;tetrabutylammonium bromide TS202.3 A 1002-0306(2011)08-0350-04 2010-01-07 李红(1978-),女,博士,副教授,主要从事食品化学方面的研究工作。 郑州轻工业学院2008年博士基金项目(000420)。 猜你喜欢 酸酯戊醇棕榈 一种环戊醇脱氢制环戊酮催化剂及其制备方法能源化工(2022年2期)2023-01-15乙醇酸酯制乙醛酸酯的生产方法能源化工(2022年3期)2023-01-15糖耗速率对浓香型白酒发酵过程异戊醇合成的影响食品与发酵工业(2022年15期)2022-08-18它们可以用来书写吗小天使·一年级语数英综合(2020年11期)2020-12-16棕榈树文理导航·科普童话(2017年4期)2018-02-10棕榈散文诗(2017年17期)2018-01-31废弃食用油和正戊醇混合物的柴油机可持续环保燃烧方法汽车文摘(2017年7期)2017-12-08棕榈设计有限公司风景园林(2017年3期)2017-06-22Cu(Ⅱ),Ni(Ⅱ),Co(Ⅱ),Mn(Ⅱ),Zn(Ⅱ)和Cd(Ⅱ)的乙基3-(2-氨硫化亚肼基)-2-(羟胺基)丁烯酸酯配合物:合成、表征和细胞毒性无机化学学报(2014年6期)2014-07-14欧盟将褐煤酸酯移出许可食品添加剂清单食品与生物技术学报(2014年11期)2014-04-07
|
【本文地址】
 食品工业科技2011年8期
食品工业科技2011年8期