| 『流式protocol』用PI、7 | 您所在的位置:网站首页 › DAPI溶液有毒吗 › 『流式protocol』用PI、7 |
『流式protocol』用PI、7
|
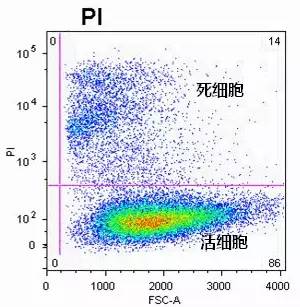
流式细胞术检测时,死细胞非常容易导致非特异性染色,引起结果不正确,所以排除死细胞很关键,更详细的解读请参见以前发过的两篇文章: 死细胞的鉴别一般通过DNA结合染料排除,利用死细胞膜通透性增大、不破膜的情况下DNA染料即可进入的特点区分出死细胞,但所用染料浓度、时间远远低于细胞周期所用的浓度,并且不需要固定。 常用的核酸结合死活鉴别染料包括: 碘化丙啶(propidium iodide,PI) 4',6-二脒基-2-苯基吲哚二盐酸盐(4',6-Diamidino-2-phenylindole dihydrochloride,DAPI) 7-氨基 - 放线菌素D(7-amino-actinomycin D ,7-AAD) DRAQ7 SYTOX 不过对于一些胞内抗原(细胞因子、转录因子),由于需要固定、破膜,所以上述染料中,除了一些胺类染料(如Live/Dead、Ghost等)和新型蒽醌类染料CyTRAK Orange外,其它染料不再适合此类标本的细胞死活鉴别。 这里,只向大家讲解一下用PI、7-AAD、DAPI的染色方法,其它商品化死活染料请按照说明书操作: 1. 用0.5ml 1×PBS重悬细胞。 2. 加入PI或DAPI或7-AAD,终浓度分别为PI(5 µg/ml)、DAPI(500-1000 ng/ml)、7-AAD(2.5 µM) 3. 加入上述染料后,尽快上机,一般不要超过5分钟(有些厂家说明书写着10分钟,可能与浓度有关,可按照说明书操作)。 PI检测通道:使用488 nm激发,用610/20 BP收集 DAPI检测通道:最好用355nm激发,用440/40BP收集;也可以用405nm激发,450/50BP收集 7-AAD检测通道:用488nm激发,用670/14BP收集 下图是用PI检测细胞死活的结果图:
本文来自流式中文网(flowcyto.cn)欢迎转发到朋友圈,但谢绝复制粘贴转载如有需要请联系返回搜狐,查看更多 责任编辑: |
【本文地址】