综述 |
您所在的位置:网站首页 › 酶的修饰作用是什么 › 综述 |
综述
|
曾经由于受到仪器灵敏度以及方法学的限制,mRNA的化学修饰丰度较低导致RNA表观遗传学研究被整整滞后了几十年。检测这种修饰的研究方法的局限性,导致人们忽略了这些修饰在mRNA表观遗传学中的重要性。 在转录后修饰中,m6A是最普遍的修饰之一,广泛存在于tRNA、rRNA、mRNA、miRNA、lncRNA和circRNA中。值得注意的是,在真核细胞中,m6A修饰在所有RNA碱基修饰中占比达到80%,在polyA mRNA中m6A在所有RNA碱基修饰中占到的比例也超过50%。 大约在40年前,已经有国外的课题组首次在小麦、燕麦、胚芽鞘和玉米的RNA中发现m6A修饰。随后又有其他课题组陆续在病毒、果蝇、酵母、植物、人类和其他哺乳动物中的RNA中有鉴定到m6A修饰(液相质谱法鉴定)。 在以前的研究中,m6A的修饰被认为是“静态的”和不可逆的。然而,何川教授在2011年首次发现FTO蛋白可以对带有m6A修饰的腺苷有去甲基化修饰作用。 随后,许多课题组又提出了“体外转录体”的概念,并逐渐扩展到一个新的研究领域。在哺乳动物中,m6A修饰比例在0.1-0.4%,相当于每2000个核苷酸中有一个m6A修饰位点。据报道酿酒酵母减数分裂的发生率稍高,m6A碱基比例较高,大约为0.7-0.9%。在各种病毒中,每条RNA上m6A修饰的碱基在1-15个左右,而拟南芥中每1000个核苷酸中就有0.5-0.7个位点有m6A修饰(或每条转录本中有0.7-1个m6A位点)。 在植物和其他真核生物中,m6A修饰是由m6A甲基转移酶在与RNA上的保守motif RRACH(R=G/A; H=U/A/C)结合后产生的。有趣的是,当高度保守的GAC突变为GAU时(A碱基仍然有m6A修饰但是边上的C碱基变成了U),肉瘤病病毒mRNA不再发生m6A修饰。 m6A修饰频率在RNA中分布不是特别均匀,在成熟的mRNA中丰度较高。这种修饰主要富集在3’ UTR和终止密码子TES附近,尤其是CDS序列的3’端和3’UTR前端。在压力胁迫等条件刺激下,5’UTR和转录起始位点TSS上也有大量的m6A修饰。 在植物中,除了3’UTR和TES,部分样本在5’UTR和TSS附近也存在大量m6A修饰富集。超过60%的m6A修饰位于叶绿体相关蛋白基因的TSS附近,在测序结果中某些光合作用的相关基因也存在大量的m6A修饰。这些结果表明m6A修饰参与调控了光合作用。 迄今为止,m6A的研究大多集中在人类和其他哺乳动物中,而很少有关于植物m6A的论文。此外,许多关于人类和其他哺乳动物中的m6A文章得出的结论在植物中受到了挑战。 本文首先对22种植物中的m6A writers和erasers进行鉴定,总结在植物中RNA甲基化酶的组成和结构。由于m6A在不同物种中高度保守,选择拟南芥作为模型来确定其他植物物种的同源蛋白,以揭示m6A修饰潜在的分子机制。 其次,系统地综述了近年来植物m6A甲基化生物学功能的研究进展。 第三,研究了不同植物之间m6A甲基化酶之间的关系,描述了m6A在植物中甲基化酶的功能和进化,有助于更好地理解m6A的功能,有助于揭示RNA修饰调控机制的复杂性。 植物m6A甲基化酶:writers、erasers和readers
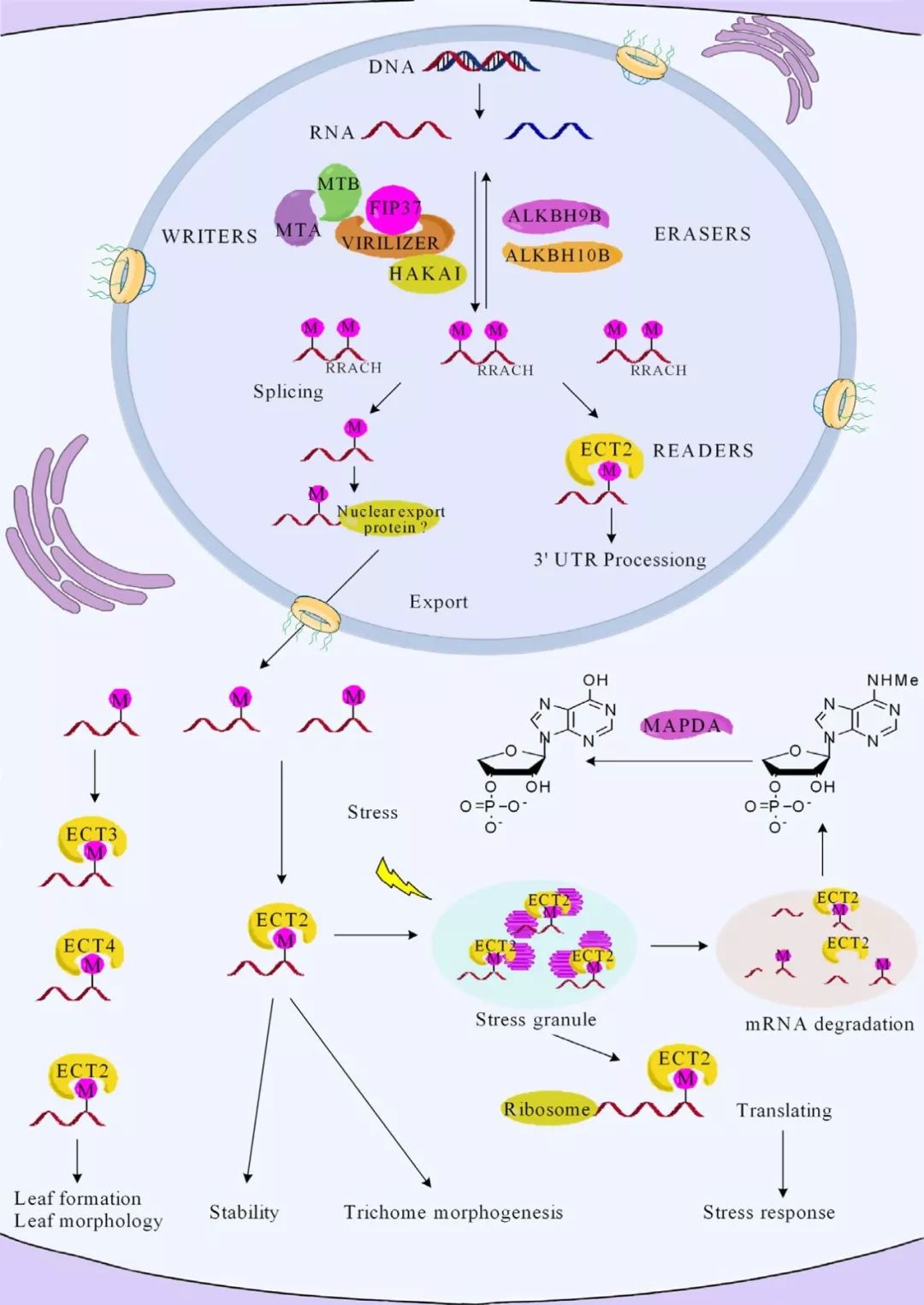
图1. 通过m6A书写、擦除和阅读蛋白网络的作用,建立了一个m6A修饰调控拟南芥基因稳定和翻译的示意图——m6A甲基转移酶(writers)和去甲基化酶(erasers)导致m6A基因修饰的动态模式。m6a-writer复合物包括蛋白质MTA、MTB、FIP37、virilizer和HAKAI。核内的ALHBH9b和ALKBH10b蛋白可以去除m6A修饰。ECT2/3/4和CPSF30蛋白作为m6A阅读蛋白,专门结合含有RRACH motif的m6A位点并介导特定功能。m6A甲基化在mRNA代谢、翻译和稳定性中的重要作用已经被发现。ECT2调节核内的3′UTR mRNA处理。然而ECT2在细胞质中可以结合到含m6A的RNA,以促进mRNA的翻译,并将mRNA导入应激颗粒,以提高应激耐受性。另两个阅读蛋白ECT3/4可能调控拟南芥叶片的形态发育。最后,通过酶MAPDA催化N6-MAMP转化为IMP,可以将RNA中的m6A修饰转化为N6-mAMP。 m6A甲基化转移酶是在转录后由保守motif RRACH的一类RNA结合蛋白形成复合物组成。m6A甲基化、去甲基化以及识别过程中涉及到许多蛋白,包括writers、erasers和readers。在拟南芥中writers包括MTA、MTA,erasers包括ALKBH9b、ALKBH10b,readers包括ECT2、ECT3和ECT4等。 因为m6A水平远远低于RRACH motif丰度,所以并不是所有RRACH motif都与m6A修饰相关,这表明调节m6A修饰的分子机制尚未被完全挖掘。 拟南芥甲基化转移酶MTA和FIP37等可以调控顶端分生组织的发育拟南芥去甲基化酶ALKBH9b和ALKBH10b作为erasers可以对RNA上带m6A修饰的腺嘌呤进行去甲基化修饰反应。 拟南芥中ECT2(具有YTH结构域)是最重要的一个阅读蛋白之一在mRNA的3’UTR有显著富集。ECT2在调节细胞核中mRNA 3’UTR加工及mRNA稳定性方面起着十分重要的作用。当RNA从细胞核运输到细胞质中,ECT2还能调控拟南芥毛状体发育(案例解析:m6A-YTH组件调控拟南芥叶片发育时间和形态发生 | m6A专题)。ECT3和ECT4在拟南芥细胞质中结合m6A修饰的mRNA,与ECT2一起在不同时间点调控叶片形态发育起到关键作用。此外在热胁迫下,拟南芥翻译起始被抑制,ECT2会在应激颗粒上富集,表明ECT2能控制细胞质溶胶中mRNA的命运。最后体内RNA转换产生的N6‐methylated AMP(N6-mAMP),是由MAPDA酶通过水解反应将其转化为肌苷一磷酸IMP。 作为模式植物,拟南芥上的m6A相关研究由于起步较早,可以为其他植物提供参考。 m6A Writers 在哺乳动物中鉴定的第一个m6A甲基转移酶被命名为METTL3,并从200kDa甲基转移酶复合物中被成功克隆出来。METTL3是S-腺苷-L-蛋氨酸(S‐adenosyl‐L‐methionine, SAM)依赖性甲基转移酶家族的一个成员,在植物和哺乳动物中高度保守。MTA(METTL3人同源蛋白)是拟南芥中最早发现的甲基转移酶之一。 进化分析以及实验均表明,METTL14蛋白是人类催化m6A RNA甲基化的第二个最活跃的m6A甲基转移酶,与METTL3高度同源,但METTL14没有甲基转移酶活性。在通过氢键与METTL3相互作用形成非常稳定的二聚体之前,METTL14在结合RNA底物方面发挥了重要作用。拟南芥中已经鉴定出MTB(METTL14人类同源蛋白),但其功能仍未知。 Pre-mRNA剪接调节因子WTAP的缺失也可能导致mRNA整体m6A水平显著降低,这表明WTAP是甲基化转移酶复合物的第三个主要蛋白。WTAP在启动和控制METTL3-METTL14复合体活性所需的pre-mRNA剪接因子,在细胞核内定位方面起着至关重要的作用。FIP37(WTAP人同源蛋白)是一种E3泛素连接酶,在拟南芥中首次被鉴定与MTA相互作用。 m6A甲基化复合物的第四个关键蛋白KIAA1429是通过敲除突变鉴定出来的,这个蛋白缺失会导致哺乳动物mRNA整体m6A水平显著降低。Virilizer是果蝇体内的同源蛋白,通过调控整体m6A水平控制性别分化(sex determination),被认为是m6A甲基化复合物的第五个蛋白。在拟南芥中,Virilizer(KIAA1429人类同源蛋白)和E3泛素连接酶HAKAI(HAKAI人类同源蛋白)分别被发现是甲基化转移酶复合物的第四个和第五个关键蛋白。
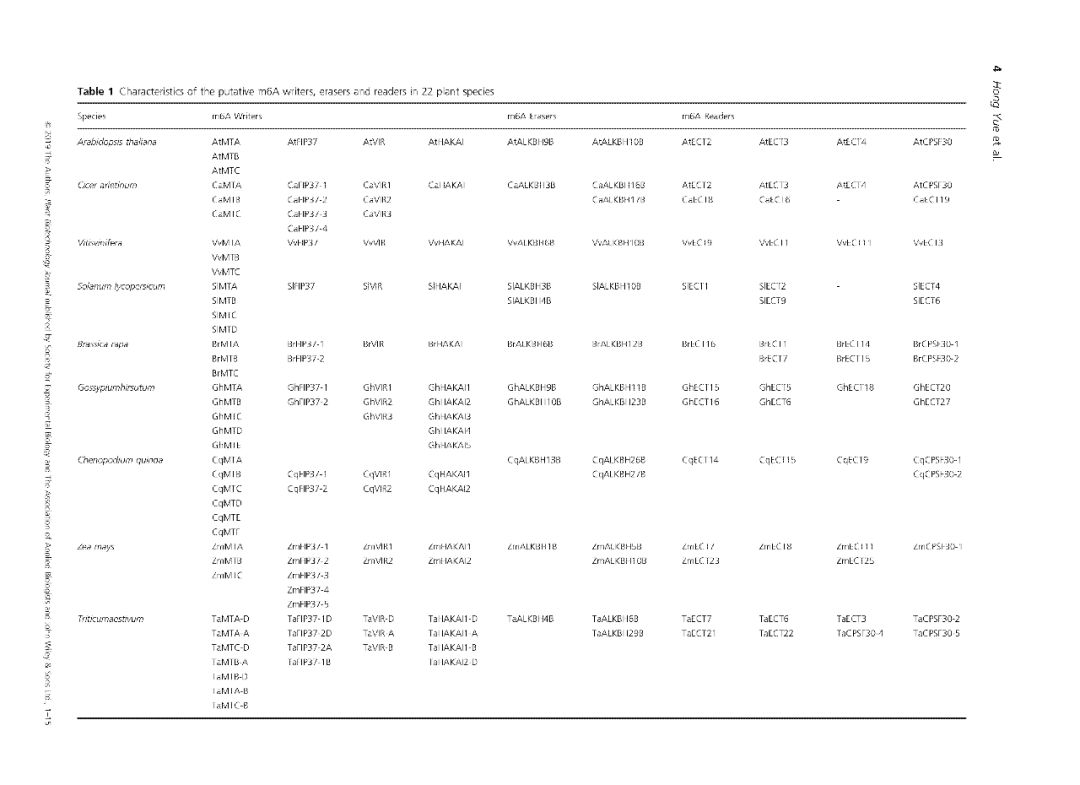
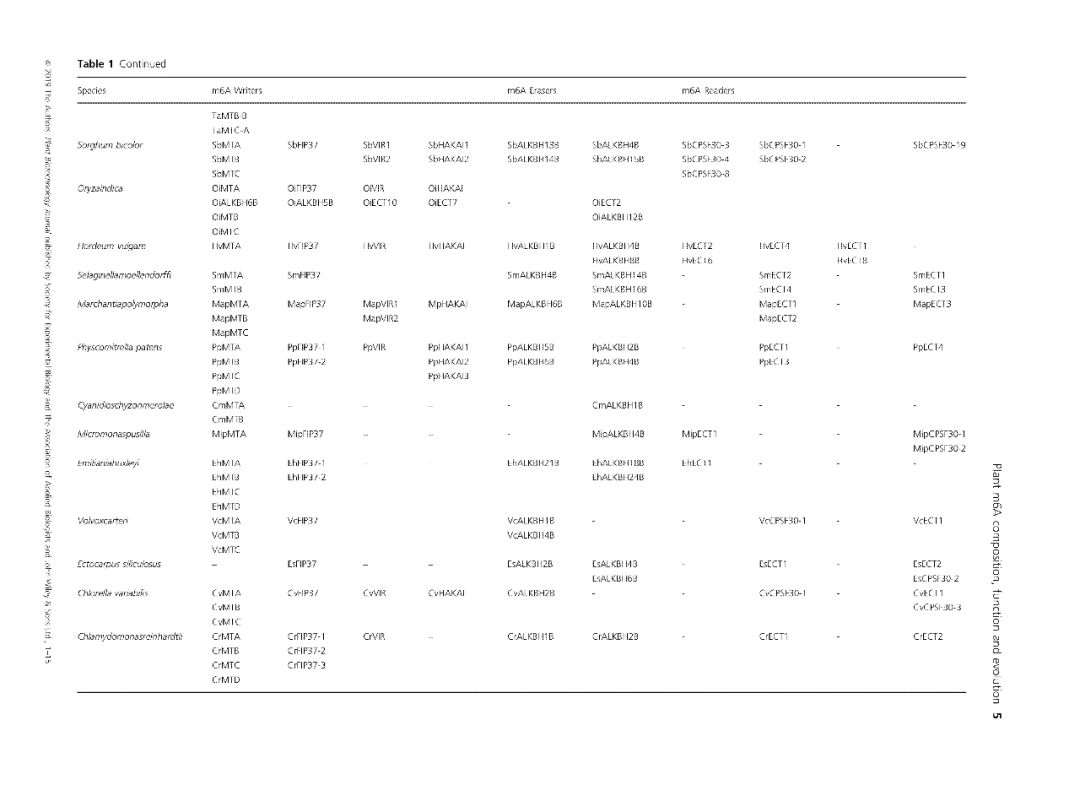
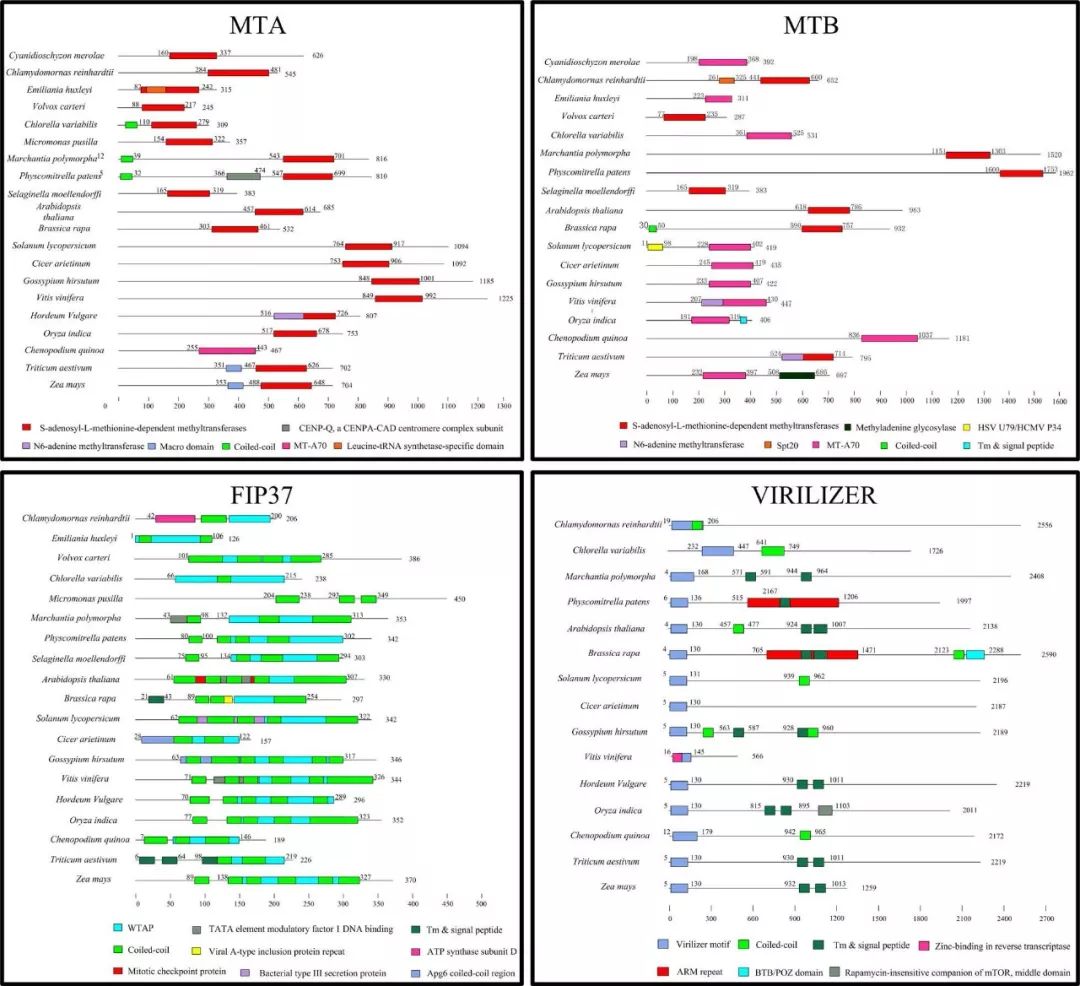
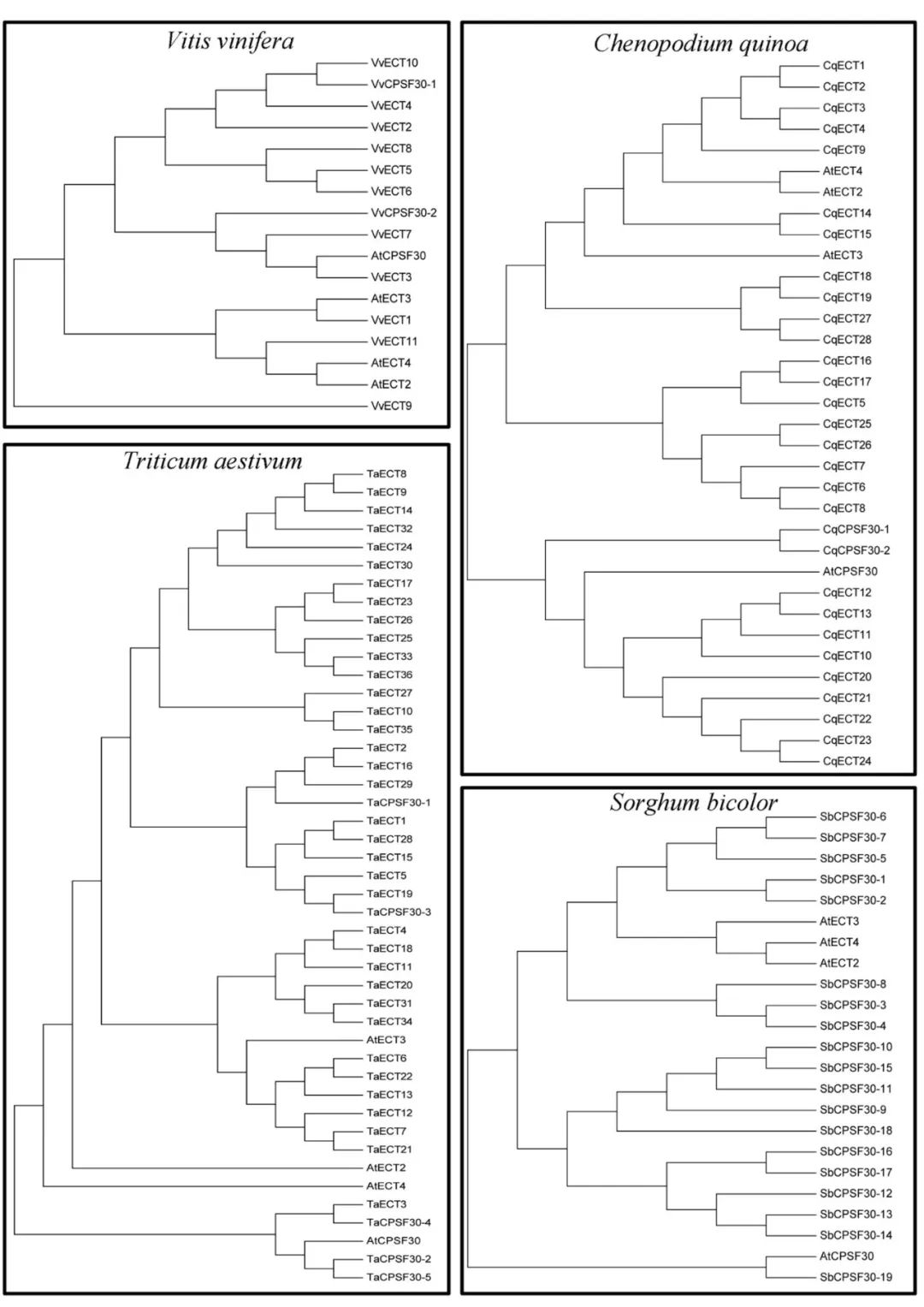
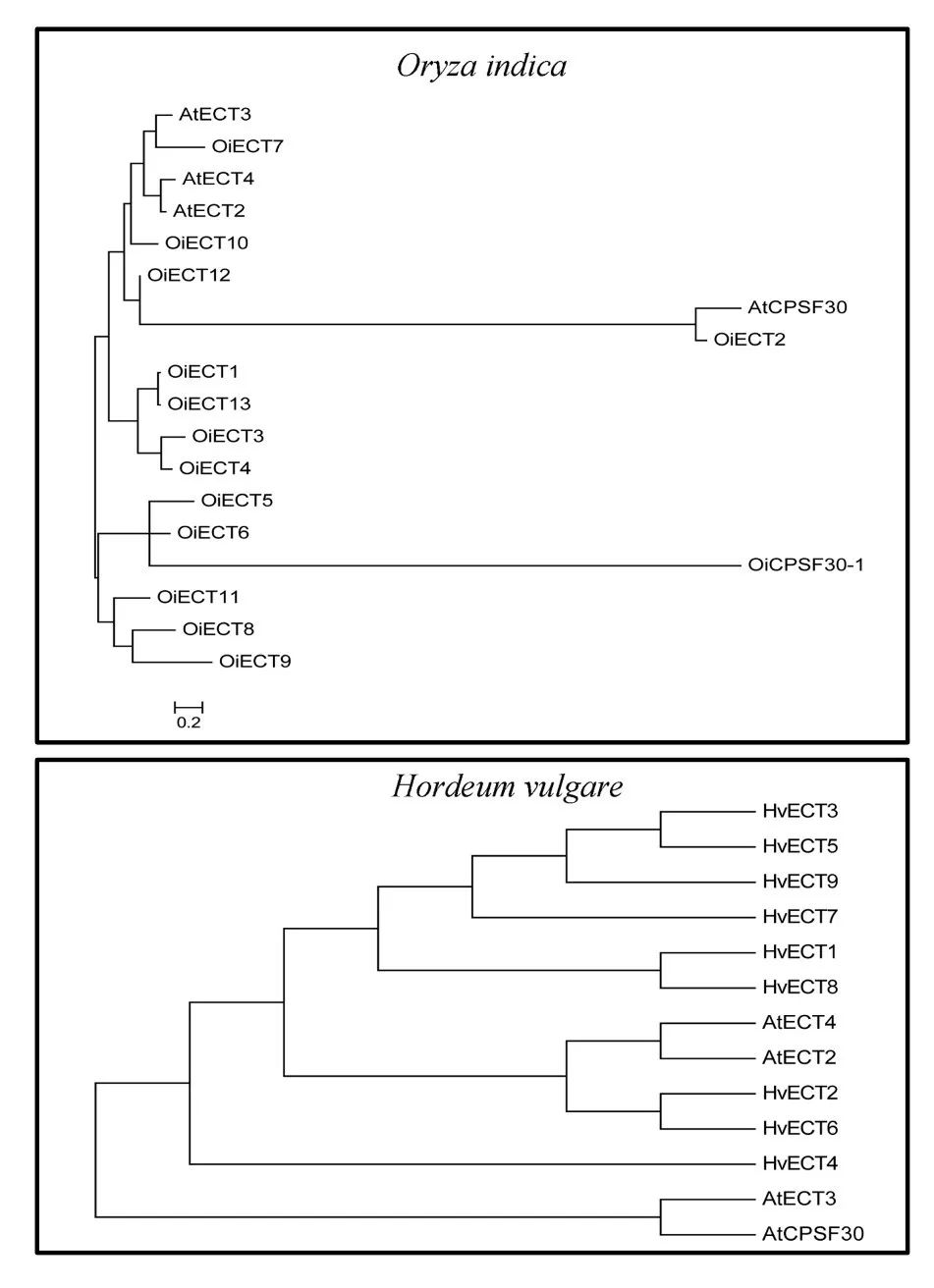
m6A的writers高度保守,因此拟南芥中的蛋白可以提供鉴定不同植物种的同源基因所需的序列信息。大量的植物基因组信息已公开,可以选择了一些具有代表性的物种进行比较基因组分析,包括6个双子叶植物物种、6个单子叶植物物种、1个蕨类植物物种、2个苔藓物种和7个藻类物种。这些物种的蛋白质序列来自Ensembl plants和NCBI。 以拟南芥MTA、MTB、FIP37、Virilizer和HAKAI蛋白序列作为参考序列,用这些下载的蛋白质序列构建本地蛋白质数据库,然后搜索候选m6A writers。 从Pfam数据库下载MTA70超家族(PF05063)、WTAP超家族(PF17098)和Virilizer motif(PF15912)序列的HMM(隐马尔可夫模型)信息,并使用HMMER搜索工具评估所有植物种蛋白质序列。159个候选的m6A writers组件使用HMM搜索和BLASTP进行识别。所有植物共鉴定出69种MTA、MTB和MTC蛋白。 MTA蛋白主要分布在分裂组织中,特别是在生殖器官、顶端分生组织和新生根系组织中。MTA蛋白的失活会影响发育,影响植物胚胎在球形阶段的发育,最终导致胚胎死亡。m6A修饰降低与生殖器官、茎和侧根分生组织中MTA蛋白质的相对丰度降低呈正相关。 有趣的是,在大麦和小脓疱菌中只发现了一种MTA。在这两个物种中,MTB和MTC蛋白可能采用了MTA蛋白特殊的分子作用。关于MTC蛋白的功能目前报道不多,这是本文中确定的另一个全新的m6A writer。 在玉米和小麦中分别鉴定出5个FIP37蛋白和2个FIP37蛋白。FIP37基因敲除后,胚乳和胚胎发育延迟,随后导致胚胎致死。FIP37的缺失显著降低了3′UTR中m6A的修饰,终止密码子对5′UTR中m6A的修饰影响较小。 在动物中,FIP37的功能与WTAP不同。WTAP定位于细胞核并影响mRNA的剪接,而FIP则在核浆内均匀分布,未发现影响RNA剪接。FIP37的分布与MTA相似,这两种蛋白在顶端分生组织、幼叶和花器官中高表达。FIP37敲除后,植株在茎尖分生组织中表现出细胞过度增殖,这表明m6A修饰对于调节分生组织中的细胞分裂至关重要。 因此,我们推测这些FIP37对于维持植物茎分生组织的增殖起着不可或缺的作用(案例解析:拟南芥m6A甲基化酶FIP37调控茎尖分生组织发育 | m6A专题)。 m6A E rasers 在哺乳动物中,首次发现m6A去甲基酶——FTO(fat mass and obesity‐associated protein)。FTO以α-酮戊二酸和二价铁离子Fe2+依赖方式催化m6A修饰的腺苷转化为不带m6A修饰的腺苷,这表明m6A是一种可逆的动态修饰。然而,最近的研究报告称FTO是m6Am,去甲基化酶,而不是m6A本身。部分研究发现当底物为m6Am时,FTO的催化率明显高于m6A。此外,Jaffrey等人也发表论文称FTO在consensus site分析中显示出对m6Am的强烈偏好,而对m6A没有偏好。 第二种m6A去甲基化酶是ALKBH5(alkylation repair homolog 5, 烷基化修复同系物5)是FTO一样都是Alkb家族的同源蛋白。乳腺癌细胞中ALKBH5蛋白的表达升高与m6A整体水平的降低有直接关系。当底物为m6A修饰的RNA时候时,ALKBH5具有催化活性使腺嘌呤上的m6A修饰被去除,但是ALKBH5对未发生m6A修饰的腺嘌呤本身没有催化活性,这表明ALKBH5是一种m6A去甲基酶。 何川课题组在2014年Nature Communications的文章中对拟南芥进行了转录组测序和m6A-seq。结果表明,m6A修饰在拟南芥中是一个动态的过程(案例解析:m6A-seq揭示拟南芥RNA甲基化独特特性 | m6A专题)。 其他几项研究均证实,带m6A修饰的腺嘌呤可通过去甲基化酶ALKBH9b和ALKBH10b的作用下还原为不带有m6A修饰的腺苷(案例解析:拟南芥去甲基化酶ALKBH10调控成花转变 | m6A专题)。ALKBH9b定位于在有siRNA的胞质颗粒,可定向到P小体。ALKBH9b和ALKBH10b属于铁II/α-酮戊二酸依赖性双加氧酶(Fe(II)/α‐ketoglutarate‐dependent dioxygenases)的Alkb家族蛋白,包含高度保守的synthase‐like合成酶结构域。下载了synthase‐like合成酶结构域(PF13532)序列的HMM信息,并使用HMMER搜索工具识别了22个植物物种的同源基因。共鉴定出22种植物中大肠杆菌alkb家族293个同源物。 这些研究揭示了拟南芥m6A去甲基化的过程由ALKBH9b和ALKBH10b介导,尽管去甲基酶家族在其他植物物种中的存在和作用机制尚不清楚。 m6A readers 为了了解m6A相关基因表达调控的分子机制,m6A阅读蛋白的功能至关重要。这些阅读蛋白与m6A修饰的RNA能够特异结合,实现甲基化修饰的生物学功能。 需要注意的是,m6A阅读蛋白不参与腺嘌呤上N6的甲基化和去甲基化的作用,而是与m6A的RNA结合后进一步发挥功能。 YTHDF2和YTHDF3是由Gideon Rechavi课题组在2012那篇Nature中首次报道。这2个m6A阅读蛋白是Gideon Rechavi的学生Dan Dominissini采用Pull-down的形式鉴定到的。 YTH家族成员高度保守,包含一个芳香口袋的YTH结构域,用于识别m6A修饰的碱基。这些蛋白质广泛存在于人类、果蝇、酵母和拟南芥中。 此外,不同的m6A阅读蛋白可以产生不同的功能。例如,YTHDF1通常定位于胞浆/细胞质中,但也很有可能与细胞核中的eIF3相作以促进翻译起始和蛋白质合成。 胞浆中YTHDF2蛋白上有鉴定到超过3000个含有m6A的靶RNA,在大多数的mRNA和一些非编码RNAs中,它能特异地识别m6A的保守核心基序GAC。 有趣的是,YTHDF1和YTHDF2这两个蛋白的靶mRNAs存在大量交叉重叠现象。YTHDF1促进靶mRNAs的有效翻译,而YTHDF2能够识别这些靶mRNA并促进其降解。
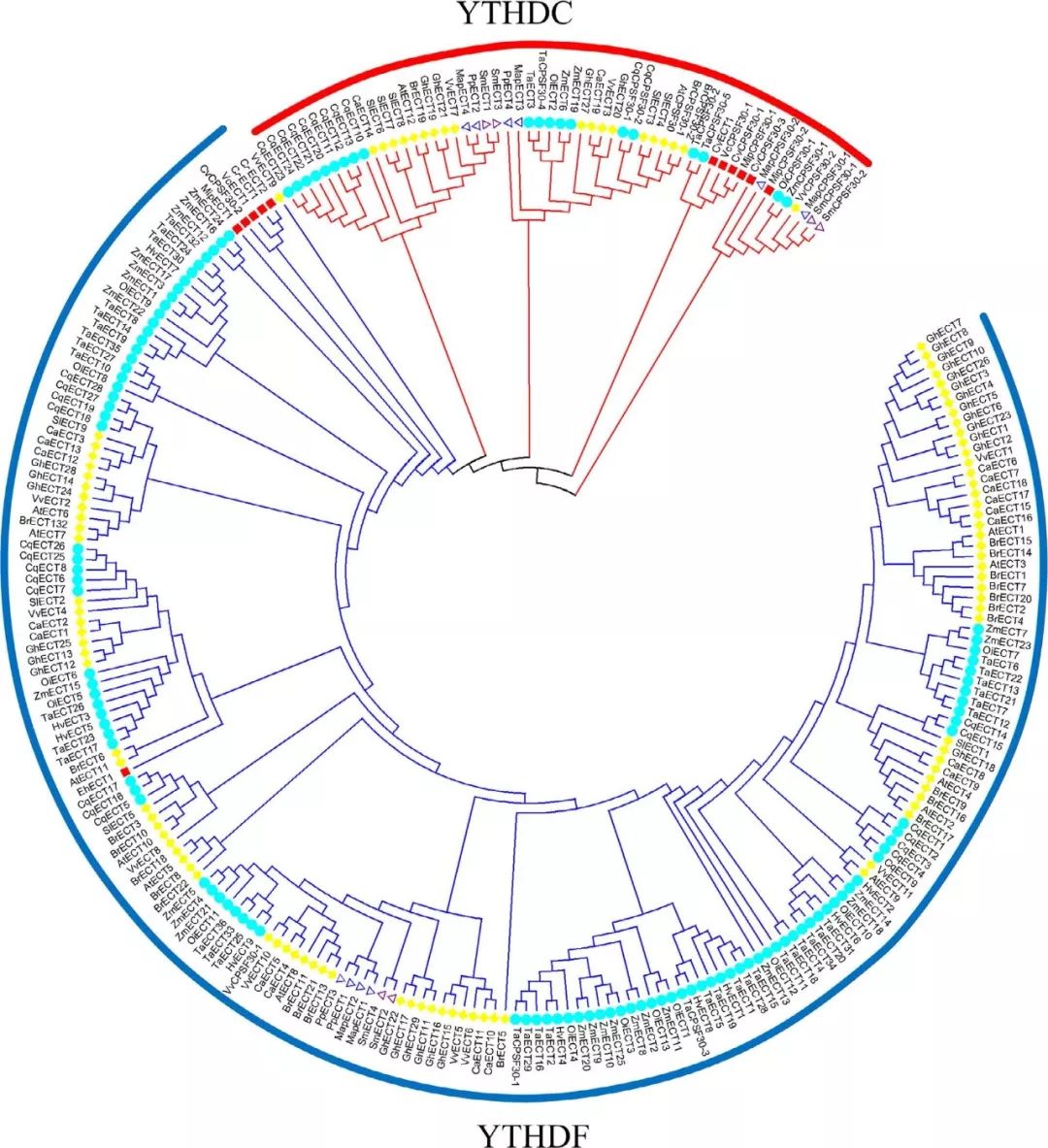
此外,m6A结合蛋白YTHDC1位于细胞核中,并介导了mRNA剪接。YTHDC1与pre-mRNA剪接因子SRSF3互作,促进其与带有m6A碱基修饰的RNA结合,抑制剪接因子SRSF10与m6A之间的结合,导致m6A修饰发生可逆。 LncRNA XIST可通过招募结合甲基酶复合物所需的蛋白RMB15和RBM15b,在XIST上诱导m6A甲基化。YTHDC1与m6A位点结合,促进X染色体基因中XIST介导的转录沉默。 在本文中,通过BLASTP和HMMER搜索(PF04146),共鉴定了22个植物中的278个m6A阅读蛋白。基于序列相似性,含YTH结构域的蛋白质可分为两个不同的亚家族:YTHDF和YTHDC。 YTHDF亚家族蛋白主要结合mRNA中的所有m6A位点,而YTHDC仅结合mRNAs和非编码RNAs中的某些核富集位点。在这项研究中,系统发育分析结果显示55个YTH蛋白可分为YTHDC亚家族,223个可分为YTHDF亚家族。 综上所述,这些甲基化转移酶、去甲基化酶和甲基化阅读蛋白的识别、分类和特征将有助于建立属于植物生物学中独有的m6A调控途径。 植物中m6A的功能描述与简介 m6A与mRNA加工 由于拟南芥拥有比较完整的突变体库,所以在研究m6A的模式植物上绝对是不二之选。 关于植物中m6A修饰或m6A相关酶的机制与功能研究仍然数量较少。首先,m6A被认为是最重要的RNA修饰之一,无论是mRNA降解、稳定性、翻译还是小RNA加工都与m6A修饰相关。 3′ UTR和5′ UTR区域的m6A修饰都与基因表达呈正相关,而mRNA其他区域的m6A修饰会导致拟南芥的基因表达降低(案例解析:m6A-seq揭示拟南芥RNA甲基化独特特性 | m6A专题)。 ECT2蛋白作为YTHDF2人同源蛋白,不仅调控核内的3′UTR加工,还通过结合带有m6A修饰的碱基,在促进mRNA稳定和控制胞质内的mRNA命运中起着关键作用(案例解析:m6A-YTH组件调控拟南芥叶片发育时间和形态发生 | m6A专题)。 最近的研究发现5′ UTR的m6A修饰可以影响蛋白质的翻译效率。第一个证据来自热休克应激反应的研究,从而导致m6A修饰的重新分布,使得5′ UTR区域内的m6A修饰比例增加,并在应激条件下促进蛋白质翻译。 在METTL3的突变体中,在mRNA 5′ UTR中含有m6A修饰会降低翻译效率,但在终止密码子或3′ UTR区域却没有类似现象,这表明5′ UTR上的m6A修饰会影响细胞的翻译效率。 此外,m6A修饰在mRNA上不同部位也能对翻译机调控制产生明显的影响。例如,eIF4E是翻译启动的关键蛋白。mRNA上3′ UTR有m6A可以招募阅读蛋白YTHDF1,通过与eIF4E/eIF4G/eIF3之间建立联系,将43s启动前复合体招募到5′cap,从而促进依赖cap的翻译。 然而,应激反应基因中的5′ UTR m6A修饰通过直接结合eIF3和随后招募非eIF4E依赖的43s核糖体复合物来独立促进翻译。 此外,在拟南芥中m6A去甲基化酶ALKBH9b还介导了mRNA沉默和衰变的过程。 m6A在植物发育中的作用 m6A修饰被认为在植物胚胎发育中起着关键作用。m6A甲基化转移酶在胚胎后表达水平降低,包括MTA、MTB、FIP37、Virilizer和HAKAI,导致m6A整体水平显著减少。这些m6A writers的表达降低或敲除产生了不同的分化表型,包括毛状枝、缺陷叶萌生、营养枝顶端分生组织过度增殖,最终导致胚胎致死。 ECT2的敲除增加了毛状体分支,表明ECT2对调节毛状体分支的发育至关重要。ALKBH10b的敲除导致开花延迟,也抑制了营养生长,表明ALKBH10b介导的mRNA去甲基化修饰影响mRNA转录的稳定性继而影响成花转变。 某些m6A相关基因在调控愈伤组织中转录因子活性方面起着不可或缺的作用,而其他m6A相关基因则与叶绿体以及类囊体功能相关。 此外,N6‐mAMP脱氨酶(MAPDA)将N6‐mAMP分解为IMP,这可能与根系发育有关,因为MAPDA的敲除会导致根系生长速度略有下降。 m6A在胁迫刺激下应激反应 越来越多的研究表明m6A也参与调节对各种非生物(abiotic)和生物胁迫(biotic stress)的反应。不同的细胞应反应可导致m6A在转录层面重新分布,导致m6A与5′UTR区域整体m6A水平的增加。 5′ UTR上的m6A修饰以一种不依赖帽子结构的方式来指导eIF3E的结合,以促进哺乳动物mRNA在热应激下的翻译启动机制。 m6A整个调控及修饰模式是动态的,约5-30%的m6A peak在紫外线、热休克或干扰素γ作用下发生改变,从而影响基因表达和剪接。 在植物中,许多研究揭示了m6A对应激反应的动态分子调控机制。ECT1和ECT2与应激反应蛋白CIPK1(Calcineurin B‐Like‐Interacting Protein Kinase1)能够特异性互作,并在不同外部条件刺激下,将钙信号传递到细胞核中。 尽管ECT2缺乏YTH结构域,但在细胞质中ECT2能与在3’ UTR含有m6A修饰的mRNA相互结合。这一由ECT2介导的对植物特异性m6A motif的识别,允许它在热应激条件下下将mRNA重新定位到应激颗粒(案例解析:m6A-YTH组件调控拟南芥叶片发育时间和形态发生 | m6A专题)。 其他研究还证实,在病原微生物的胁迫下,植物的m6A整体水平出现上升。西班牙某研究团队在PNAS曾经发文称,拟南芥去甲基化酶ALKBH9b降低了RNA整体的m6A水平,并可能通过与病毒外壳蛋白(coat protein)的相互作用,共同影响AMV(苜蓿花叶病毒)的侵染能力。ALKBH9b发生突变后,拟南芥体内病毒RNA整体m6A水平上升(病毒m6A专题 | 拟南芥去甲基化酶调控病毒上m6A修饰)。 中科院北京基因组研究所于军教授团队,曾经在2014年分别对水稻分化愈伤组织和叶片进行了m6A-seq和转录组测序。结果表明基因上发生m6A位点在正常水稻组织以及人和小鼠之间高度保守。 然而,一些m6A修饰位点在mRNA的区域也可能表现出物种特异性、细胞特异性或应激特异性调节。例如,与叶片相比,水稻愈伤组织中发生m6A修饰的基因及发生修饰的mRNA上的具体区间(如TSS、TES、3’ UTR及5’ UTR等)具有组织特异性。 拟南芥叶绿体和线粒体中带有碱基修饰的转录产物中m6A修饰占到了84%的比例,换句话说大部分碱基修饰都是m6A修饰。 另外64%和79%的m6A甲基化转录物在叶、花和根之间不同的组织表达方式有所不同。为了了解具体不同基因在不同位点特异性m6A修饰在mRNAs中发挥的功能,有必要更深入研究不同物种、细胞和外界压力下m6A修饰究竟有何差别。 如此看来m6A修饰似乎是控制基因表达、植物发育和生理过程的有效植物调控策略。 m6A甲基化酶在植物中的进化 为了了解m6A三种甲基化酶的进化历史和相互关系,文章分析了22个代表性植物中m6A甲基化转移酶。结果表明,在高等植物中,m6A writers的数量比低等植物中要多,这表明高等植物可能需要更精确的m6A修饰调控机制,以应对复杂多变的环境。 值得注意的是,m6A甲基化转移酶在外果皮中没有被鉴定出来。除变种的小球藻和莱茵衣藻外,蕨类植物物种和藻类物种均不含病毒和HAKAI相关蛋白。 莱茵衣藻是一种单细胞绿藻,属于陆生植物分化前较早的一种原始生物。因此这些结果可能表明,在这些植物物种中,VIRILIZER和HAKAI并不存在。所以我们推测,蕨类植物和大多数藻类可能有一个m6A修饰的替代机制或另一个至今仍未被鉴定的蛋白在行使m6A修饰的作用,而不仅仅是只有上面两个提到的m6A甲基化转移酶。 然而,目前有关这一领域的文献资料较少,希望今后有更多的课题组对低等植物m6A修饰机制进行更深入的研究。 有趣的是,异源六倍体小麦中拥有数量最为庞大的m6A甲基化转移酶。目前,对植物m6A甲基化转移酶的研究还比较少。大多数仍然集中在人、小鼠、果蝇、酵母等模式生物中。 按照目前研究来看,仅有拟南芥目前有少量的m6A甲基化转移酶报道。如若对植物中m6A甲基转移酶复合物开展鉴定,将有助于理解植物中m6A修饰发挥的巨大功能。 为了研究m6A甲基化转移酶在保守的核心结构域上的进化关系,我们预测MTA、MTB、FIP37和Virilizer中的保守蛋白结构域。
这22个植物中最主要的四种甲基化转移酶,能够识别出的保守结构域一些细节如上图所示。大多数MTA成员具有一个SAM(S-腺苷甲硫氨酸)甲基转移酶结合域,除藜麦外在所有研究物种中都高度保守。 此外,所有物种中的MTB蛋白也包含一个SAM甲基转移酶结合域或SAM结合位点MTA70,这是具有甲基化催化活性的结构域。 所有FIP37蛋白都包含一个WTAP结构域,而Virilizer蛋白在所有物种中都包含一个Virilizer motif。结果表明所有植物中,m6A甲基化转移酶一些关键区域的蛋白质序列和结构域都高度保守。
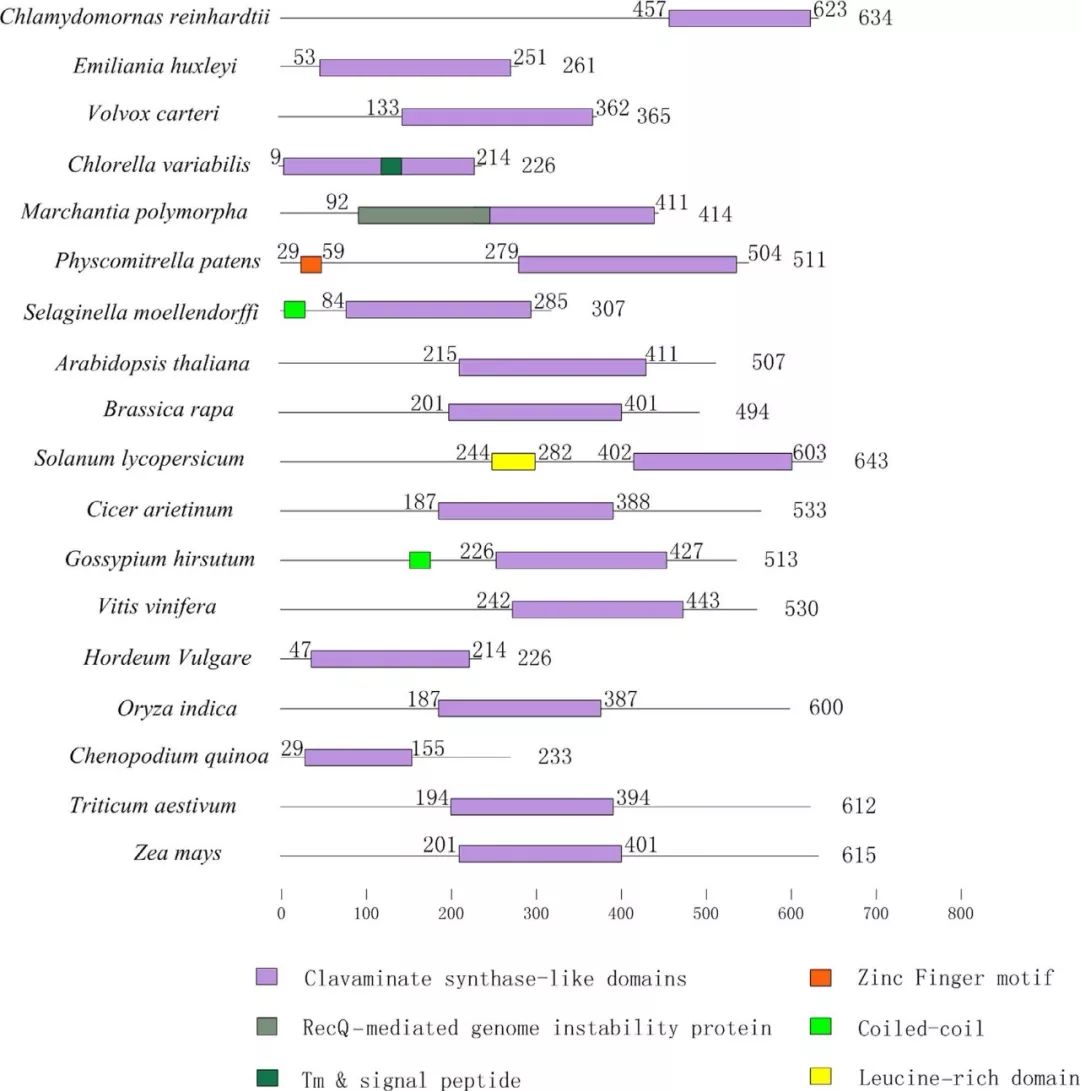
被子植物中ALKBH家族蛋白数量最多,其次是蕨类植物,最后是苔藓植物。 藻类中ALKBH家族蛋白整体被鉴定到的数量与其他植物相比特别低,但艾米莉亚纲植物除外。 在小麦和藜麦中分别鉴定出29和27种ALKBH家族蛋白。所研究物种之间的主要区别在于陆地植物的基因组含有大量的ALKBH蛋白,而藻类可能只有一个拷贝。 在植物从低单细胞生物向高花植物进化的过程中,进一步探索ALKBH蛋白的种类是如何扩展的,这将是非常重要的。 所有植物ALKBH家族成员彼此高度相似,并具有clavaminate synthase‐like合成酶结构域。 值得注意的是,髌骨酸浆菌有一个锌指基序,而番茄有一个富含亮氨酸拉链的结构域,这表明它们也可能作为转录因子来调节基因表达。 m6A在进化过程中可能保留某些保守功能。这种原始形态的蛋白通常具有类似的生物学功能,广泛分布于不同物种。
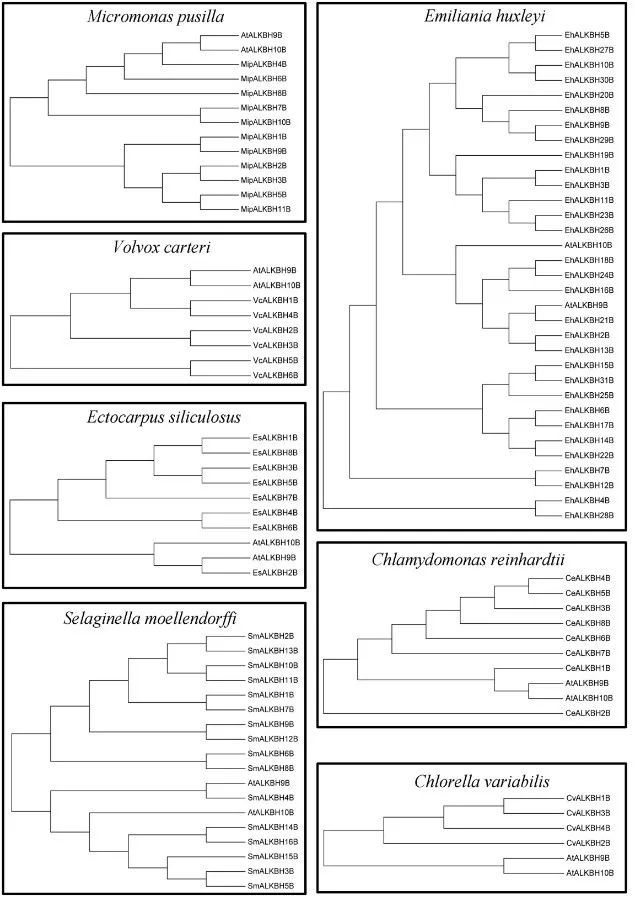
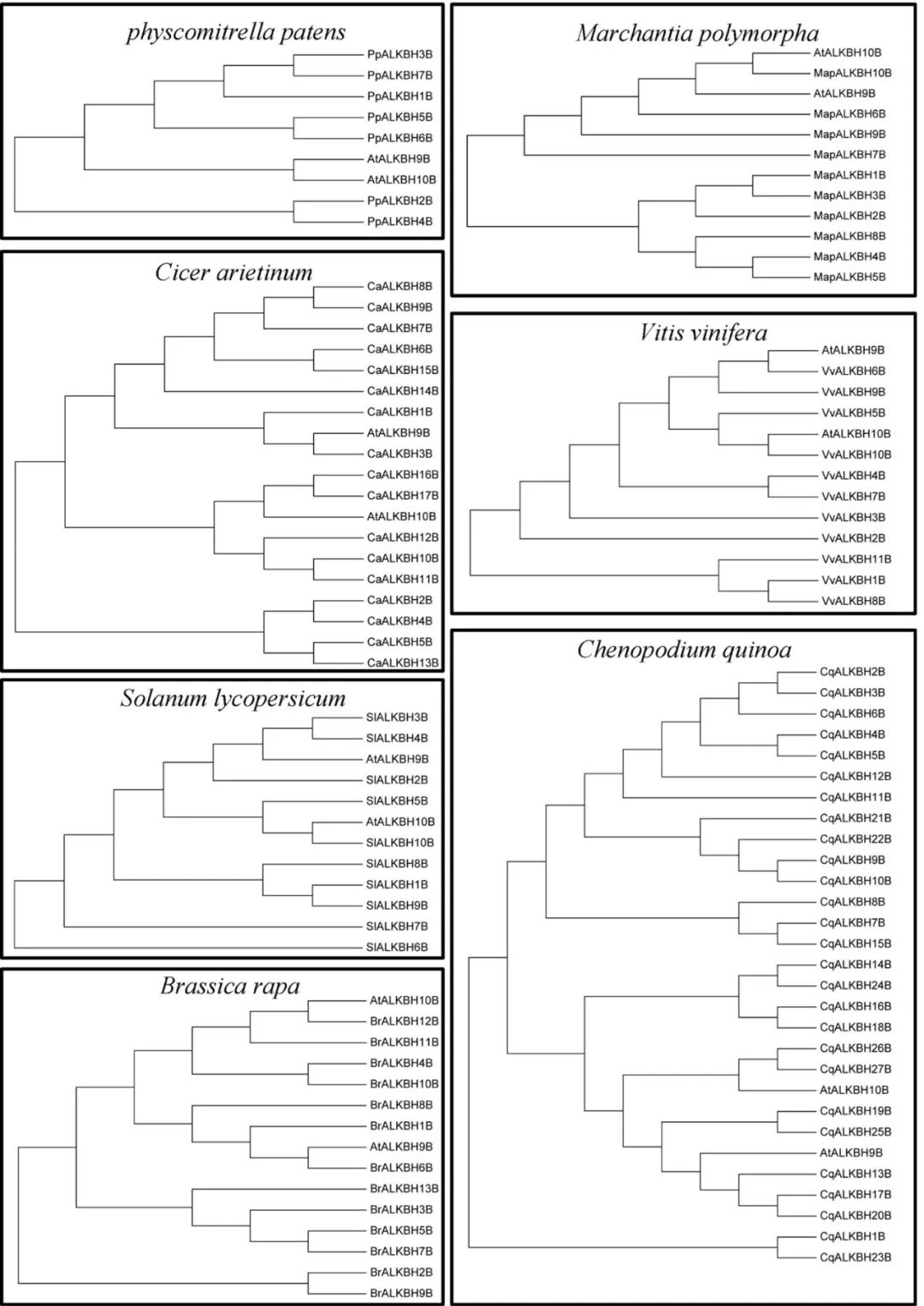
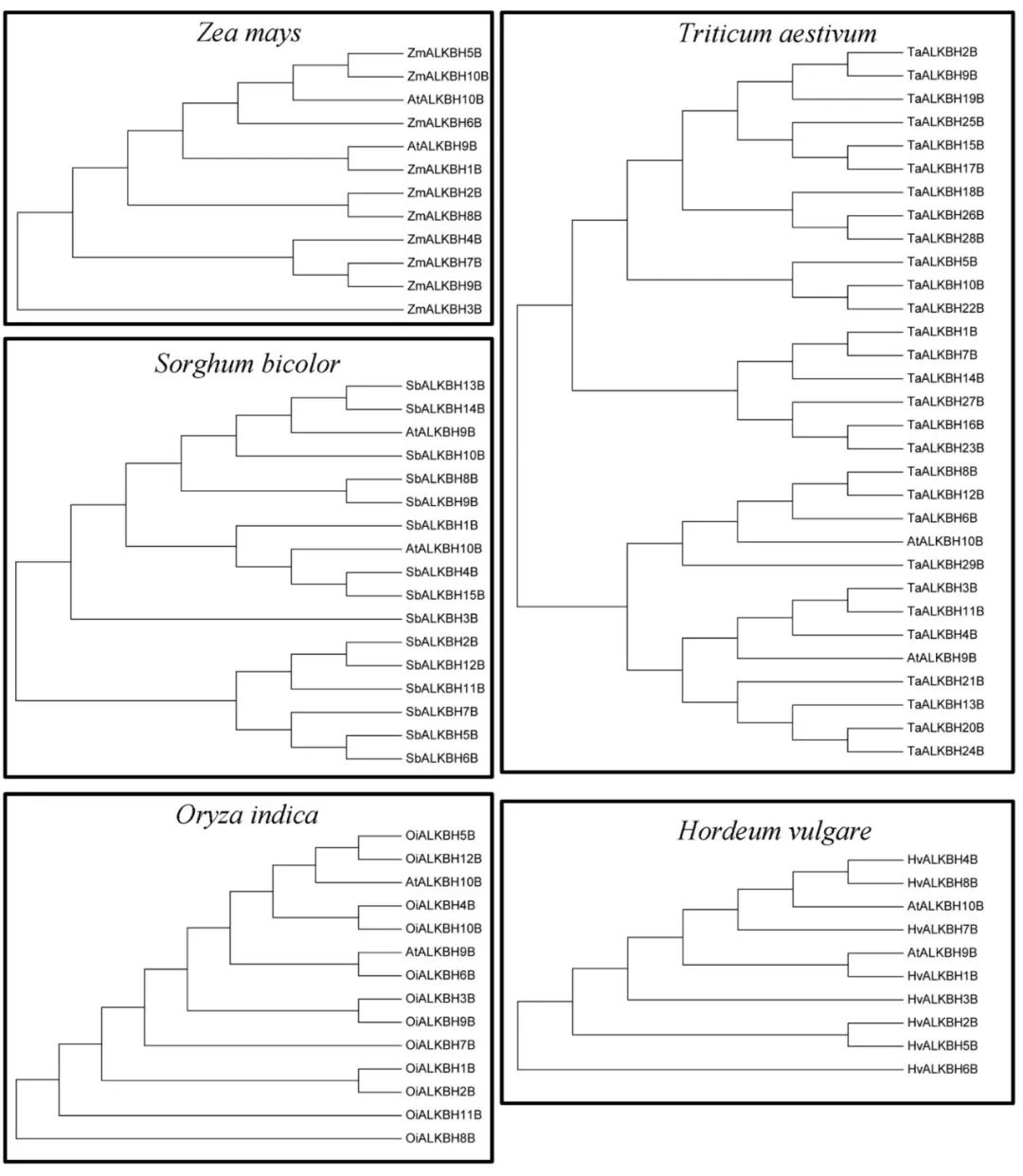
系统发育分析是一种快速和相对准确的鉴别同源蛋白质的方法。利用MEGA6采用NJ法基于序列相似性构建ALKBH蛋白系统发育树。如果蛋白具有类似m6A去甲基化的功能,则被认为是拟南芥ALKBH9b和ALKBH10b同源蛋白。 在水稻(Oryza indica)中鉴定出12种ALKBH蛋白质,其中,ALKBH5b、ALKBH6b和ALKBH12b被归类为潜在的m6A去甲基化酶。 此外,在小麦中鉴定出29种ALKBH蛋白,其中ALKBH4b、ALKBH6b和ALKBH29b被归类为m6A去甲基化酶。目前,虽然我们发现OsALKBH1可能与去甲基化酶很接近,但在水稻中至今仍然没有发现m6A去甲基化酶。 有人假设,作为Alkb的同源蛋白,EGL‐9可能参与植物RNA病毒中的RNA去甲基化修饰这一过程。这项研究的结果可能对试图理解植物中m6A调节机制有一些帮助。 植物比其他真核生物(包括酵母、人及其他哺乳动物)含有更多的YTH结构域蛋白。例如,在拟南芥中发现了13种含有YTH结构域的蛋白——ECT1-12和CPSF30。拟南芥中,这些蛋白数量明显高于哺乳动物中已经确定的5种蛋白(YTHDF1-3、YTHDC1-2)。 结果表明,YTH蛋白在植物中广泛存在。被子植物中的YTH蛋白的数量特别高,尤其在小麦、藜麦和陆地棉中分别发现了41、30和29种YTH蛋白。 在蕨类植物、苔藓植物和藻类中发现的YTH蛋白数量较少,其生物学重要性仍然未知。值得注意的是,分裂酵母中的YTH结构域蛋白MMI1不与m6A的腺嘌呤相互结合,但可以识别特定的核苷酸序列,这表明并非所有的YTH结构域都与m6A修饰的碱基结合有关。
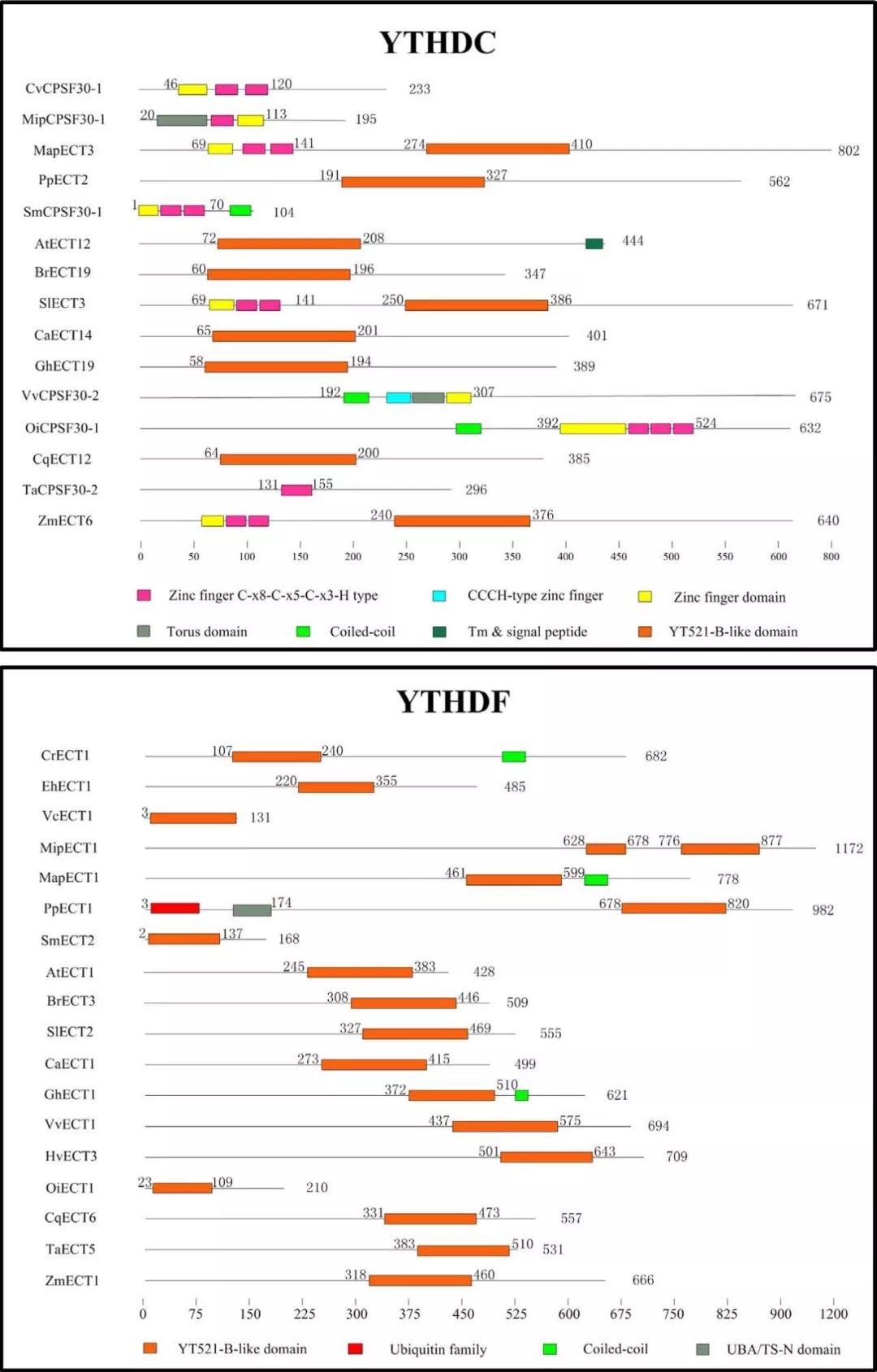
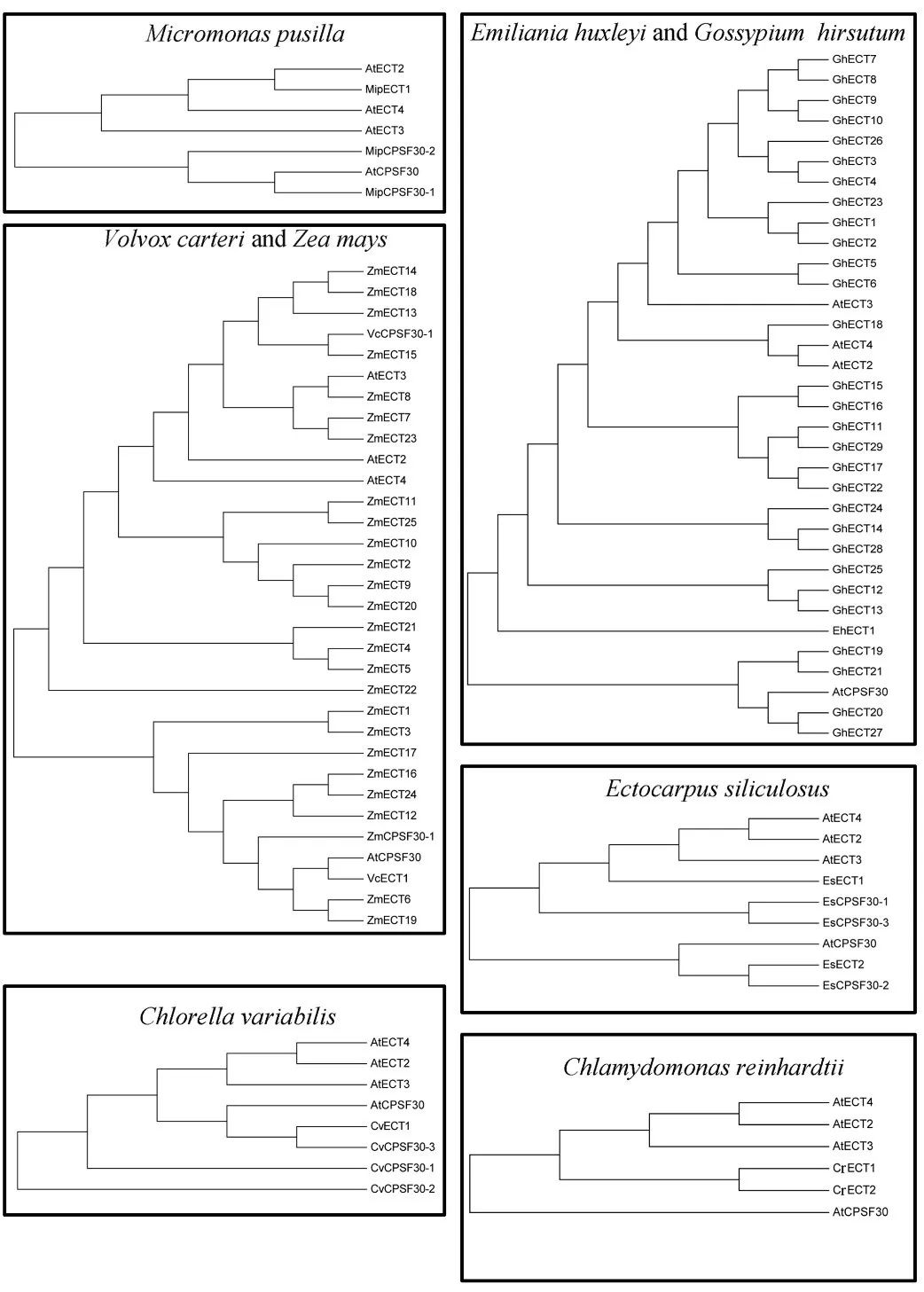
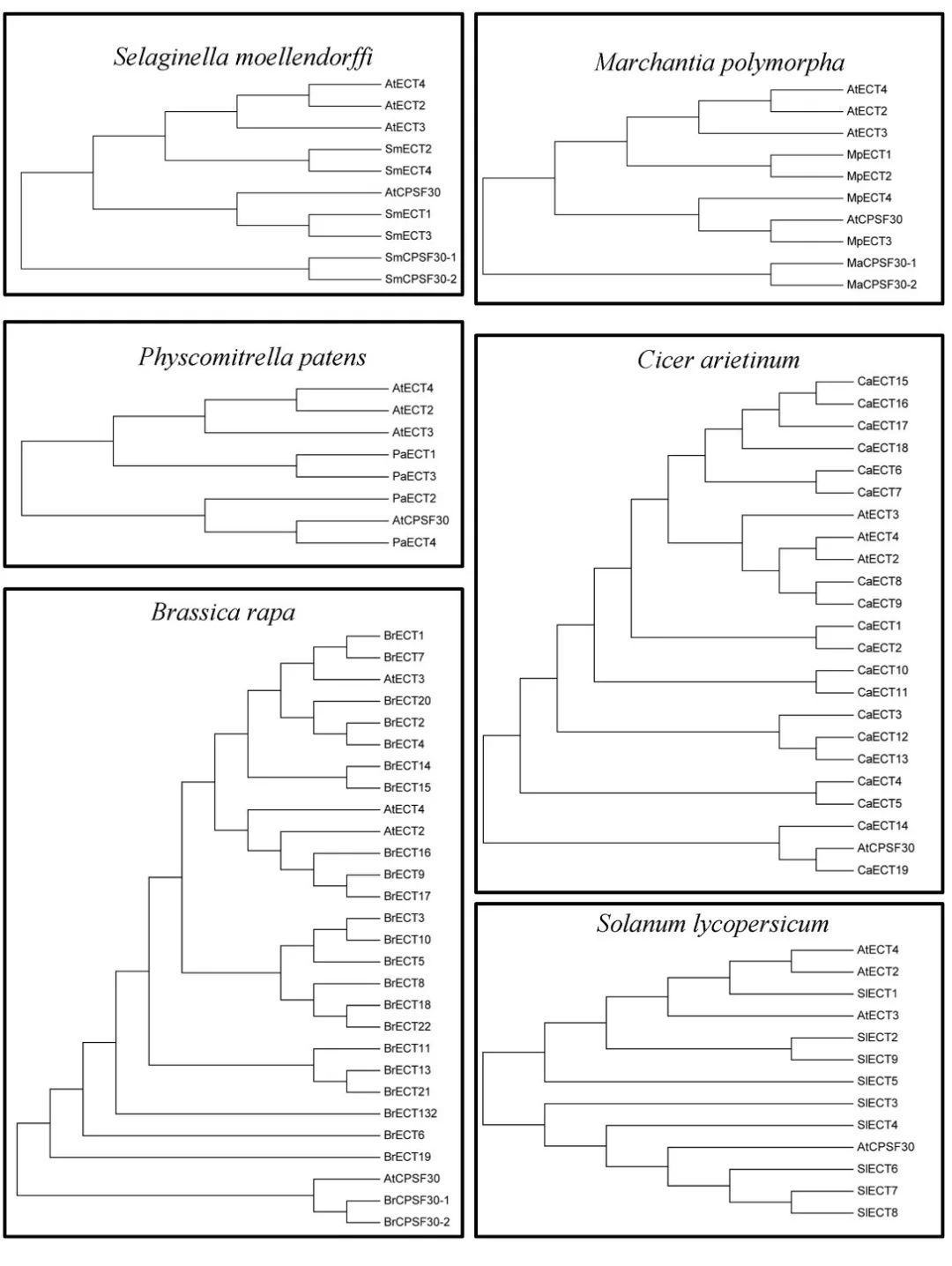
CPS30是植物多聚腺苷酸化复合物的成员之一,它属于拟南芥中的YTHDC蛋白家族下的一个亚型。所有植物中,YTHDC亚家族蛋白都含有YTH结构域或高度保守的锌指结构。 在所研究的5种藻类(蓝藻、埃米利亚、团藻、外果皮和衣藻)中均未发现YTHDC蛋白,表明大多数藻类在进化过程中没有发生YTHDC基因的复制事件。 值得注意的是,两种单子叶植物高粱和普通大麦也缺乏YTHDC蛋白,而所有双子叶植物、蕨类植物和苔藓植物物种都有一个或多个YTHDC家族蛋白成员。我们推测,在不同单子叶植物的进化过程中,这种YTHDC蛋白亚型可能已经消失。 一些研究表明,YTHDC1是调节内源性转录物可变剪切的关键蛋白之一。最重要的是,只有YTHDC1才能与XIST基因上的76个m6A修饰位点相互结合,这对抑制female cells中的基因起着十分关键的作用。YTHDC1将介导XIST功能性抑制X染色体上的基因表达。另一种阅读器蛋白YTHDC2则通过其解螺旋酶功能提高了HIF1α mRNA的翻译效率。 一个主要的功能YTH域从所有植物种的YTHDF亚科成员中被鉴定了出来。是高度保守,主要定位在细胞质。 小麦中的YTH结构域位于蛋白N末端,这表明ECT5可能结合来自可翻译的带有m6A修饰的mRNA并转移到加工体。相反,卷柏和水稻中的YTH结构域位于蛋白C端,这表明ECT2和ECT1选择性结合带m6A修饰的mRNA。 所有物种都含有至少一个YTHDF亚科蛋白,表明植物的共同祖先可能经历了相似的基因复制,这些复制的产物进一步进化出新的特征。 在拟南芥中,ECT2、ECT3和ECT4被确认为m6A阅读担保,并且能够识别带有m6A修饰的碱基及mRNA。 与YTH结构域相关的另一种蛋白质是拟南芥中的CPSF30。CPSF30定位于细胞核,通过调节参与拟南芥水杨酸途径的3′端mRNA的剪接,对外部刺激作出反应,并发挥重要作用。
通过构建系统发育树,已在21个其他物种中鉴定出拟南芥ECT2/3/4和CPSF30的同源蛋白。在小麦中鉴定出了YTH蛋白共41个,只有8种蛋白被发现是潜在的m6A阅读蛋白。 在水稻中鉴定出14种YTH蛋白,其中3种蛋白被发现是潜在的m6A阅读蛋白。 上述从小麦和水稻中鉴定到的蛋白,被认为具有与拟南芥相似的功能,但目前尚不清楚这些蛋白是否真的作为植物中的m6A阅读蛋白。 综上所述,m6A甲基化酶自植物早期进化以来,就存在于许多植物共同祖先的遗传信息中,与这些蛋白相关的结构域在藻类、蕨类植物和被子植物中都高度保守。但是某些蛋白似乎在进化过程中丢失了。进一步深入了解低、高等植物之间m6A甲基化酶的进化关系,可以能更好地了解它们的功能。 结论及未来的展望 在本文中,我们系统地回顾了植物m6A甲基化酶的蛋白结构、组成、功能和进化。对这些m6A相关蛋白的氨基酸序列进行比较研究后,将有助于理解m6A修饰的动态过程及其功能作用,并加深我们对m6A如何在植物中发挥RNA表观遗传调控的理解。 近几年来,为了检测RNA上的m6A修饰,国内外许多课题组开发了一系列高效的高通量检测工具。m6A-seq也叫MeRIP-seq,采用特异性较强的m6A抗体,与带有m6A修饰的RNA片段结合进行高通量测序,是RIP-seq的一种特殊形式。 此外,miCLIP-seq可以做到几乎单碱基分辨率,而m6A-seq只能做到对某个高甲基化区域进行分析。另外还包括JACS上发表的低通量m6A单碱基分辨率检测方法,以及最新骆观正课题组发明的非抗体依赖的ACA内切酶法,都在m6A检测的精度和深度上有了质的飞越。 在数据库上,中山大学的任间教授和屈良鹄教授分别构建了比较完整的m6A数据库。 另外中科院细胞生化所的陈玲玲教授和杨力教授在circRNA m6A修饰的研究上有了新突破,还开发了一系列新的算法来检测circRNA上m6A修饰情况。 尽管m6A研究已经取得了不少突破,但仍需要进一步的工作来全面了解m6A的功能。 首先,应该在植物中全面挖掘m6A的writers、erasers和readers的“真实身份”,这将有助于理解植物物种中多种类型RNA分子的甲基化水平是如何调节的。 其次,应该仔细验证m6A甲基化酶的表达模式,因为来自同一基因家族的不同的m6A甲基化酶,会产生不同的mRNA转运或翻译机制。 第三,虽然对m6A在植物中的作用和分子机制的认识逐渐增加,但大多数的研究都集中在模式植物拟南芥中,而对其他重要的经济作物粮食作物的研究却很少。目前尚不清楚m6A修饰是如何调节器官形成、细胞分裂、生长发育,特别是小麦、大麦和水稻等世界主要作物。今后对作物RNA上的m6A进行深入研究,可以进一步提高作物种子产量,并且可能还能为作物抗逆境胁迫能力的提高提供有参考价值的信息。返回搜狐,查看更多 |
【本文地址】
今日新闻 |
点击排行 |
|
推荐新闻 |
图片新闻 |
|
专题文章 |