全文版 |
您所在的位置:网站首页 › 药理学的研究内容为 › 全文版 |
全文版
|
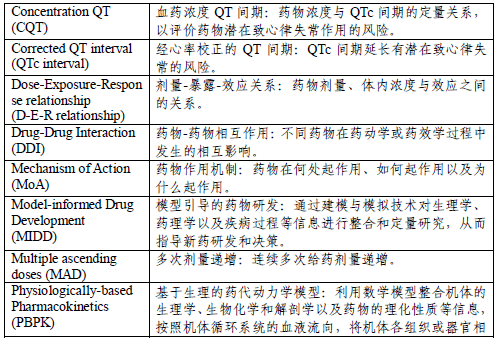
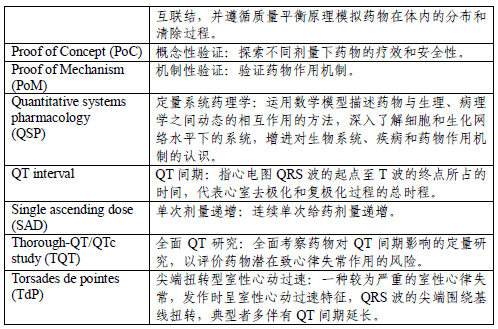
2. 药效动力学研究 (三)暴露-效应关系研究 五、研究方法 (一)经典研究方法 (二)基于模型的研究方法 (三)其他前沿方法 六、研究设计的总体考虑 (一)独立研究设计 (二)合并研究设计 (三)嵌套研究设计 七、化学创新药和生物制品创新药的基本考虑 八、监管考虑 (一)申报资料 (二)说明书 (三)其他情形 九、缩略语及含义 十、参考文献 一 前言 临床药理学研究作为创新药上市前临床研究不可缺失的研究内容,可在创新药整体研发策略和各关键时间点,结合临床研究整体进度进行科学合理地研究设计和考虑。临床药理学研究结果是支持探索性和确证性临床研究设计和上市申请的重要科学依据,同时也是创新药上市申请申报资料中常规包含的内容,研究结果用于支持说明书撰写。 本指导原则旨在为创新药研发过程中临床药理学研究的研究内容、研究时机、总体设计等关键问题提出建议。这些建议均需基于“具体药物具体问题具体分析”的原则综合评估。 本指导原则所述创新药包含化学药创新药和生物制品创新药(其中细胞治疗产品、基因治疗产品等可视情况参考)。各项创新药临床药理学研究的具体设计和数据分析等可参考相关指导原则,比如《化学药创新药临床单次和多次给药剂量递增药代动力学研究技术指导原则》、《治疗性蛋白药物临床药代动力学研究技术指导原则》、《新药研发过程中食物影响研究技术指导原则》、《药物相互作用研究技术指导原则》、《肾功能不全患者药代动力学研究技术指导原则》、《创新药人体生物利用度和生物等效性研究技术指导原则》、《模型引导的药物研发技术指导原则》、《群体药代动力学研究技术指导原则》等。 本指导原则主要围绕创新药上市前临床药理学研究相关问题进行阐述。创新药获批上市后,根据不同的研究目的或监管要求等需开展进一步的临床药理学研究时,其研究理念、研究设计和技术方法等,可参考本指导原则。 二 创新药临床药理学研究的目的和作用 科学合理的临床药理学(包括定量药理学)研究有助于深入理解药物在体内的作用过程和机制等,从而提高创新药研发效率和成功率。近些年,创新药临床药理学研究的理念和策略、技术手段和方法等较传统模式发生了改变,不局限于临床药代动力学(Pharmacokinetics, PK)研究,而是以研究问题为导向,注重将创新药的剂量、暴露量、生物标志物、临床终点(包括有效性和安全性终点)进行量化分析,为后续临床研究的设计提供指导以及为最终的药品说明书推荐用法用量。临床药理学研究应贯穿于创新药上市前和上市后的全生命周期中。 定量药理学对于创新药研发具有重要意义。模型引导的药物研发(Model-informed Drug Development, MIDD)理念贯穿创新药研发全过程。建模与模拟技术可在多个关键决策点发挥重要作用。在创新药上市前的整个临床研究过程中,可采用模型引导的药物研发模式,不断积累研究数据,并及时分析剂量-暴露-效应关系(Dose-exposure-response relationship, D-E-R relationship)及其关键影响因素,为后续研发和注册提供依据,包括选择优化的目标适应症人群/亚人群、用法用量等。 创新药获得上市批准时,会同时获批药品说明书。说明书中通常包含药品的基本属性信息、适应症、用法用量和临床研究结果等上市前的研究结果。创新药临床药理学研究结果所提供的支持性证据贯穿在整个药品说明书中,将体现在说明书中的【用法用量】、【药代动力学】、【药物相互作用】、【药物过量】、【禁忌】和【注意事项】等项目内容中,其他比如特殊人群用药的内容也体现了临床药理学研究结果,如肝功能不全患者、肾功能不全患者、儿童、老年人以及孕妇和哺乳期妇女等。 三 临床药理学研究的总体计划 临床药理学研究是创新药临床研发的组成部分,建议早期制定创新药临床药理学研究的整体计划,制定研究计划时需进行系统考虑。临床药理学研究计划通常包含各项临床药理学研究的计划执行时间(处于临床整体研发的某个阶段)及其研究内容和目的等。在临床研发进展到不同阶段时(比如机制性验证(Proof of Mechanism, PoM)、概念性验证(Proof of Concept, PoC)和关键性临床研究),根据已获得的研究结果和相关领域进展对研究计划进行及时更新。 临床药理学研究计划包含但不限于临床药理学研究计划列表、计划开展时间等内容,可涵盖模型引导的药物研发计划(如有)和生物标志物研究计划(如有)等。 临床药理学研究计划列表通常包含临床药理学研究内容、开展相关研究的考虑、研究时机(处于临床整体研发的某个阶段)以及相关研究总体设计考虑等。模型引导的药物研发计划通常对整体临床研发计划中为解决重要问题而开展的模型分析进行计划。生物标志物研究计划阐明如何采用药理学生物标志物来支持PoM研究,从而为PoC研究中的用法用量选择提供依据,计划同时包括检测方法的开发和验证的说明。 四 研究内容和研究时机 创新药临床药理学研究是问题导向的研究,通常根据药物特性、拟开发适应症和临床治疗领域的特点设计相应的研究,往往包含多个研究项目。需说明的是,创新药临床药理学研究包括但不限于本指导原则所列出的以下研究内容,应基于药物特性、适应症特点、临床需求等综合评估需开展的研究内容,比如可能影响药物人体PK特征的内在因素方面,除了儿科人群和肝/肾功能不全患者研究之外,还需考虑开展老年人、妊娠、哺乳期、其他器官功能不全等人群研究,有时需考虑开展遗传药理学研究。 需关注,临床药理学研究结果作为指导临床用药的科学依据时,通常需结合暴露-效应关系分析进行综合判断,比如是否需根据食物影响研究结果进而设定服药和进餐的关系,不仅与食物对药物体内暴露影响的程度有关,更重要的是需结合暴露-效应关系分析判断该程度的影响是否具有临床意义,即是否对临床用药安全有效性产生影响。 除此之外,建议汇总临床研发阶段各项研究中收集的PK数据,综合分析影响药物PK特征的内在因素和外在因素,包括但不限于年龄、性别、体重、种族、药物相互作用等。 (一)药代动力学研究 根据非临床研究结果可对创新药在人体内的吸收、分布、代谢等情况进行预测,并可用以解释临床研究结果。比如考察肠吸收和通过血脑屏障能力的渗透性研究、体外蛋白结合研究、肝脏代谢和药物相互作用研究等。体外药物代谢和药效学研究通常为体内研究设计提供依据,比如体外研究结果可为后续如体内药物相互作用临床研究以及基于生理的药代动力学(Physiologically-based Pharmacokinetic, PBPK)模型构建等提供设计依据和重要参数。早期获得的体外研究结果将有助于后续临床研究的开展。有时需要在创新药临床研发全程根据临床研究结果,适时设计针对性的体外研究以回答某些特定的临床药理学问题。 1. 单次/多次给药剂量递增研究 单次给药剂量递增(Single-ascending Dose, SAD)研究和多次给药剂量递增(Multiple-ascending Doses,MAD)研究通常包含安全耐受性评价和PK评价等。其中,单次/多次给药剂量递增PK研究是最早探索创新药人体内PK特征并关联暴露量与药物安全性(有时包含药效)关系的研究,可结合在耐受性研究中开展。 SAD研究可以在较宽剂量范围内获得创新药单次给药不同剂量下的安全性和耐受性、PK特征、剂量比例特征、线性范围等数据。MAD研究可获得创新药多次给药不同剂量下的安全性和耐受性、PK特征、剂量比例特征、线性范围、时间依赖性、蓄积程度等数据。 通过早期临床PK研究,可以探索和了解给药剂量与药物体内暴露之间的关系,评价药物制剂的合理性及指导制剂优化等。为了更早和更好地了解暴露-效应关系,建议在SAD和MAD研究中尽可能考察药物在较宽剂量范围内的PK及药效动力学(Pharmacodynamics, PD;如可能),为后续临床研究方案的选择提供依据。 早期SAD和MAD研究通常在健康志愿者中进行。有时,SAD和MAD研究可根据药物的特性、适应症特点和临床需求等选择患者开展研究。 2. 患者药代动力学研究 (1)研究内容 患者PK研究主要研究药物在目标适应症人群中的PK特征,以及患者与健康志愿者(如有)的PK差异。患者PK研究结果为以患者为受试者的探索性和确证性临床研究提供设计依据。患者PK研究有时是独立研究,有时嵌套在评估患者疗效和安全性的探索性和确证性临床研究中。 (2)研究时机 在探索性和确证性临床研究之前获得患者PK研究数据(如在I期或II期临床研究早期阶段开展小样本患者PK研究,以获取患者PK特征),有助于认知创新药在目标适应症患者人群和亚群体中的PK特征,为后续临床研究设计提供重要支持性依据。创新药申报上市时通常需提交患者PK研究结果。 同样,建议在患者人群尽早建立暴露-效应关系,并在此基础上进行剂量优化和个体差异的评估。 3. 物质平衡研究 (1)研究内容 物质平衡研究考察创新药在人体内的吸收、代谢和排泄特征,阐明原型药及其代谢产物在人体内代谢/消除的途径和时间过程等问题,其对全面认知创新药的临床用药安全有效性结果具有重要意义。物质平衡研究结果对药物相互作用研究和探索性/确证性临床研究设计具有重要参考作用,对肝/肾功能不全人群研究的必要性提供依据。建议关注在人体物质平衡研究中发现的未在动物实验中观察到的新代谢产物和与其他物种体内不成比例的高浓度的代谢产物。 物质平衡研究可以采用放射性同位素示踪法或其他合适的方法开展。 (2)研究时机 物质平衡研究通常建议在确证性临床研究开始前完成。建议在早期临床研究中尽早开展体循环代谢产物的定性研究,并根据人体代谢研究结果与动物代谢研究结果的差异,考虑后续完整的物质平衡研究的开展时机问题。 如果发现人体特有代谢物、活性代谢物和/或高比例代谢物会对后期临床研究检测对象和安全性事件分析等问题产生重要影响,建议统筹考虑研究时机问题。采用放射性同位素示踪法时,由于放射性同位素标记工作耗时较长,建议尽早准备相关工作。 4. 食物影响研究 (1)研究内容 食物影响研究考察的是与不进餐相比,受试者进餐后创新药体内暴露的变化,以及不同类型的饮食对暴露的影响。 食物影响研究结果可用以支持后续临床研究中受试者服药和饮食类型或时间的设计安排,并最终用以指导撰写说明书。特别指出,食物引起的暴露的变化最终能否对临床用药带来明显影响,需结合临床研究的安全有效性结果以及暴露-效应关系分析进行综合评价。当食物引起的暴露水平的变化对临床用药有明显影响时,需要在说明书中明确患者服药时是否可以同时饮食或者服药和饮食之间的时间窗。如拟上市制剂与临床研究所用制剂不同,建议关注拟上市制剂的食物影响问题。 (2)研究时机 可以考虑在临床研究早期初步考察食物对创新药制剂体内暴露的影响,为后续临床研究设计提供依据。 最好在确证性临床研究前完成食物影响研究,研究结果用以指导确证性临床研究中,受试者饮食和服药时间关系的设计,避免食物作为混杂因素影响对创新药安全性和有效性的评价。 如果在探索性和确证性临床研究前未考察食物对新药体内暴露的影响,且临床研究中受试者的饮食和服药情况未加控制,则食物对暴露量的影响可干扰对创新药安全性和有效性结果的评价分析,可能导致研究结果的错误解读,影响创新药研发。 5. 药物相互作用研究 (1)研究内容 应对创新药确定的和可能的产生药物相互作用的因素如代谢酶、转运体等开展临床药物相互作用(Drug-Drug Interaction, DDI)研究,研究结果将指导后续临床研究入排标准、联合用药、剂量调整等设计问题,并将作为说明书中相关内容的撰写依据。 (2)研究时机 通常可基于体外酶学、转运体等研究结果,决定DDI研究开展的时机,以及决定需考察的可能影响创新药体内暴露的代谢酶或转运体等。如果根据临床前实验或临床研究结果明确了特定代谢酶或转运体对药物的代谢或转运起主导作用,或药物对主要的代谢酶或转运体有明显抑制或诱导作用,建议开展相应的临床DDI研究。对临床用药有指导意义的DDI研究,应在创新药注册申报前完成。 在临床开发的早期开展DDI研究,有助于后续成药性评价、剂量调整建议以及探索性和确证性临床研究的入排标准设计。否则,在获得DDI研究结果前,通常需要在后续临床研究中设计相对严格的入排标准,以确保受试者的安全性和/或有效性。如果不能通过临床研究方案中的入排标准控制DDI的风险,则需要采用根据DDI影响的程度对创新药进行剂量调整的研究设计。 当药物经多种代谢酶代谢且各代谢酶均对药物的代谢起关键作用时,可能需要开展多项体内DDI研究。这些研究可以在整体创新药临床研究策略中进行合理安排。 在后期评估安全性和有效性的临床研究中,可以收集患者合并用药信息,通过患者群体药代动力学等方法评估早期的健康志愿者DDI研究结果是否适用于患者人群,并有助于发现可能的新的DDI。 6. 肝/肾功能不全患者PK研究 (1)研究内容 创新药拟开发适应症人群包含肝脏和/或肾脏功能不全患者时应考虑开展相关患者人群的PK研究。 建议在创新药临床研发过程中评估肝/肾功能不全对药物PK的影响,以使肝/肾功能不全患者可以考虑被纳入后续临床研究中。 肝脏和肾脏作为两大最重要的药物代谢和排泄途径,对多数创新药物尤其是化学药物的PK都可能产生有临床意义的影响。肝功能或肾功能不全的患者对一些创新药体内暴露量可能有一定程度的影响,从而可能影响临床用药安全有效性。如果创新药获批上市后不排除会有肝功能不全或肾功能不全患者用药,根据药物特性、代谢、排泄机制及给药途径等,若无法排除肝/肾功能不全对创新药体内暴露量无影响,则在上市前开展肝功能和/或肾功能不全患者人群的PK等研究是必要的。 肝功能不全患者的肝酶代谢能力和胆道排泄功能可能会有不同程度的降低,这对主要经肝脏代谢或排泄的创新药PK可能产生不同程度的影响,且毒性或者活性代谢物的产生也会受到影响,故创新药通常需要开展肝功能不全人群的PK研究。研究结果将用以指导后续临床研究受试人群的用药剂量调整,并指导说明书撰写。 肾功能不全患者由于肾脏病理改变,导致肾小球滤过、肾小管重吸收和分泌等功能发生改变,从而对主要通过肾脏排泄的创新药产生不同程度的体内PK的影响。即使非主要通过肾脏消除的创新药,其吸收、蛋白结合率、组织分布甚至其在肝脏和肠道的代谢酶和转运体也会在肾功能降低的情况下发生变化。通常创新药需要开展肾功能不全患者体内PK研究。研究结果将用以指导后续临床研究相关研究人群的用药剂量调整,并指导说明书撰写。 (2)研究时机 建议在创新药临床研发过程中,尽早评估肝/肾功能不全对药物PK的影响,目的是通过前瞻性的研究进行适当的剂量调整,以使肝/肾功能不全患者可以考虑被纳入后续临床研究中。 7. 儿科人群研究 除非拟上市适应症或人群确定不包含儿科患者人群,其他情况通常需在批准儿科人群用药前开展儿科人群研究。研究结果用以指导儿科人群用药方案的制定。 儿童的生长发育和疾病状态等因素可能会不同程度影响药物的吸收、分布、代谢和排泄,导致儿童和成人之间、不同年龄段患儿之间的暴露量以及临床的获益和风险均可能不同。因此,在考虑到目标适应症人群年龄的基础上,如必须开展儿科人群研究,应优先在较大年龄段的患儿中开展儿科人群PK研究。 儿科人群研究建议参考儿科药物研发的相关法规文件和技术要求。 8. 生物利用度和生物等效性研究 (1)研究内容 在创新药临床研究早期阶段,可能通过相对生物利用度研究考察不同的处方、工艺、剂型、规格、给药途径等情况下的暴露量和吸收速率的相似性情况,或结合创新药理化性质和拟开发的目标适应症特点等,不断完善创新药制剂的处方和工艺,为创新药后续开发提供依据。 有时需考虑开展绝对生物利用度研究。比如创新药同时开发静脉和非静脉给药剂型时,此时可通过绝对生物利用度研究获得非静脉给药途径的绝对吸收百分数。 创新药关键临床研究前甚至上市前(完成关键临床研究后)改变剂型、改变生产场地或放大生产批量等情况时,需按照相关指导原则要求,充分评估其对制剂性能的影响,根据风险评估结果开展研究,必要时需开展生物等效性研究,以支持与此前完成临床研究数据的可桥接性。具体要求建议参考相关技术指导原则。 (2)研究时机 临床研究全过程中都有开展生物利用度/生物等效性研究的可能性。较晚开展关键生物利用度/生物等效性研究可能有一定风险,比如发生药学重大变更的制剂的关键临床研究已经开展甚至已经完成,但是变更前后的制剂的生物等效性研究结果未能达到生物等效,则使用两种制剂获得的临床研究数据将可能无法桥接。 (二)药效动力学研究 1. 药效学指标 广义的药物效应包括疗效和不良反应。本指导原则中药物效应相关内容适用于基于药物作用机理的上述两种不同的效应。 表征药物效应的指标有多种,包括生物标志物、替代终点、临床终点等。 (1)生物标志物 生物标志物在量效关系研究中被广泛应用,可被定量、动态检测。生物标志物对创新药临床研究设计和上市剂量选择提供依据。 生物标志物的变化对药物作用机理进行验证的同时,可对药物效应进行定量、动态地评估。 如果药物靶点在健康志愿者和患者人群都存在,药物效应研究可以最早开始于健康志愿者的早期临床研究。为了尽早了解认知药物的药理学特性,建议尽早收集生物标志物信息,不断基于新获得的研究数据进行PK/PD分析。 (2)替代终点 在患者人群中进行的早期临床研究,药效学指标除了与药物作用靶点相关的生物标志物外,也可以是替代终点,比如血压、血脂、糖化血红蛋白或者肿瘤响应率等。 替代终点一般具有循证医学证据,与临床终点存在明确的相关性,并且这类指标一般在短期临床研究中可定量、动态观察。这类指标虽然不是金标准的临床终点,但其对创新药用法用量的选择具有重要指导意义,并且对临床终点的预测非常重要。由于替代终点较临床终点可在相对早期获得反应结果,是制定和优化患者人群用法用量常用的具有可行性的评价指标。 (3)临床终点 临床终点是创新药研发药效学的最佳指标。临床终点通常需要较长时间发生变化,需要较长时间的随访观察,所以相应临床研究周期长、样本量大、成本高。但也正因如此,创新药剂量优化依然可以继续通过以临床终点金标准为药效学指标的确证性临床研究进行。在大样本量的确证性临床研究中,以患者为受试者的整个人群和各种亚群体的量效关系都具有足够数据进行量化,从而支持以最终临床终点为指导,进行整个患者人群和不同亚群体的最优化用法用量的制定。故很有必要针对确证性临床研究和其他相关研究结果进行量效关系分析,选择用以申报上市的最优用法用量。 2. 药效动力学研究 随着体内研究数据的积累,体外药效学研究数据的权重通常逐渐降低,但是对于某些适应症,体外药效学研究对后期临床研究的意义非常重大。比如抗感染药物,通常通过体外药效学研究获得药物对病原体的杀菌效果以及其他重要的药效学指标,对临床研究的剂量选择和给药频率有重要的指导意义。有些特殊情况下无法开展人体研究,体外药效学研究数据可以作为PK/PD分析的支持性证据。 (1)临床研究中的药效动力学研究 在支持创新药上市的确证性临床研究之前,通常通过开展探索性临床研究探索合适的患者人群、剂量、给药时间和给药频率等。从临床药理学剂量优化的角度,探索性临床研究通常包含对多个剂量水平或者不同给药频率等不同给药方案的探索,研究结果为确证性临床研究的用法用量提供重要依据。 对于某些适应症,早期临床研究的疗效和安全性指标不能准确预测长期临床疗效和安全性指标,从临床药理学剂量优化的角度,确证性临床研究可考虑选择不同剂量水平进行以长期临床疗效和安全性为终点指标的研究,从而以长期临床疗效和安全性指标为基础,优化最终整体患者和各个亚群体的用法用量。建议在确证性临床研究中收集尽可能多患者的PK数据,以便进行患者群体药代动力学分析和暴露-效应关系分析,为用法用量和药品说明书的撰写提供理论依据。 (2)QT/QTc间期延长临床研究 药物有时引起心室复极化延迟,表现为心电图QT间期延长,有潜在可能出现尖端扭转性室性心动过速(TdP),进而导致猝死。对于创新药,通常需结合非临床和临床的研究数据,综合评估QT间期延长的风险。 研究内容: ICH要求所有具有系统生物利用度的非抗心律失常药物在上市前需进行QT/QTc间期延长以及潜在致心律失常作用的临床研究。包括全面QT研究(TQT研究)或血药浓度-QTc(CQT)间期定量分析研究。 研究时机: QT/QTc间期延长临床研究通常在健康志愿者中进行,出于安全性考虑时可以选择患者人群。CQT研究可在早期单次给药剂量递增和多次给药剂量递增阶段开展。如需进行TQT研究,通常在确证性临床研究开始前完成。确证性临床研究设计前需获得QT/QTc间期延长临床研究结果或CQT分析结果,以指导确证性临床研究设计是否需要心电图的密切监测。 (三)暴露-效应关系研究 1. 研究内容 药物给药剂量、体内暴露量、药物效应之间的关系及其影响因素和可能的机制,是创新药临床药理学研究的核心内容,贯穿临床研发始终。暴露-效应关系对于指导创新药后续研发决策(如是否有必要继续研发等)、临床研究方案设计、用法用量方案、目标适应症人群的选择、疗效确证、风险管控措施的制定、药品说明书撰写等具有重要意义。同时,暴露-效应关系还有助于早期的PoM和PoC。 暴露-效应关系是连接给药剂量和药物疗效/安全性指标的重要内容。在整个剂量-暴露-效应的证据链中,PK量化了剂量和暴露量之间的关系以及个体间暴露量差异的因素,而暴露-效应关系则进一步量化了药物暴露量和疗效/安全性指标的关系以及不同亚群体甚至不同个体在疗效/安全性指标上的差异及其影响因素。 基于早期生物标志物或者替代终点的暴露-效应关系分析,可以指导后续临床研究的用法用量的选择和优化等。而基于临床终点的暴露-效应关系分析,可以作为药物有效性的重要证据,也可以用于评价获益风险比,以及推荐拟注册的用法用量等。 建议随着临床研究数据的不断积累,对药物的暴露-效应关系进行持续完善和更新。 2. 研究时机 创新药进入人体临床研究伊始,建议尽早开展剂量-暴露-效应关系研究和分析。可考虑在单次/多次剂量递增等早期研究阶段收集和检测药物有效性和安全性相关指标。药效学指标选取时,应关注所选取指标与临床终点的相关性情况,相关性越强,暴露-效应关系分析结果越可靠,据此选择的用药方案则越有利于后续临床研究尤其是关键临床研究的开展,能更好反映创新药真实的获益和风险情况。暴露-效应关系分析贯穿整个创新药研发过程,是提高临床研究成功率的基础。 五 研究方法 (一)经典研究方法 基于个体密集PK数据的非房室模型和房室模型分析方法在量化小样本平均PK参数领域有重要作用,比如生物利用度和生物等效性研究、食物影响研究、DDI研究、肝/肾功能不全等特殊人群患者研究等,都基于此类研究方法。经典PK研究通常采用描述性统计方法报告研究结果,初步描述药物的PK、PD及安全性特征。 (二)基于模型的研究方法 基于模型的研究方法应用于创新药研发的各个阶段,常用模型包括群体药代动力学模型、PBPK模型、基于模型的荟萃分析、暴露-效应关系分析、疾病进展模型等。 患者和/或健康志愿者的密集和稀疏PK、PD数据,在群体分析方法中都可以被采纳。群体分析方法的优势是可以量化PK、PD的个体间变异和随机变异,并分析变异来源,结合药物暴露-效应关系分析的结果,判断是否需要对某些特殊人群进行相应的剂量调整。 随着创新药研发知识的积累,一些跟人体相关的影响药物PK的共性知识逐渐完善,可以被用于构建PBPK模型。这种分析方法可以用于指导DDI等研究。应用此类模型作为申报注册的支持性证据时,建议提前与监管部门沟通。 (三)其他前沿方法 近年来,一些新技术的理论和方法得到了快速发展,逐步应用于创新药临床药理学(包括定量药理学)研究中的暴露-效应关系分析、用法用量设计和优化等领域,如定量系统药理学(Quantitative Systems Pharmacology, QSP)、机器学习(Machine Learning)、人工智能(Artificial Intelligence, AI)等。创新药开发人员可以在科学合理的条件下,采用这些新技术进行研究探索。采用新技术和新方法时,应有科学的评估或验证。 六 研究设计的总体考虑 在当代创新药研发全过程中,临床药理学各项研究的研究设计、开展时机等都发生了变化,具有一定的灵活性,可基于具体药物的整体临床研究策略和进程进行设计考虑。这些研究目的不同的临床药理学研究项目可以独立开展,也可以设计为回答不同问题的组合研究,或者将具有特定研究目的的临床药理学研究嵌套在其他临床研究中进行。 (一)独立研究设计 前文所述的各项临床药理学研究可以进行独立研究设计,采取分别开展某项研究的策略开展研究。此时,可以避免或减少研究结果解读时的相互干扰问题。独立研究设计的临床药理学研究结果将更真实可靠反映单一因素下创新药的PK、PD特征,比如剂量-暴露关系、食物影响等问题,通常可作为撰写说明书相关内容的稳健证据。 (二)合并研究设计 有些情况下,不同临床药理学研究项目可能可以合并到同一个研究中,即在同一个研究中考察和回答不同临床药理学问题。比如在早期单次/多次剂量递增研究中同时开展初步物质平衡研究或CQT研究,同时探索性考察食物影响或某项代谢酶/转运体的DDI情况等。 此时,应充分关注和详细分析该项合并研究的方案设计的科学合理性及可实施性,并充分探讨该项合并研究的数据结果对于回答不同临床药理学问题(研究目的)的可靠性,应关注不同临床药理学问题之间的相互影响。 (三)嵌套研究设计 某些临床药理学研究可以通过恰当设计嵌套在安全有效性临床研究中,可根据不同的研究目的,考察全部或部分受试者的PK或PK/PD。 为了更好评估药物的治疗窗,鼓励收集临床研究中尽可能多的受试者PK数据,从早期单次和多次给药剂量递增健康志愿者或患者的PK数据到确证性临床研究患者的PK数据。 七 化学药创新药和生物制品创新药的基本考虑 化学药创新药和生物制品创新药的临床药理学研究的必要性和研究设计等考量也有所不同。 相对于化学药物结构已知,大多数的生物制品是复杂的混合物,其覆盖面广,包括疫苗、血液制品、细胞治疗、基因治疗和治疗性蛋白药物等。其中治疗性蛋白药物与化学药物的研究方法较为接近,但因分子结构存在较大差异,二者的临床药理学研究也存在不同之处。 在药物吸收方面,与大多数治疗性蛋白药物通过肠道外途径给药不同,化学药物的结构、理化性质和生化特性能使其通过被动扩散或主动转运进入细胞和/或细胞核而产生药理学作用。多数化学药物通过优化后可以做到口服给药。在研发过程中通常会涉及到食物影响和与抑制胃酸药物的相互作用的研究。 化学药物在体内经过代谢酶代谢时,可能形成活性代谢产物,本身也可能是代谢酶的抑制剂或诱导剂;其体内过程同时受转运体的调节,也有可能抑制或诱导转运体。需根据体外代谢酶和转运体的研究结果来制定DDI以及物质平衡等临床药理学研究计划。 在考虑和设计遗传药理学研究时,化学药物应注意所涉及的代谢酶和转运体是否存在基因多态性,并根据基因多态性可能产生的影响选择不同的研究方法。 对于治疗性蛋白药物,其在体内经催化降解为小的多肽或氨基酸并通过肾脏排出体外,或进一步参与到氨基酸循环。物质平衡研究对确定治疗性蛋白药物的代谢及排泄方式一般意义不大。治疗性蛋白药物的DDI研究的考虑主要有以下方面:(1)本身是炎性因子或能够调控炎性因子,从而改变代谢酶的表达,(2)通过影响生理过程(比如胃排空),从而改变其他药物的吸收,(3)影响其他药物作用的靶点或靶点介导的药物消除而产生DDI,(4)通过影响FcRn而产生DDI,(5)为免疫抑制剂,通过影响免疫原性而产生DDI。针对治疗性蛋白药物消除和代谢的特定研究(比如微粒体、全细胞或组织匀浆研究)以及体外代谢物鉴定的必要性和可行性,应视具体情况而定。 在特殊人群研究中,比如肝/肾功能不全人群中,需要综合考虑目标适应症人群的肝/肾功能水平,肝脏和肾脏在药物清除过程中的贡献程度。比如药物主要经肝脏代谢(如治疗性蛋白药物在肝脏降解)时,应考虑并设计肝功能不全人群研究。当药物主要经肾脏排出(如治疗性蛋白药物分子量小于69KDa)时,应考虑并设计肾功能不全人群PK研究。 FcRn存在一定的基因多态性。当治疗性蛋白药物包含Fc段且需要时,可视情况考虑和评估FcRn基因多态性对药物PK和有效性的影响。 免疫原性的考察应贯穿治疗性蛋白药物整个临床研究始终。免疫原性问题可能影响生物制品创新药体内PK特征,甚至影响创新药临床安全和有效性结果。 八 监管考虑 (一)申报资料 在创新药申报上市申报资料的临床药理学概述性内容中,应提供所有临床药理学研究项目的列表。应简要介绍已完成的非临床相关研究结果,以帮助阐述药物作用机制(Mechanism of Action,MoA)、解释人体PK、PD(包括疗效和安全性)数据等,比如渗透性、血脑屏障、蛋白结合、肝脏代谢和DDI等。应简要综述各项人体临床药理学研究结果,比如健康志愿者和/或患者的PK、PD和PK/PD关系的研究,以及内在和外在因素对PK和PK/PD关系的影响等。应简要阐述研究设计和数据分析的关键信息,比如研究剂量的选择、研究人群、考察的内在或外在因素的选择、PD终点的选择以及采用经典方法或者基于模型等方法收集和分析数据用于评估PK、PD等。 创新药上市申报资料中应按照法规要求提交每一项独立临床药理学研究的详细内容,包括研究方案(需提供历次方案的修订版本、修订依据、伦理批件等)、统计分析计划、研究总结报告等。适当情况下,分析体内研究结果时,应结合体外研究数据,进行体内-体外相关性分析。应关注PK和PD结果的异常数据,充分分析个体间和个体内变异及其带来的临床影响。 应提交完整的药代动力学研究报告、群体药代动力学研究报告、暴露-效应关系分析报告等。除常规申报资料要求外,应在研究报告中提供全面的PK参数。群体药代动力学研究报告和暴露-效应关系分析报告等应按照国内外相关法规和指导原则要求提供全面的原始数据和程序代码等,并说明用于数据分析的软件及相应版本等。除了描述性数据结果分析之外,建议尽可能同时使用图表等形式直观呈现研究结果和基于相应结果做出的相关决策。 根据临床终点指标或其他终点指标进行的暴露-效应关系分析来支持药物疗效或者关键临床研究剂量和申报上市剂量时,应在暴露-效应关系分析报告中详细阐述所选择指标的科学合理性,以及与临床终点的相关性。 如果某项临床药理学研究开展了多个独立研究,比如某创新药开展了多个独立的PK研究,此时应根据数据汇总和分析数据集情况,整理相关内容,并完整递交到监管机构。将多项独立研究结果进行汇总分析和解读,并形成临床药理学研究总结报告,此时应充分分析不同研究的关键设计(比如不同的研究剂量、采血点、给药周期、给药频率等)的异同点,以及对于汇总数据分析的可行性和结果解读的影响等。 (二)说明书 创新药申报上市的同时,应根据说明书制定的相关法规要求,结合非临床和临床等研究结果草拟说明书内容,并提交监管部门。 如果应开展但未开展某项临床药理学研究,需在申报资料中充分阐述科学合理性和原因,同时阐述说明书中相关项目的撰写内容及其科学考虑等。 (三)其他情形 对于罕见病用药和附条件批准上市等特殊情况,可结合药物特性、目标适应症患者和临床需求等情况具体问题具体讨论和综合评估。 九 缩略语及含义
十 参考文献 1. ICH M4E: The Common Technical Document on Efficacy.2016. 2. ICH E4: Dose-Response Information to Support Drug Registration.1994. 3. ICH E14: The Clinical Evaluation of QT/QTc Interval Prolongation and Proarrhythmic Potential for Non-Antiarrhythmic Drugs.2005. 4. ICH E14: The Clinical Evaluation of QT/QTc Interval Prolongation and Proarrhythmic Potential for Non-Antiarrhythmic Drugs. Questions and Answers (R3).2015. 5. 国家药品监管管理局. 《模型引导的药物研发技术指导原则》. 2020年12月. 6. 国家药品监管管理局. 《群体药代动力学研究技术指导原则》. 2020年12月. 7. 国家药品监管管理局. 《儿科用药临床药理学研究技术指导原则》.2020年12月. 8. 国家药品监管管理局. 《儿科人群药代动力学研究技术指导原则》.2014年7月. 9. 国家药品监管管理局. 《药物相互作用研究技术指导原则(试行)》. 2021年1月. 10. 国家药品监管管理局. 《治疗性蛋白药物临床药代动力学研究技术指导原则》. 2021年2月. 11. 国家药品监管管理局. 《化学药创新药临床单次和多次给药剂量递增药代动力学研究技术指导原则》.2021年12月. 12. 国家药品监管管理局. 《肾功能不全患者药代动力学研究技术指导原则》. 2021年12月. 13. 国家药品监管管理局. 《新药研发过程中食物影响研究技术指导原则》. 2021年12月. 14. 国家药品监管管理局. 《创新药人体生物利用度和生物等效性研究技术指导原则》.2021年12月. 免责声明 本公众号发布的文章均为促进制药界同行的交流与学习;不用于任何商业用途。 我们尊重原创作品。选取的文章已明确注明来源和作者,版权归原作者所有,如涉及侵权或其他问题,请联系我们进行删除。 内容由凡默谷小编查阅文献选取,排版与编辑为原创。如转载,请尊重劳动成果,注明来源于凡默谷公众号。 文章内容为作者观点,不代表本公众号立场。 文章搜索 本公众号开通往期文章任意搜功能啦 在公众号菜单栏中输入“搜索”,即可搜索往期微信内容返回搜狐,查看更多 |
【本文地址】
今日新闻 |
点击排行 |
|
推荐新闻 |
图片新闻 |
|
专题文章 |