抗体偶联药物稳定性和制剂配方 |
您所在的位置:网站首页 › 组氨酸缓冲液的优势和劣势 › 抗体偶联药物稳定性和制剂配方 |
抗体偶联药物稳定性和制剂配方
|
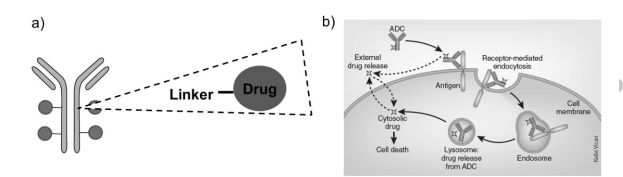
图1. ADC作用的基本机制 1. ADC的特异性元件 对于已上市的抗体药物或者是ADC,稳定的制剂配方是首先要考虑开发的。蛋白质很容易发生物理或者化学降解。偶联药物带来了更多的复杂性和不稳定因素。因此涉及ADC的每一个元件的稳定性都得一一考虑。 1.1 抗体部分 尽管1997年才批准了第一个商业化抗体药物Rituxan®,但是抗体药物的表征已经做的非常细致,相应的表征技术也相当广泛和成熟。由于只有完整抗体有着较长的半衰期,目前,只有完整抗体被用作ADC元件。当然其他形式的抗体也有可能被应用到ADC上来,但是目前还未见应用到临床上。其它可应用于ADC的抗体形式包括抗体片段,单链抗体片段,甚至是纳米抗体。对于实体瘤治疗来说,抗体片段或者纳米抗体渗透性更高。另外,有一项双特异性ADC同时靶向HER2和CD63正在临床试验。紧跟抗体药物的发展,多数ADC使用的抗体为人源化抗体或者全人源抗体序列。更重要的是ADCs选用的抗体和抗原结合后特别易于内化,因为大多数设计理念是药物通过内化释放到胞内起到杀伤作用。Gébleux等人的一项临床前研究显示非内化的ADC抗体也具有潜在的抗肿瘤活性。 亲本抗体的免疫原性对ADC来说同样是致命的,因为药物偶联后ADC保留了亲本抗体的免疫原性。对于偶联来说,抗体的多种功能基团都可以使用。这些基团包括半管氨酸残基(硫醇),赖氨酸(氨基),醇类(羟基),醛基,叠氮化物。游离巯基可能降低单链抗体的稳定性,但链间半胱氨酸的减少对抗体的稳定性没有负面影响,是最早使用的偶联方法之一。半胱氨酸偶联的抗体药物在荷载药物和偶联点上是不均匀的,每个抗体分子上偶联的药物分子从0-8都有。为了提高均一性,对IgG活性没影响的硫醇基团一级结构上通常被半胱氨酸取代,因此称之为硫代抗体。 通过添加连接剂对表面赖氨酸残基进行修饰,可以中和这些残基上的正电荷。尽管理论上通过赖氨酸可以偶联很多药物分子,现报道显示通过赖氨酸偶联每个抗体可以偶联多达8个药物分子。在1种通过赖氨酸偶联的ADC上发现有50%的赖氨酸是部分被修饰,尤其是在易接近性和高灵活性区域的赖氨酸。因此,与半胱氨酸连接的ADC相比,赖氨酸连接的ADC具有更大的异质性,但与单克隆抗体的差异较小。为了更好地控制赖氨酸偶联ADC的药物负荷和特异性,研究只针对溶剂型和反应性最强的赖氨酸偶联反应。进一步的技术,如酶偶联,利用非天然氨基酸偶联。例如p-乙酰基苯丙氨酸,位点特异性聚糖偶联,正在开发研究。 1.2 连接元件 对于ADC来说,连接子在化学过程中,血浆循环以及产品储存过程中的稳定性非常关键。此外有效荷载必须对内源性反应是惰性的以保证药物在靶细胞内释放。连接剂的选择同样影响着抗体与抗原,Fc受体的结合,同样影响着ADC的热稳定性。 不同的连接剂已经有文献很好的综述过,偶联剂可以简单的分为化学化学易剪切偶联剂,酶易消化偶联剂,不可剪切偶联剂。化学易剪切偶联剂可以通过PH依赖机制完成剪切,这就意味着它很容易在胞内溶酶体酸性环境中完成剪切。(如图2)Mylotarg®and Besponsa®就是通过化学易剪切的腙键偶联的,在PH7.2环境中,该偶联剂相对稳定,半衰期为60h,而在PH5.0环境中,该偶联剂显得很不稳定,半衰期只有3h。由于体内除溶酶体之外的酸性环境还存在其他酸性环境,因此,非特异性药物释放时有发生。Mylotarg®撤市的一个原因就是其在血浆中的不稳定性。酶易消化偶联剂稳定性相对有所增加,主要通过溶酶体酶消化完成剪切。这一偶联方式成功的案例有Adcetris®就是通过缬氨酸瓜氨酸肽键偶联的。通过非剪切偶联剂偶联的ADCs首先需要内化,然后抗体在胞内降解释放出药物。对于非剪切偶联剂偶连来说,非特异性释放药物减少了,也就降低了药物的系统毒性。Kadcyla®就成功地运用了非剪切偶联剂SMCC。药物和连接剂一起起着强大的细胞毒性作用。偶联剂的最佳选择也依赖于靶抗原,靶抗原应该处在细胞表面易于被ADC结合。相关文献也报道了最新的若疏水性偶联剂用于更加高效的荷载疏水性分子。本文对偶联剂自身的稳定性没有过多的介绍,感兴趣的读者可以自行查阅相关的文献。 偶联剂的选择决定了抗体药物的比率(DAR)。药物分布偶联稳定性对于ADC的质量至关重要。此外,残留或游离药物的分析对ADC毒性和安全性评估也很重要。例如,常用的硫代丁二酰亚胺连接剂在生理pH和温度下,如果附近有其他硫醇,则会发生逆反应和交换反应,其疏水性可能会增加蛋白质的聚集.
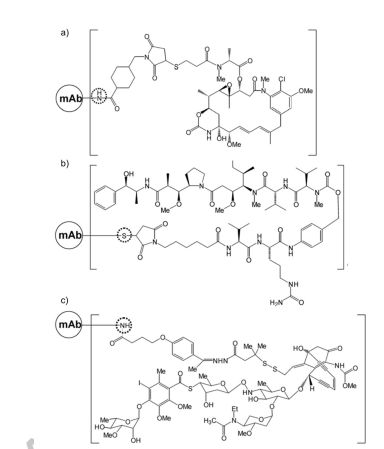
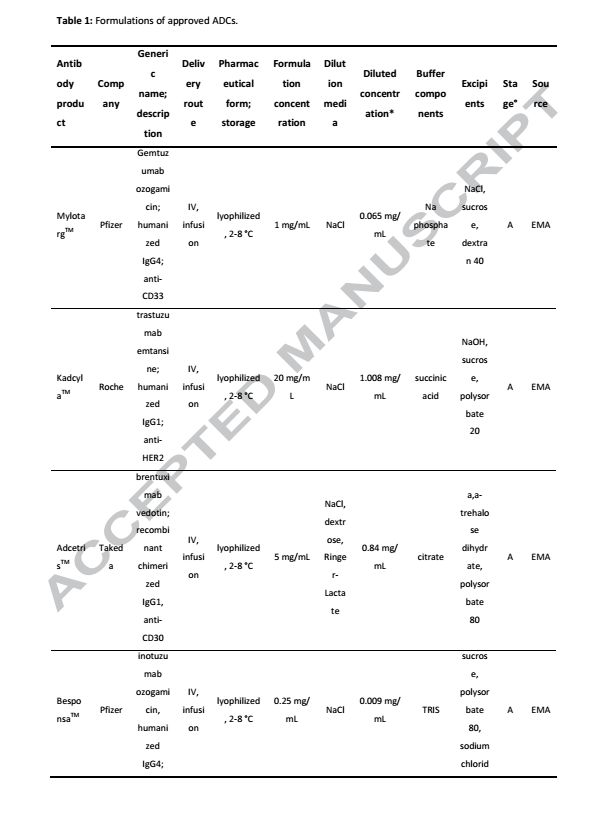
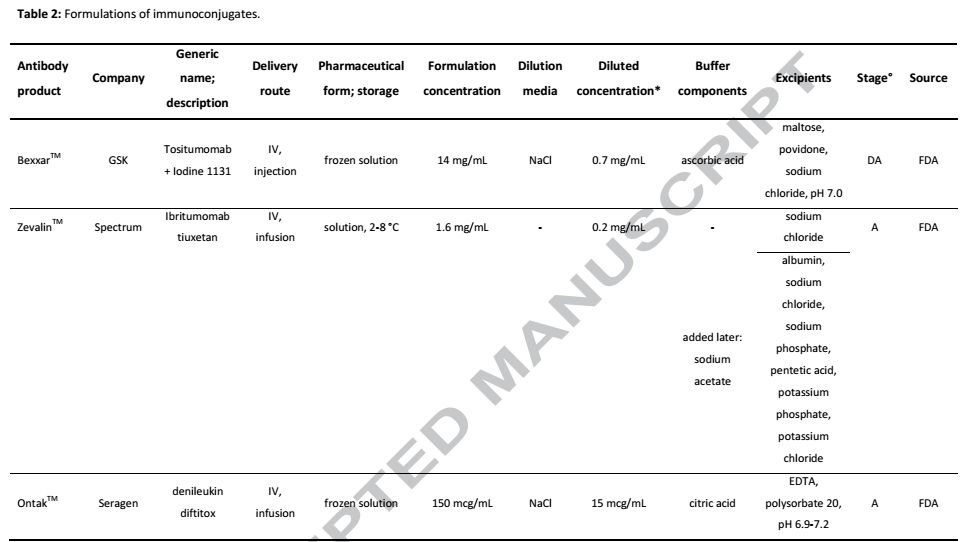
图2.市场上偶联剂和荷载药物化学结构图 1.3 荷载元件 被选为ADC有效载荷的药物具有高度的细胞毒性,并以有效的形式从ADC释放。有效载荷以及它最终的代谢形式决定了ADC分子的毒性。第一代ADC,释放的有效荷载有别于游离的药物,这就降低了ADC1的有效性,如今的有效荷载主要有两类,靶向DNA分子的有效荷载和靶向tubulin的有效荷载。应用于临床试验靶向DNA的有效荷载有calicheamicin,pyrrolobenzodiazepine dimers, doucarmaycin, 和indolinobenzodiazepinedimers,靶向tubulin的有效荷载主要是抗有丝分裂的药物例如auristatins和maytansinoids。由于到达靶分子的ADC的比例很低,这就要求有足够多的荷载药物释放才能达到杀伤肿瘤的效果(106分子/细胞)。 有效荷载对传统化疗来说毒性太大而且对肿瘤细胞没什么选择性。例如DNA烷基化药物duocarmycins和pyrrolobenzodiazepines被重新研究评估有可能成为更高效的药物,尤其是分子量为700到750Da,分别作为质子供体和受体的emtansine和vedotin更加备受关注。如McCombs等人所述,如果药物的溶解度、共轭适配性和稳定性足够高,就可以作为ADC的有效载荷。例如,亲脂性有利于通过细胞膜,而在水缓冲液中偶联也是必要的。疏水性将影响ADC的稳定性,因此,亲水性偶联剂会减少疏水作用力对ADC造成的影响。另外,药物必须具有可以偶联的官能团,而且不会对药物发挥功能造成影响。如上所述maytansinoids可以作为ADC的有效荷载。添加一个官能团已实现方便连接的挑战催生了对那个位置可以修饰和那种功能团可以方便结合的研究。最后确定了一个末端包含硫醇集团的部位容易形成酯健侧链。除了末端硫醇基团,前体药也被考虑,例如氯甲基,氨基甲酰,肽和碳酸盐衍生物。 1.4.ADC注意事项 ADC的主要特征是药物抗体比DAR,DAR决定着ADC的有效性和稳定性。如果DAR太低,细胞毒性就会太小,起不到杀伤肿瘤细胞的作用。若是DAR太高,其免疫原型会大大提高,因此会引起免疫系统的识别从而被清除,随着DAR增高,ADC聚集的可能性就会增加,这都会对ADC产生不利。DAR值在2-4之间属于最佳选择。对于一个特定的ADC来书DAR的最佳比需要稳定性试验,体内有效性和药代动力学共同来决定。例如Sun等人描述的ADC的效能随着DAR比例增加而增加,当DAR超过6,ADC被清除地速率急剧上升。Hamblett等人发现DAR与血浆清除之间存在明显的相关性。偶联会影响到抗体的结构进而影响抗体的其它生物学功能。构象不稳定和胶体不稳定可诱导蛋白质聚集,从而导致效率降低和免疫原性增大。 Ross和Wolfe最近综述了ADC的物理和化学稳定性。通过半胱氨酸偶联荷载药物,蛋白质构想没有明显的变化,但是构象解链的能域降低,更多的疏水区域形成。因此,蛋白熔解温度降低,换句话来说,蛋白热稳定性变差,更容易形成聚集结构。DAR越高的分子更容易聚集,而混合物中DAR的种类越多,ADC整体的稳定性变得越差。最新文献报道,疏水性药物和DAR值高达8直接导致了抗体的不稳定性。通过半胱氨酸连接的ADC热稳定随着DAR的升高而降低,随着离子强度的升高而升高。如果一个抗体的偶联部位在Fab,这种偶联方式对熔解温度的影响在CH2结构域比CH3结构域更加敏感。 关于赖氨酸连接ADC稳定性的文献较少。通过偶联,赖氨酸上的正电荷被剔除,也因此产生了多种变体形式,当ADC在40℃储存7天后,ADC的熔解温度降低,抗体-连接子中间体的比例下降,更高分子量的物质含量上升。Wakankar等人也表明,共轭对CH2结构域的影响最大,这可以解释为CH2结构域具有较高的灵活性,共轭的可能性增加。非常有趣的是单独先加入连接剂形成的聚集体要比同时加入连接剂和药物要多。未形成ADC的偶联剂可以跟侧链亲核氨基酸反应形成聚体。荷载药物的疏水性甚至是电荷的分布不均一都将增加赖氨酸连接的ADC聚集的风险。与赫赛汀相比,Kadcyla®的胶体稳定性有所下降。与硫醇偶联物相比,赖氨酸偶联物对Fab结构域稳定性的影响较小。Mohamed等人最近比较了PH,温度,搅动,反复冻融对trastuzumab和赖氨酸偶联ADC(T-DM1)的影响。与父本抗体相比,了PH,温度,搅动都加快了T-DM1的降解。尽管DARs略有不同,Kadcyla®和一种生物相类似药比较显示出相似的热稳定性和聚集行为。 ADCs的化学稳定性取决于亲本抗体。连接子负载的不稳定性和抗体上的结合位点也影响着ADC的稳定。例如,硫醚琥珀酰亚胺键可以在温和的水环境中氧化,然后亚砜被消除。对于偶连过程,抗体,偶联剂,药物的物理,化学特性都需要考虑。例如,抗体在缓冲的水溶液中更稳定,而有效载荷通常具有有限的水溶性。偶联过程中需要用到的有机溶剂将影响抗体的稳定性。另外,抗体需要出在与偶联过程兼容的PH环境里。副反应也将影响抗体的稳定性。例如琥珀酰亚胺酯不仅与赖氨酸反应,还与半胱氨酸和酪氨酸反应。另外,用于伯氨为组氨酸的缓冲液不能用于赖氨酸偶联的连接反应。对于ADC来说,最后对于未连接的药物以及参与的有机溶剂的去除是不可或缺的。 2.ADCs制剂配方的考虑 由于蛋白质的结构多样性,这就需要为每一种产品开发一种独特和具体的配方,而这一个过程往往是最耗时的。对于ADCs来说,最佳的制剂配方不仅仅要考虑抗体的稳定性,还需要考虑连接剂,药物的稳定性。表1和表2分别列出了截止2018年9月已上市的ADCs和免疫偶联剂的配方。ADC现有市场药物是以下制剂配方考虑的基础。 表1.上市ADC药物制剂配方
表2.免疫共轭物配方
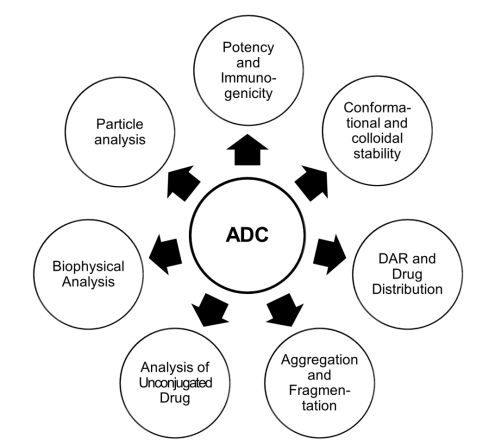
2.1产品的关键因素 市场上ADCs的药物浓度都低于20mg/ml,这与市场上传统的治疗性抗体高于50mg/ml的浓度还是有相当大的差距。ADCs的高特异性,高有效性对肿瘤细胞的杀伤以及通过静脉注射避免了对ADCs高浓度储存的需求。低浓度降低了聚集的风险,尤其是当抗体偶联疏水性药物的时候。这对于ADC来说是一个重要的优势,因为净表面电荷的损失和负载的疏水性,导致ADC的溶解度可能比亲本单抗会降低。 市场上ADC的给药方式是输注,在输液袋里,抗体的浓度相对较低,由于药物可以吸附在塑料袋上,这就增加了药物损失的风险,改善的方法就是提高药物的疏水性。药物稀释也会降低药物的稳定性,诱导聚集甚至颗粒物形成。在0.9%生理盐水中,净电荷的消除,增加了蛋白质分子之间的相互吸引,这就降低了高DAR比ADC的可溶性,增加了聚集的风险。0.9%NaCl和5%右旋葡萄糖输液溶液均为微酸性溶液,视稀释因子、pH值和ADC制剂缓冲液容量而定,随着溶液PH的改变,ADC表面电荷也随着改变,尽管ADC制剂通常也是弱酸性的。 低离子强度的制剂配方将有效降低ADC的聚集化和片段化,尤其对于通过赖氨酸偶联的ADC,表面电荷不均匀分布。在传统单克隆抗体中,电荷分布不一致的分子更容易受到分子间吸引。DAR分布以及多种DAR混合物强烈影响着ADC稳定性和制剂组成。此外,选择合适的pH值不仅受到ADC的IEP的影响,还受到连接剂的影响,如巯基琥珀酰亚胺连接剂的水解受到pH值增加的刺激。连接剂在冻干粉制剂中的水解显著减少。对于生物制药来说,液体制剂是首选,2013年前,日本和美国市场上2/3的生物制品药为液体制剂。与冻干粉相比,选择液体制剂的优势是成本更低,使用更加方便。但是,产品必须面对稳定性的问题。时至今日,所有上市ADC药物都是冻干粉制剂,且缓冲液中含有糖和表面活性剂等成分。仅有一些免疫共轭物以液体制剂或者冷冻形式储存。因此,公开的文献都在关注ADC冻干粉制剂的稳定性。很明显,冻干可以大大降低化学降解,特别是自由药物形成的风险。例如,Adcetris®和Kadcyla®中的硫代琥珀酰亚胺键可以通过琥珀酰亚胺水解或反-michael反应降解。在Besponsa®和Mylotarg®中使用的腙连接非常不稳定,在血浆中发生缓慢水解。有趣的是,与传统单抗疗法相比,ADC可以是光敏的,Mylotarg®和Besponsa®采用琥珀色玻璃瓶。 2.2 ADC制剂组成 ADC制剂的辅料相同于亲本单抗的辅料配方,缓冲液的选择取决于靶pH值、ADC的不稳定性以及对液体或冻干形式更感兴趣。对于高浓度治疗性单抗,有人讨论选用无缓冲液的制剂,但是对于脆弱的ADC来说,无缓冲液制剂是不行的。由于ADC最终是和生理盐水或者5%葡萄糖共同输注的,所以制剂阶段等渗是不要考虑的。然而,强化剂,如氯化钠,甘露醇或蔗糖可以添加到ADC的配方。糖,特别是蔗糖和海藻糖,在ADC冷冻和冻干过程中起着保护剂的作用。在冷冻过程中需要添加5%(W/V)的糖,而在干粉状态下,糖与蛋白质量比至少要达到1:1是必须的。随着下一代位点特异性ADCs的发展,治疗剂量相应的增加,DAR有可能降低,那时,糖有可能不再是ADC制剂必须的。表面活性剂,尤其是聚山梨醇酯20或者80通常添加在抗体制剂和ADC制剂中。聚山梨醇酯的降解,引入杂质混合物对于药物制剂来说是一大挑战。但是添加它的好处是表面活性剂可以增及蛋白质的稳定性,减少蛋白分子的聚集,同时增加蛋白表面可湿性,便于冻干粉末的再溶解。与单抗药物相比,ADC需要更高的表面活性剂浓度,来减少因ADC的不均一性以及偶联药物疏水性带来的ADC的聚集。为了减少负载的疏水影响,一般建议使用带有表面活性剂的低离子强度缓冲液。在较高的离子强度下,ADCs表现出更明显的团聚体形成和较低的Tm,且与盐的类型无关。 3. 针对ADCs的分析 市场准入的ADCs依赖于已经证实了的稳定性,以及长时间保持生物活性,以及在可能遇到的压力条件下仍然保持稳定和相应的生物活性。传统抗体的分析方法也适用于对ADC分析(如图3)。当然并不是所有方法都照搬传统抗体的分析方法,一些方法需要做出改进,比如当荷载药物有相应的UV吸收或者样品异质性很高时,分析方法都需要做出调整。尤其是当ADC是通过赖氨酸或半胱氨酸经过化学反应偶联时,所的药物是高度不均一的。由于这可能会影响药物的安全性和有效性,目标产品配置文件通常包含DAR和同质性规范的程度,以控制产品质量并确保不同批次内的一致性。更多的分析方法还比较欠缺有待进一步开发。以下是对ADC分析所需要特别考虑关键点的简短陈述。 DAR可以用紫外/可见分光光度计测量,但只有当有效载荷和抗体之间的吸收最大值不同时可以使用。其他测定DAR、载药量分布和游离药物的方法有疏水相互作用色谱法和LC-ESI-MS法。肽图分析可以用来识别特定的蛋白质修饰,以及可能形成的共轭和降解。传统检测释放药物的方法为RP-HPLC,毛细管电泳和ELISA也可以使用。一些表征技术需要根据ADC做出调整,例如在SEC中,由于疏水性负载,可能必须通过添加有机溶剂来减少与色谱柱的更强的相互作用。此外,用于动态扫描荧光法测定Tm的外源性荧光染料SYPRO®Orange可与疏水有效载荷相互作用,限制了其在ADC中的应用。
图3. ADC必要的分析方法 4. 结论 对于ADCs来说,从传统抗体的概念出发,多种方法可以预测其稳定性,也可以找出适合于ADC的最佳制剂配方。但是,ADCs毕竟还是跟抗体药物有差别,一个用于偶联的偶联剂小分子,一个有效荷载药物小分子都是ADCs必须要考虑的因素。截至目前被EMA和FDA批准的ADC药物只有四个,相关可用于参考的知识数据也相当有限。这就要求制剂配方科学家仔细开发每一个ADC的制剂配方并实时监控整个过程中ADC的稳定性。总之,ADC开发过程的每个环节都非常关键,抗体的选择,结合位点的选择,偶联剂的选择,荷载药物的选择,在生理状态下抗体,偶联剂,荷载药物的稳定性,成品ADC的均一性,DAR值,游离态药物浓度等等,制剂配方都需要通过体内外大量的实验去证实。最终才能开发出高效的药物递送系统。 参考来源: Duerr C, Friess W.Antibody-drug conjugates-stability and formulation.Eur J Pharm Biopharm. 2019 Jun;139:168-176. doi: 10.1016/j.ejpb.2019.03.021. Epub 2019 Mar 30.返回搜狐,查看更多 |
【本文地址】
今日新闻 |
点击排行 |
|
推荐新闻 |
图片新闻 |
|
专题文章 |