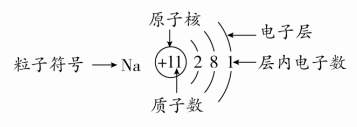
原子结构示意图全部 |
您所在的位置:网站首页 › 原子结构示意图第四周期 › 原子结构示意图全部 |
原子结构示意图全部
 1. 核外电子排布的表示方法
1. 核外电子排布的表示方法
(1)原子结构示意图
①小圆圈和圆圈内的符号及数字表示原子核及核内质子数。 ②弧线表示电子层。 ③弧线内数字表示该层中的电子数。 (2)离子结构示意图 ①当主族中的金属元素原子失去最外层所有电子变为离子时,电子层数减少一层,形成与少一个电子层的稀有气体元素原子相同的电子层结构。
②非金属元素的原子得电子形成简单离子时,形成与电子层数相同的稀有气体元素原子相同的电子层结构。
1.下列表示物质结构的化学用语或模型正确的是 A.HF的电子式: C.S2-离子的结构示意图: 【答案】B 【解析】 A、HF为共价化合物,电子式为 B、O为8号元素,核外有8个电子,其中第一层有2个电子,第二层有6个电子,核外电子排布为 C、S为16号元素,核内有16个质子,S2-离子的结构示意图为 答案选B。 2、 明确几个量的关系(1)质量数(A)=质子数(Z)+中子数(N),质量数可近似地代替原子的相对原子质量。 (2)原子的核外电子总数=质子数=核电荷数=原子序数。 (3)阳离子Mn+的核外电子数=质子数-n; 阴离子Nn-的核外电子数=质子数+n。 2.某物质H2RO3分子中共有x个电子,R原子的质量数为A,则R原子核内含有_______个质子,________个中子。 【答案】x-26 A-x+26 【分析】 根据分子中各种元素的原子核外电子数的和等于总电子数,原子核外电子数等于其原子核内质子数,原子的质量数等于其质子数与中子数的和计算。 【详解】 H原子核外只有1个电子,O原子核外有8个电子,则根据H2RO3分子中共有x个电子,可得该物质分子中R原子核外电子数为(x-1)×2-8×3=x-26; 由于原子的质量数等于其质子数与中子数的和,R原子的核外电子数等于x-26,则其原子核内质子数也等于x-26,其质量数为A,故该原子核内中子数为A-( x-26)= A-x+26。 【点睛】 本题考查了分子的构成及原子构成微粒关系的知识。在任何分子中原子核外电子数等于原子核内质子数,质量数等于原子核内质子数与中子数的和。掌握微粒的构成及相互关系是解答关键。 3、 明确符号ZA±cXmn±中各个字母的含义
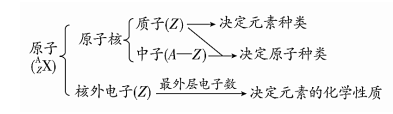
3.下表符号中“2”的含义正确的一组是( ) 选项 21H 42He O2 Mg2+ A 质量数 中子数 质子数 电荷数 B 质量数 质子数 原子数 电荷数 C 质子数 中子数 原子数 电子数 D 质量数 质子数 分子数 电荷数 【答案】B 【解析】21H、42He、O2、Mg2+的“2”的含义分别是质量数、质子数、一个分子中含有的原子个数、离子所带的电荷数,故B正确; 4、同位素、同素异形体的判断和理解(1)同种元素可以有多种不同的核素,即可存在不同的原子,所以元素的种类数远小于原子的种类数。 (2)判断某组微粒是同位素还是同素异形体,关键是要确定微粒的类别。只有原子才可能是同位素,单质才可能是同素异形体。 4.下列说法正确的是 () A.红磷、白磷属于同位素B.H2、D2属于同素异形体 C.4019K、4020Ca互为同位素D.H、D、T互为同位素 【答案】D 【解析】A.分子结构不同的单质属于同素异形体, 因而红磷和白磷是同素异形体,A项错误; B. H2、D2构成元素相同,属于同种单质,B项错误; C. 4019K、4020Ca含有不同元素,因而不是同位素,C项错误; D.H、D、T均是氢元素的不同核素,互为同位素,D项正确。 5、 构成原子的粒子数目与元素种类、原子种类的关系
5.有①质子数②中子数③核外电子数④价电子数 ⑤最外层电子数⑥电子层数。请用上述序号回答: (1)原子种类由 决定,元素种类由 决定。 (2)原子的质量数由 决定,元素在周期表中的位置由 决定。 【答案】①②;①;(2)①②;④⑥或⑤⑥ 【解析】具有相同核电荷数的(即核内质子数)的一类原子的总称,所以决定元素种类的是是质子数。而决定原子种类的则是质子数和中子数。中子数和质子数之和是质量数,元素在周期表中的物质由周期和族决定,周期序数等于核外电子层数,族序数等于最外层电子数。元素原子的最外层电子数就是价电子数。 6、主族元素原子结构与其在周期表中的位置关系(1)核外电子层数=周期数。 (2)主族序数=最外层电子数=最高正价(O,F除外)=8-|最低负价|。 6.原子结构示意图为 【答案】第四周期ⅥA族;+6;H2XO4;弱 【解析】略 7、电子层与周期表关系误区元素原子的K、L、M层电子数为偶数时,K、L、M不一定是最外层,即使是最外层也不一定是主族元素,如零族。 7.根据中学化学教材所附元素周期表判断,下列叙述不正确的是() A.K层电子数为奇数的所有元素所在族的序数与该元素原子的K层电子数相等 B.L层电子数为奇数的所有元素所在族的序数与该元素原子的L层电子数相等 C.L层电子数为偶数的所有主族元素所在族的序数与该元素原子L层电子数相等 D.M层电子数为奇数的所有主族元素所在族的序数与该元素原子M层电子数相等 【答案】C 【解析】 【详解】 A.K层电子数为奇数的只有氢原子,氢原子所在族的序数与该元素原子的K层电子数相等,故A正确; B.L层电子数为奇数的所有元素为锂、硼、氮,元素所在族的序数与该元素原子的K层电子数相等,故B正确; C.L层电子数为偶数的所有主族元素主要有铍、碳、氧、氖以及第三周期的所有原子,比如钠原子所在族的序数为第ⅠA族,该元素原子的L层电子数为8,不相等,故C错误; D.M层电子数为奇数的所有主族元素主要有钠、铝、磷、氯,元素所在族的序数与该元素原子的M层电子数相等,故D正确。 故选C。 8、根据稀有气体元素的原子序数确定 主族元素在周期表中的位置的方法(1)记住稀有气体元素的原子序数(2He、10Ne、18Ar、36Kr、54Xe、86Rn、118Uuo),便可确定主族元素的位置。 (2)原子序数-最邻近的稀有气体元素的原子序数=ΔZ ①若ΔZ>0,则位于稀有气体元素下一周期,族序数为ΔZ; ②若ΔZ HI> HBr>HCl,③错误;④卤族元素由上到下相对原子质量增加,由于卤素单质都是分子晶体,相对分子质量越大,沸点越高,④正确;⑤卤族元素由上到下非金属性减弱,因此阴离子的还原性增强,⑤正确;综上所述,②④⑤正确;正确选项C。 点睛:同主族元素的单质和化合物性质具有相似性和递变性;从上到下,单质的氧化性减弱,单质的沸点升高;气态氢化物的沸点氟化氢反常,存在有氢键所致;氢卤酸(HX) 的酸性逐渐增强,阴离子的还原性逐渐增强。 12、卤素单质的特殊性(1)溴是常温常压下唯一的液态的非金属单质。 (2)卤素单质都有毒,溴有很强的腐蚀性,液溴易挥发,保存时要加一些水进行“水封”,碘可升华,遇淀粉溶液变蓝(检验I2)。 (3)Cl2、Br2、I2易溶于有机溶剂苯、CCl4、汽油等。 (4)F2是唯一从水中置换出O2的非金属单质。 (5)卤素单质与变价金属(如Fe)反应 2Fe+3X2===2FeX3(X===F、Cl、Br) Fe+I2===FeI2 12.关于卤素(F、Cl、Br、I)的性质的叙述,错误的是( ) A.卤素单质的密度逐渐增大 B.将氯水加到KI淀粉溶液中,溶液变蓝 C.除了I2外,其它卤素单质都能将Fe氧化到+3价 D.F2能从NaCl溶液中置换出Cl2 【答案】D 【解析】A、卤素单质从上而下密度逐渐增大,选项A正确;B、氯元素的非金属性强于碘元素的,因此氯气能把碘化钾氧化生成单质碘,碘遇淀粉显蓝色,所以将氯水加到KI-淀粉溶液中,溶液变蓝,选项B正确;C、碘的氧化性较弱,故 除了I2外,其它卤素单质都能将Fe氧化到+3价,选项C正确;D、 F2的非金属性很强,直接与水反应,而不能从NaCl溶液中置换出Cl2,选项D错误。答案选D。 13、 判断元素金属性强弱的方法(1)根据元素的单质与水(或酸)反应置换出氢的难易程度来判断,若其单质与水(或酸)反应置换出氢越容易,则元素的金属性就越强;反之,金属性就越弱。 (2)根据元素的最高价氧化物对应的水化物——氢氧化物的碱性强弱来判断,若其最高价氧化物对应的水化物——氢氧化物的碱性越强,则元素的金属性就越强;反之,金属性就越弱。 (3)根据金属活动性顺序表来判断,排在金属活动性顺序表前面的金属,金属性越强。 (4)根据金属单质之间的置换反应判断,金属性强的元素的单质能把金属性弱的元素的单质从其盐溶液中置换出来。 13.下列实验依据可判断某元素的金属性强弱的是( ) A.导电性的强弱 B.跟非金属反应生成化合物的价态高低 C.1mol该金属跟酸反应放出氢气的多少 D.最高价氧化物对应水化物碱性的强弱 【答案】D 【详解】 A.金属的导电性属于物理性质,导电性的强弱与金属性强弱无关,A错误; B.金属单质在反应中失去电子的能力越强则金属性越强,与失去电子的多少无关,即生成的价态高低无关,B错误; C.金属元素的单质与水或酸反应置换出氢气越容易,则失电子能力越强,金属性越强,与生成氢气多少无关,C错误; D.金属元素的最高价氧化物对应的水化物的碱性越强,则失电子能力越强,金属性越强,D正确; 14、 判断元素非金属性强弱的方法(1)根据非金属元素单质与H2化合的难易程度判断,若单质与H2越容易化合,则元素的非金属性就越强;反之,非金属性就越弱。 (2)根据非金属元素单质与H2化合形成气态氢化物的稳定性判断,若生成的气态氢化物越稳定,则元素的非金属性就越强;反之,非金属性就越弱。 (3)根据非金属元素最高价氧化物对应水化物的酸性强弱判断,若最高价氧化物对应水化物的酸性越强,则元素的非金属性就越强;反之,非金属性就越弱。 (4)根据非金属元素单质之间的置换反应判断,非金属性强的元素的单质能把非金属性弱的元素的单质从其盐溶液中置换出来。 (5)根据非金属元素单质的氧化性判断,一般单质的氧化性越强,非金属性越强。 (6)根据元素在周期表中的位置判断,同主族元素从上到下金属性逐渐增强,非金属性逐渐减弱。 14.可以验证硫元素的非金属性比氯元素弱的事实是( ) ①H2S水溶液是弱酸,HCl水溶液是强酸 ②向氢硫酸溶液中滴入氯水有单质硫生成 ③硫、氯气分别与铜和铁反应,其产物是FeS、Cu2S、FeCl3、CuCl2 ④高氯酸(HClO4)的酸性比硫酸强 A.②③④ B.②④ C.①②④ D.①②③④ 【答案】A 【解析】 试题分析:H2S和HCl不属于最高价氧化物对应水化物,不能通过比较酸性来比较非金属性。答案选A。 点评:非金属性的比较规律: 1、由元素原子的氧化性判断:一般情况下,氧化性越强,对应非金属性越强。 2、由单质和酸或者和水的反应程度判断:反应越剧烈,非金属性越强。 3、由对应氢化物的稳定性判断:氢化物越稳定,非金属性越强。 4、由和氢气化合的难易程度判断:化合越容易,非金属性越强。 5、由最高价氧化物对应水化物的酸性来判断:酸性越强,非金属越强。(除氟元素之外) 6、由对应阴离子的还原性判断:还原性越强,对应非金属性越弱。 7、由置换反应判断:强置弱。〔若依据置换反应来说明元素的非金属性强弱,则非金属单质应做氧化剂,非金属单质做还原剂的置换反应不能作为比较非金属性强弱的依据〕 值得注意的是:氟元素没有正价态,故没有氟的含氧酸,所以最高价氧化物对应水合物的酸性最强的是高氯酸,而不是非金属性高于氯的氟元素!故规律5只适用于氟元素之外的非金属元素。 8、按元素周期律,同周期元素由左到右,随核电荷数的增加,非金属性增强;同主族元素由上到下,随核电荷数的增加,非金属性减弱。 9. 非金属单质与具有可变价金属的反应。能生成高价金属化合物的,其非金属性强 - THE END - 来源:网络,版权归相关权利人所有。我们尊重原创,如存在文章/图片/音视频使用不当的情况,或涉及原创内容,侵害了您的权益,请随时与我们联系,联系(QQ):504580314。
|
【本文地址】
今日新闻 |
点击排行 |
|
推荐新闻 |
图片新闻 |
|
专题文章 |
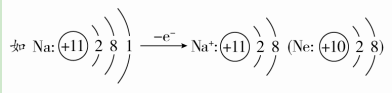
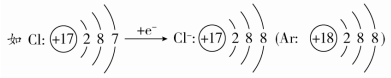
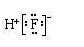 B.O的核外电子排布:
B.O的核外电子排布: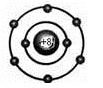
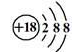 D.CH4分子的球棍模型:
D.CH4分子的球棍模型:
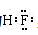 ,故A错误;
,故A错误;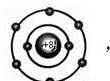 故B正确;
故B正确;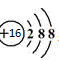 ,故C错误;D、
,故C错误;D、 为甲烷的比例模型,CH4分子的球棍模型为
为甲烷的比例模型,CH4分子的球棍模型为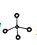 ,故D错误;
,故D错误;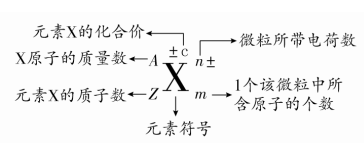
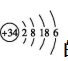 的原子,在周期表中的位置是 ,根据其在周期表中的位置推测,该元素的最高正价是 ,其最高价氧化物对应水化物的化学式为 (该元素用X代替),其酸性比硫酸 。
的原子,在周期表中的位置是 ,根据其在周期表中的位置推测,该元素的最高正价是 ,其最高价氧化物对应水化物的化学式为 (该元素用X代替),其酸性比硫酸 。