国家药监局发布《药物警戒年度报告撰写指南(试行)》! |
您所在的位置:网站首页 › 企业年度报告填写指南模板 › 国家药监局发布《药物警戒年度报告撰写指南(试行)》! |
国家药监局发布《药物警戒年度报告撰写指南(试行)》!
|
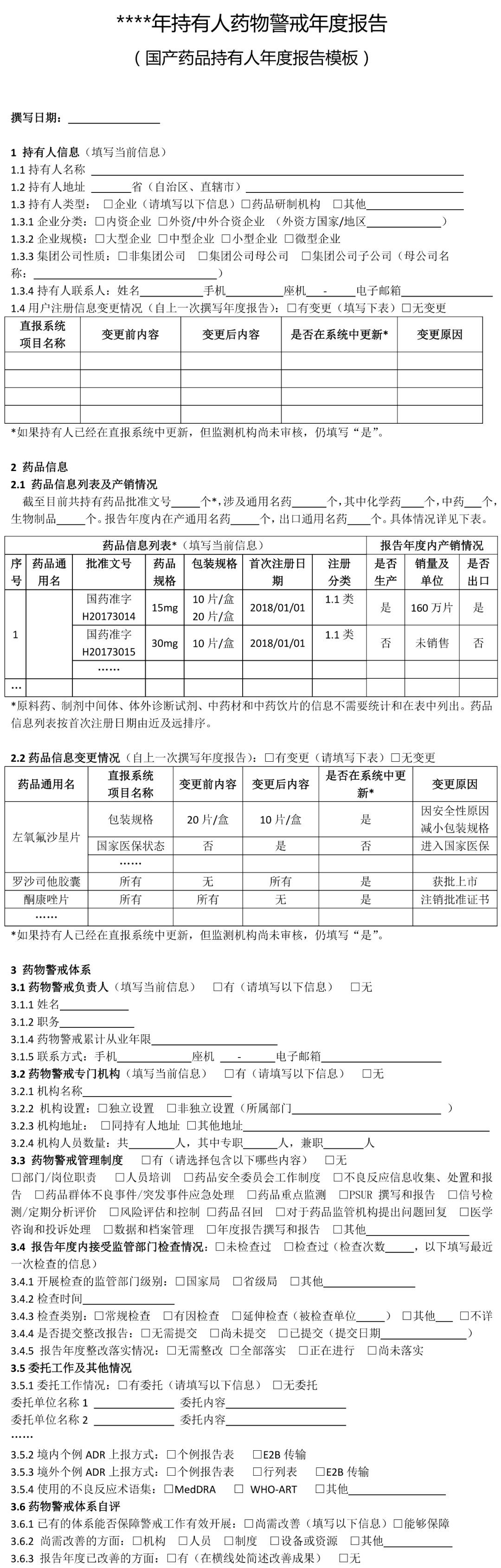
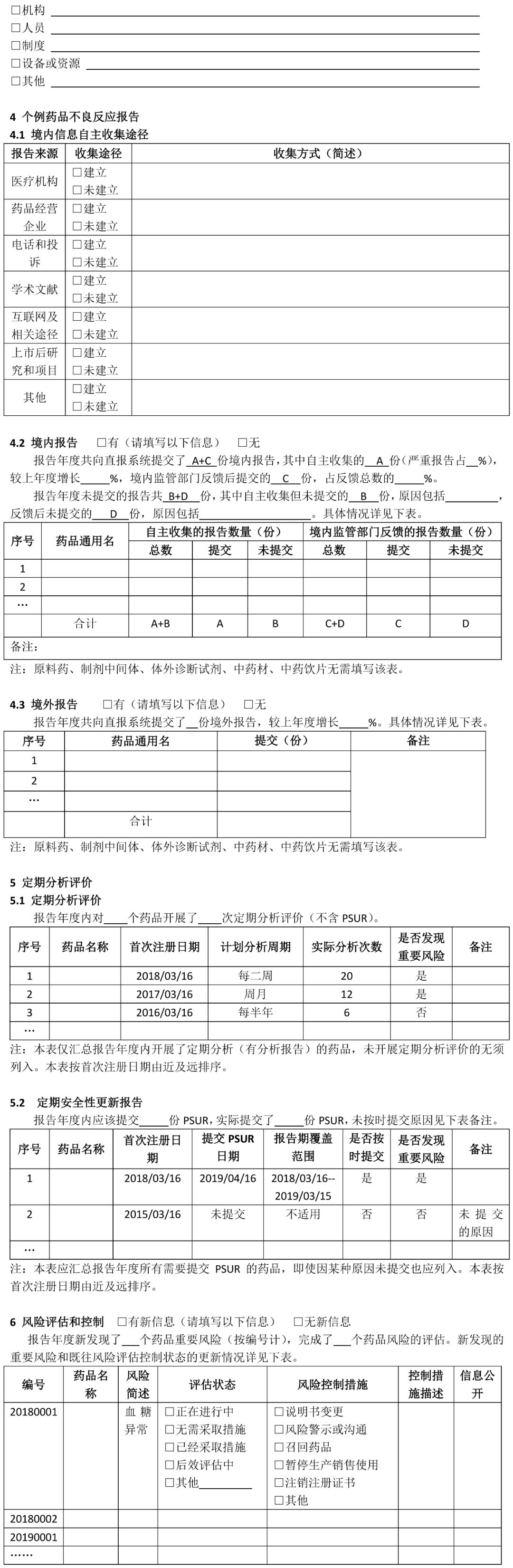
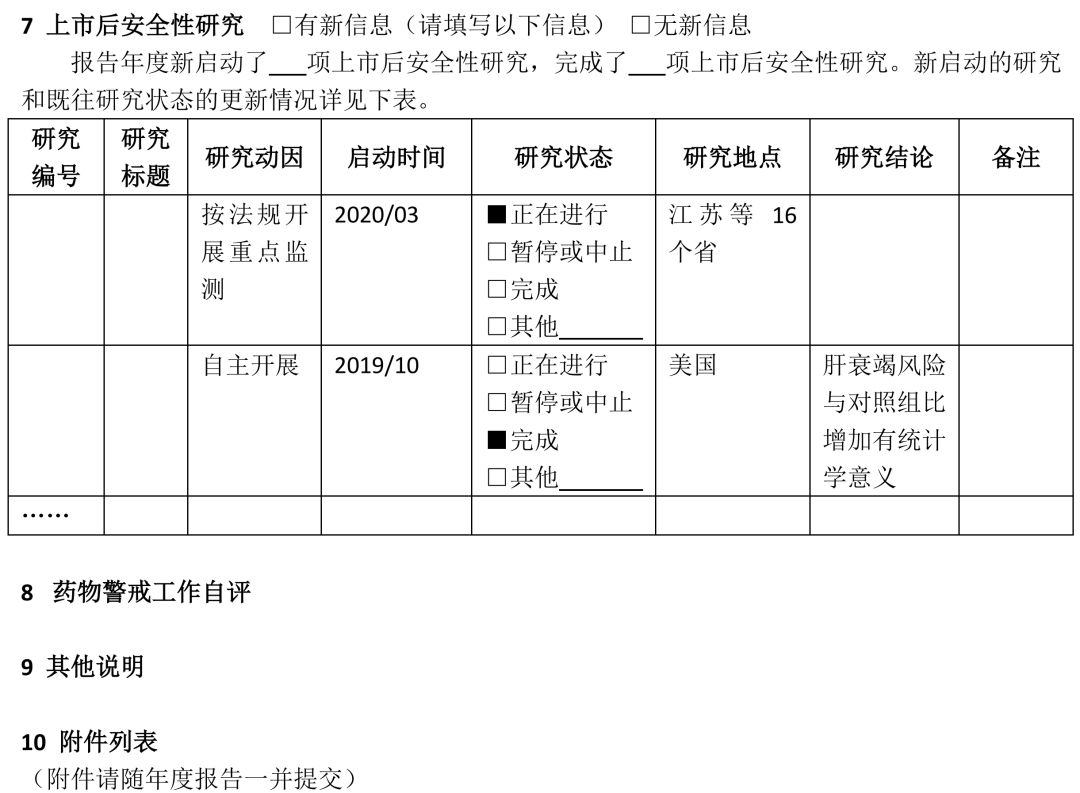
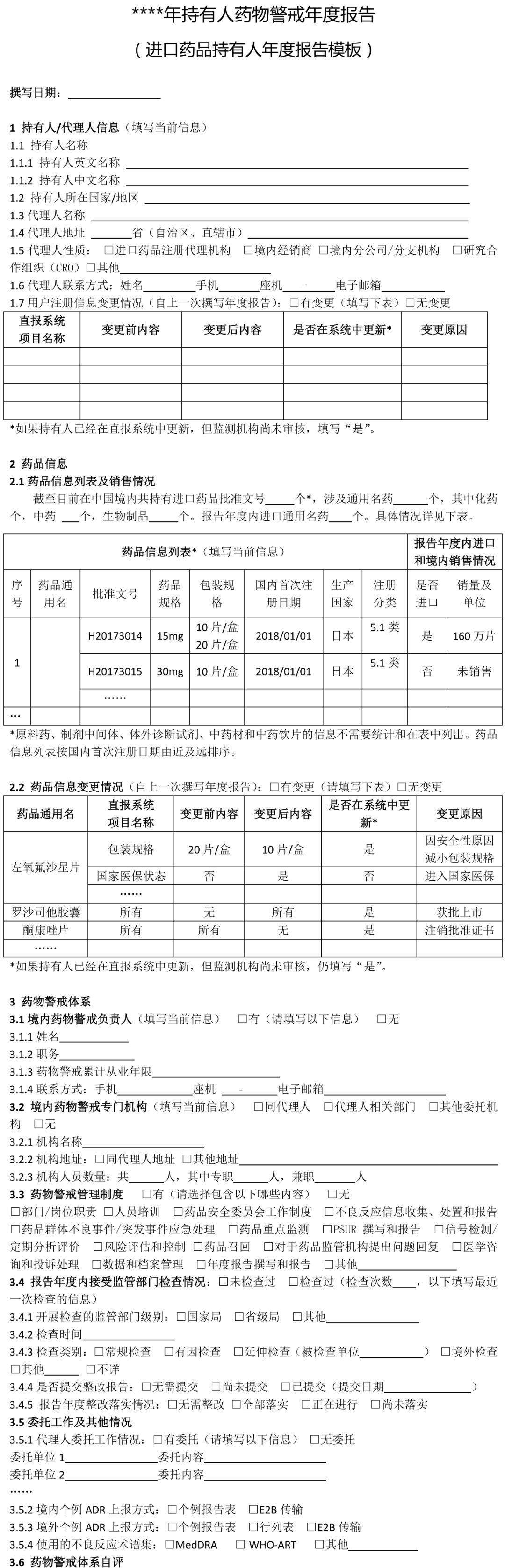
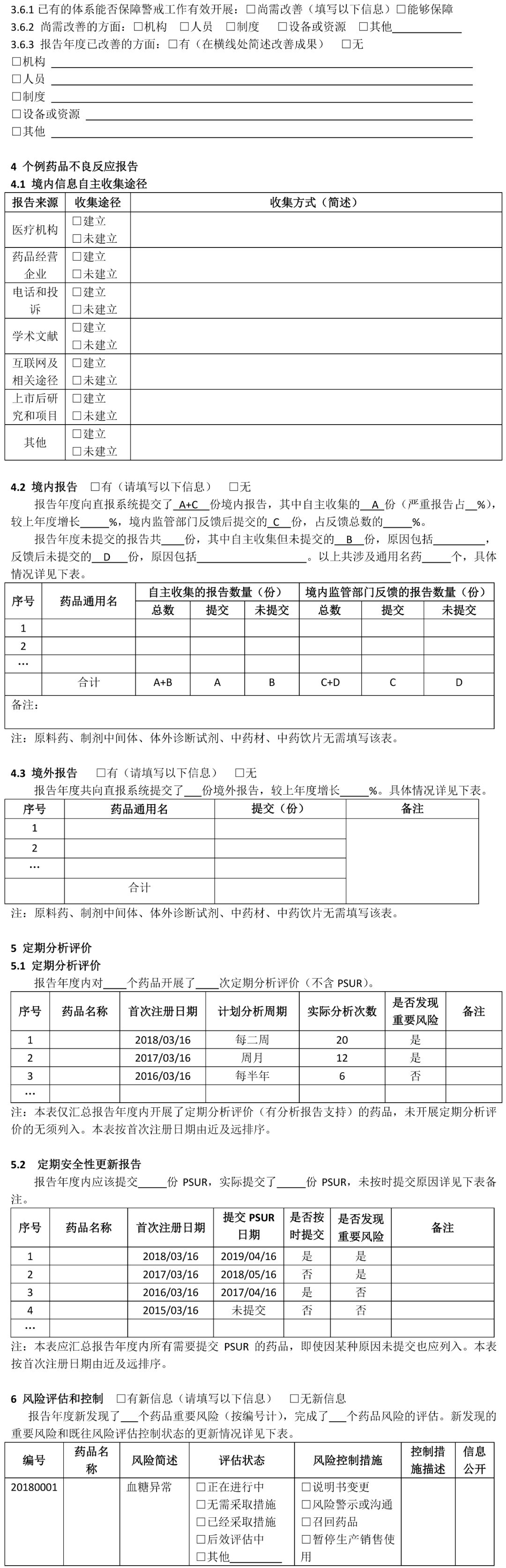
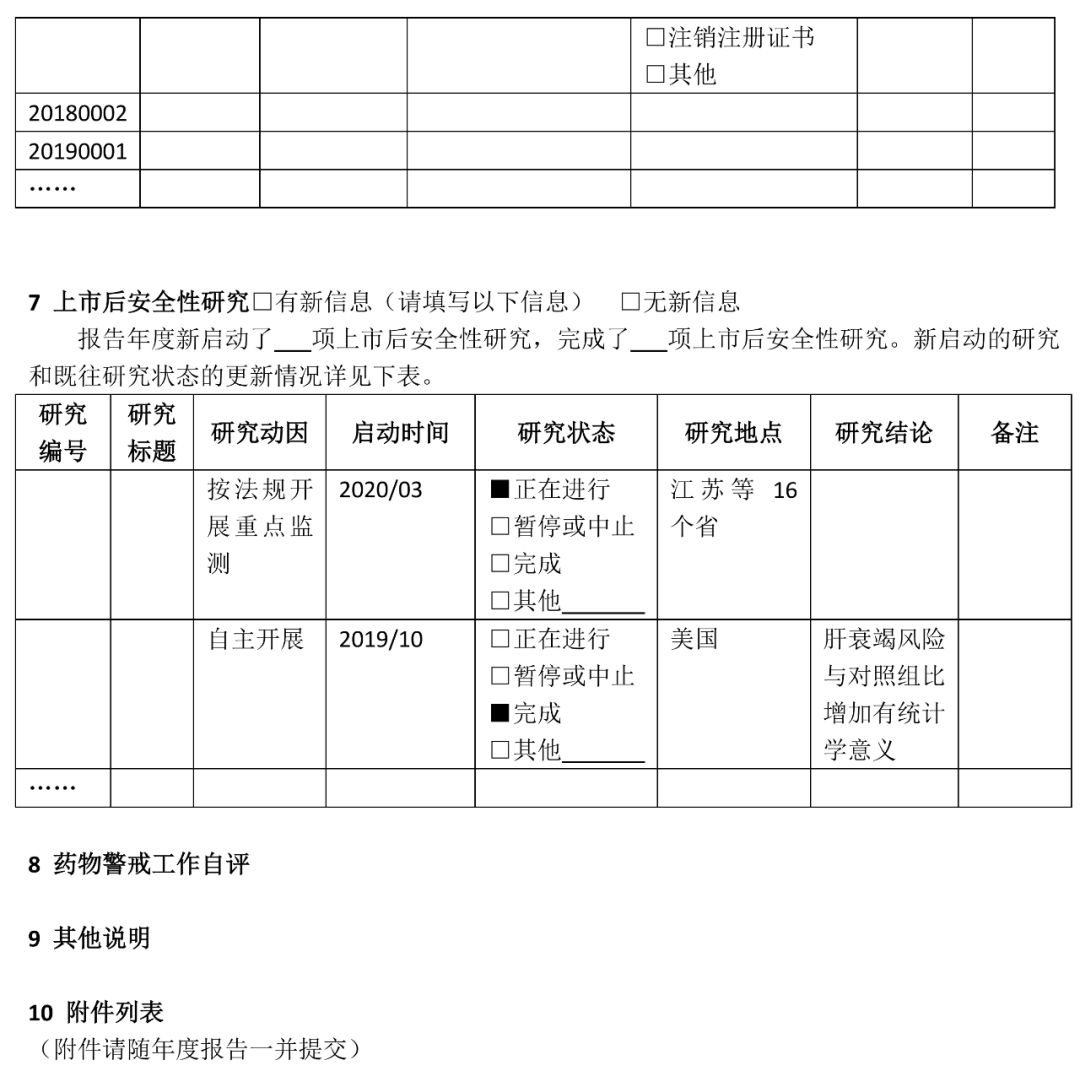
(七)疫苗的药物警戒年度报告撰写指南另行制定。 二、撰写要求 (一)国产药品持有人年度报告撰写要求 1 持有人信息 药品上市许可持有人是指取得药品注册证书的企业或者药品研制机构等。本项持有人信息填写撰写年度报告时“当前”信息。 1.1持有人名称:按照监管部门已批准注册或已批准变更的名称准确填写。 1.2持有人地址:按当前真实地址填写。 1.3持有人类型:按当前情况勾选“企业”“药品研制机构”或“其他”。如果勾选“企业”,需填写1.3.1-1.3.3项目。 1.3.1企业分类:内资企业是指由我国境内投资者投资举办的企业;外资企业是指由境外投资者独自投资经营的企业;中外合资企业是指中国合营者与外国合营者共同投资经营的企业。港、澳、台资企业参照外资/中外合资企业填写。 1.3.2 企业规模:按照《关于印发中小企业划型标准规定的通知》(工信部联企业〔2011〕300号)中“工业行业”的划分标准,从业人员1000人以下或营业收入4亿元以下的为中小微型企业。其中,从业人员300人及以上,且营业收入2000万元及以上的为中型企业;从业人员20人及以上,且营业收入300万元及以上的为小型企业;从业人员20人以下或营业收入300万元以下的为微型企业。从业人员1000人以上且营业收入4亿元以上按大型企业算。其他行业类型企业参照此标准。 1.3.3集团公司性质:持有人不属于任何集团公司的,选择“非集团公司”;持有人本身为集团公司母公司的,选择“集团公司母公司”;持有人为某集团公司子公司的,选择“集团公司子公司”,并填写母公司名称。 1.3.4 持有人联系方式:填写负责与监管部门联络的人员联系方式。 1.4 用户注册信息变更情况:指自上一次撰写年度报告至本次撰写年度报告期间,直报系统中“用户注册”信息实际发生变更的情况,无论持有人是否已经在直报系统中进行了更新。变更项目名称按直报系统中的项目名称填写。首次撰写年度报告应填写自直报系统注册时至本次撰写年度报告期间的所有变更。“是否在系统中更新”指持有人自上次撰写年度报告后,是否已经在直报系统中提交了更新信息。 2 药品信息 2.1 药品信息列表及产销情况 药品信息列表填写截至撰写年度报告时持有人所持有效药品批准证明文件的药品情况。药品信息列表应按药品首次注册日期由近及远的顺序排列,即最近时间批准的药品排在前面;如果同一通用名称下有不同规格产品且注册日期不同,则该药品排序以最近批准注册的日期为准。 药品通用名:准确、完整填写药品批准证明文件中的名称,不得使用简称。 批准文号:同一药品通用名有不同批准文号,填写在不同行。 包装规格:同一批准文号有多个包装规格均需填写,同一行可填写多个药品包装规格。 首次注册日期:指首次获得该规格通用名药批准证明文件的日期。 注册分类:按药品批准证明文件上的注册分类填写,没有明确注册分类填写“未分类”。 是否生产:指报告年度内持有人在境内是否生产(包括委托生产)过该药品。 销量及单位:销量指报告年度内持有人或其经销商在境内销售的药品数量。没有销售填“未销售”。销量单位按制剂单位填写,如片、粒、支、袋等。销量如以万位计,保留至少三位有效数字,如1234万片、12.3万片。 是否出口:指境内生产的药品是否出口到境外(含港、澳、台地区),包括委托其他单位出口本持有人药品。以报告年度内完成出口通关手续为标准。 2.2药品信息变更情况 是指自上一次撰写年度报告至本次撰写年度报告期间,直报系统中持有人维护的药品信息(“产品信息维护”模块)实际发生变更的情况,无论持有人是否在直报系统中进行了更新。一个通用名药有多个项目变更,填写多行。首次撰写年度报告应该填写自持有人在直报系统中注册至本次撰写年度报告期间,直报系统中持有人维护的药品信息发生变更的情况。 药品通用名:该名称如果发生变更,填写变更后的名称。 直报系统项目名称:按直报系统中“产品信息维护”的项目名称填写。 变更前(后)内容:如果药品是报告年度内新批准注册的,变更前内容应填写“无”,变更后内容应填写“所有”;如果是报告年度内注销药品注册证书的药品,变更前的内容应填写“所有”,变更后的内容应填写“无”。 是否在系统中更新:指持有人自上次撰写年度报告后,是否已经在直报系统中提交了更新信息。 变更原因:简述变更原因以及其他需要说明的问题。 3 药物警戒体系 3.1药物警戒负责人:填写当前信息。“药物警戒负责人”指持有人指定的具有一定领导职务,具备多年从事药物警戒工作经验,熟悉相关法律法规及政策,能够负责药物警戒体系的建立、运行和维护,确保药物警戒工作持续合规的人员,且该人员长期居住在中国境内。“职务”指在本持有人单位所任职务,如有多种职务,仅填写与药物警戒相关的职务。“药物警戒累计从业年限”指在任何地点从事药物警戒工作的累积年限。 3.2药物警戒专门机构:填写当前信息。“药物警戒专门机构”指持有人在境内设立的专门从事药物警戒工作的机构或部门。“机构设置”中独立设置一般是指该机构直接由公司负责人负责,非独立设置指机构设在质量部门、销售部门、医学部门等部门下,由这些部门的负责人兼职负责药物警戒工作。 3.3 药物警戒管理制度:填写报告年度信息。指持有人在报告年度是否建立了与药物警戒工作相关的管理制度。已有相关管理制度,不仅包括制定了制度文件,还包括对制度文件进行了落实,即制度已经实施。 3.4报告年度内接受监管部门检查情况:检查指报告年度内监管部门按照《药品不良反应报告和监测管理办法》《药品不良反应报告和监测检查指南》进行的检查。如有多次检查,填写报告年度内最近一次检查的情况。如果对持有人的检查延伸至委托机构,“检查类别”同时勾选“延伸检查”,并填写被检查单位名称。如有问题清单、整改报告,应随年度报告一并提交。 3.5委托工作及其他情况:“委托工作情况”指持有人委托其他单位开展药物警戒相关工作的情况,请填写委托单位名称全称,简要填写委托内容,如“不良反应收集”“不良反应报告提交”“不良反应文献检索”等。境内外个例ADR上报方式中,“个例报告表”指通过在线填写《上市许可持有人药品不良反应/事件报告表》方式上报;“E2B传输”指按照ICH E2B格式传输上报;“行列表”是指按照《药品不良反应报告和监测管理办法》对境外报告的要求上报。 3.6药物警戒体系自评:对现有的药物警戒体系能否保障警戒工作有效开展进行自评,并简述报告年度内药物警戒体系已经改善的方面。 4 个例药品不良反应报告 4.1境内信息自主收集途径:指持有人建立的自主收集境内药品不良反应信息的途径,不包括监管部门反馈信息包含的来源途径,例如持有人虽然收到监管部门反馈的医疗机构和经营企业的报告,但自主收集不包括这两个渠道,不能算建立了该途径。 4.2-4.3境内(外)报告 本部分汇总持有人所持国产药品的不良反应报告情况。境内报告是指国产药品在中国境内发生的不良反应报告;境外报告是指国产药品在境外(包括港、澳、台地区)发生的不良反应报告。以行列表形式提交的境外报告也应汇总。 境内(外)报告表应按通用名填写,同一通用名药填写一行。报告年度无论是否生产或销售,只要表中某项报告不为零,均应填写该表,所有项目均为零的药品无需填写该表。报告数量按病例计,跟踪报告不另计数。某项没有报告不填写。 自主收集的报告数量:指持有人从各种途径自主收集的个例报告数量的总和,不包括监管部门反馈的报告数量。 境内监管部门反馈的报告数量:指持有人通过直报系统接收的监管部门反馈的所有不良反应报告数量。填写年度反馈的总报告数量,以及持有人对反馈报告进行处理后又提交至直报系统中的报告数量。报告年度反馈给持有人的报告无论何时向直报系统提交,皆应算在本报告年度的报告数量中。 备注:持有人需要说明的其他问题。 5 定期分析评价 66号公告规定,持有人应定期对药品不良反应监测数据、临床研究、文献等资料进行评价,并按规定要求做好定期安全性更新报告(PSUR)的撰写及上报工作。 5.1 定期分析评价 定期分析评价是持有人发现药品风险的重要方式,持有人应根据药品上市时间、风险特征或监管部门要求,制定年度定期分析评价计划,并按计划开展工作。应综合所有安全性数据进行分析评价,包括全球数据。对于报告年度内已经开展了定期分析评价的药品(有分析报告支持),填写定期分析评价表。定期分析评价表按首次注册日期由近及远排序。PSUR相关情况不在此表中汇总。 药品名称:一般填写药品通用名称或活性成份名称,根据实际开展情况填写。 首次注册日期:如果该药品有多个首次注册日期,填写最早批准的日期。 计划分析周期:指持有人根据药品上市时间长短、药品风险特征或监管部门要求制定的分析评价周期。 实际分析次数:报告年度实际开展分析评价的次数。 是否发现重要风险:重要风险包括持有人自主发现或境内外监管部门告之的。重要风险可参考ICH E2C(R2)对重要已识别风险(Important identified risk)和重要的潜在风险(Important potential risk)的解释。发现的重要风险在第6项中进行描述。 备注:需要说明的其他内容,如未按计划开展分析评价的原因等。 5.2 定期安全性更新报告 本表汇总报告年度内应提交定期安全性报告(PSUR)的所有药品,应提交但未提交的也应列入。 药品名称:一般填写药品通用名称或活性成份名称,根据实际开展情况填写。 首次注册日期:如果该药品有多个首次注册日期,填写最早批准的日期。 提交PSUR的日期:指报告年度内向直报系统提交PSUR的日期。提交频率小于一年的,按实际情况填写多个提交日期,并在备注中说明原因。PSUR被退回后再次提交,仅填写第一次提交的日期。 是否按时提交:指PSUR是否按《药品不良反应报告和监测管理办法》要求的时限提交。按国际诞生日提交公司统一PSUR的,应在备注中说明,未延期提交,填写“是”。 是否发现重要风险:重要风险包括持有人自主发现或境内外监管部门告之的,重要风险可参考ICH E2C(R2)对重要已识别风险(Important identified risk)和重要的潜在风险(Important potential risk)的解释。发现的重要风险在第6项中进行描述。 备注:需要说明的其他内容,如未按时提交PSUR的原因。 6 风险评估和控制 填写报告年度新发现的重要风险(参见第5部分)以及既往重要风险的评估状态和控制情况的更新信息。未发现新风险或无更新信息,仅勾选“无新信息”,其他内容不填写。 编号:按四位年份(发现风险年份)+四位顺序号填写,如20180001。一个药品有多个风险,填写多个编号,一个编号占一行。某个药品的某个风险,其编号应始终保持不变。 药品名称:填写与重要风险相关的药品名称。 风险简述:简述重要风险的内容,可填写不良反应/事件名称。 评估状态:填写报告年度结束时该风险的评估状态。其中,“正在进行中”指正在开展分析评估、正在累积监测数据、正在开展安全性研究、正在制定风险控制措施等;“无需采取措施”指已经完成评估,但评估结果认为无需采取或更新风险控制措施;“已经采取措施”指已经完成评估,并已经采取或更新了风险控制措施;“后效评估中”指正在对风险控制措施的执行效果进行评估,以确定是否需要更新风险管理措施;“其他”指评估状态的其他情况,请简要叙述。 风险控制措施和控制措施描述:评估状态选择“已经采取措施”时,填写这两项。指针对重要风险持有人在中国已经采取的风险控制措施,勾选相应选项,并进行简单描述,有附件请注明。“说明书变更”指持有人因重要风险变更药品说明书的情况,且为已经批准或备案的变更;描述变更内容,如果内容过长,以附件形式提交变更说明表,包括变更的项目、变更前后内容对比、变更的详细原因;如果尚未在直报系统中提交更新的说明书,应在年度报告中以附件形式提交更新的说明书。“风险警示或沟通”指持有人通过适当的形式将风险信息有效传递给医务人员和患者,以达到风险告知和指导临床合理用药的目的;描述风险警示和沟通的方式,风险沟通内容应作为附件提交。“召回药品”指持有人主动或按监管部门要求采取的药品召回措施;描述召回原因、召回范围、召回批号和数量等。“暂停生产销售使用”指持有人主动或按监管部门要求暂停药品生产、销售或使用的情况;描述原因、暂停时间和范围等。“注销注册证书”指持有人主动注销或被监管部门注销药品注册证书的情况,描述注销原因、时间等。“其他”指除上述措施外持有人采取的其他措施,包括实施以药品限制性使用、受控使用为目的风险控制计划等;描述风险控制措施的主要内容,风险控制计划应作为附件提交。信息公开情况:指向社会公开风险控制措施的情况,描述公开的时间、方式和平台。未公开不填写。 7 上市后安全性研究 年度报告中应汇总的上市后安全性研究包括持有人发起或赞助的,在全球任何地点开展的,以药品安全性为主要目的和终点的研究,如非临床研究、临床研究、流行病学研究、主动监测、对临床试验的荟萃分析等,但对文献不良反应的综述除外。 上市后安全性研究列表应填写报告年度启动的研究情况,并更新既往研究的状态及相关信息。未启动新研究或既往研究无更新信息,仅勾选“无新信息”,其他内容不填写。 研究编号:公司为研究分配的编号,无编号的可以填写顺序号。 研究标题:填写研究标题的中文全称。研究标题应包括主要研究药品的名称,或在备注中说明研究的药品。 研究动因:简述促使企业开展研究的原因,如按法规要求开展重点监测、注册批件要求、监管部门要求、主动开展、上市后承诺等。 启动时间:“启动”指报告年度已经制定了研究方案并且开始实施(如开始入组病例)。启动时间具体到月份。 研究状态:选择截至报告年度末研究处于的状态;因任何原因暂停或中止(研究未完成但不再继续)研究,在备注中简要说明原因;“完成”指报告年度研究已经结束并完成了最终的研究报告。 研究地点:在境内开展的研究填写研究涉及的省份,涉及省份较多可填写省份数量;境外开展的研究填写开展的国家或地区。 研究结论:研究状态选择“完成”的,概括重要的安全性研究结论,未完成不填写。 备注:研究状态选择“暂停或中止”的应在备注中说明原因,并填写需要说明的其他问题。 8 药物警戒工作自评 持有人对报告年度境内开展的药物警戒工作进行自评,简要叙述报告年度在不良反应收集、报告、评价、控制等方面取得的主要进展和存在的主要问题,以及下一年度有何改进计划。 9 其他说明 持有人对年度报告中填写的内容需要说明的其他问题,没有填写“无”。 10 附件列表 与年度报告一起提交的附件列表。 (二)进口药品持有人年度报告撰写要求 1 持有人/代理人信息 持有人/代理人信息填写撰写年度报告时“当前”信息。 1.1 持有人名称:按照监管部门已批准注册或已批准变更的名称准确填写。 1.2 持有人所在国家/地区:填写持有人所在国家或地区,地区指香港、澳门、台湾。 1.3代理人名称:根据66号公告,持有人应指定在我国境内设立的代表机构或者企业法人作为代理人(以下均简称代理人),具体承担进口药品的不良反应监测、评价、风险控制等工作。代理人名称应按照书面证明材料准确填写。 1.4 代理人地址:按当前真实地址填写。 1.5 代理人性质:选择代理人性质,如果没有合适的选择项,选择“其他”,并简要描述代表人性质或代理人业务范围。 1.6 代理人联系方式:填写负责与监管部门联络的人员联系方式。 1.7 用户注册信息变更情况:指上一次撰写年度报告至本次撰写年度报告期间,直报系统中“用户注册”信息实际发生变更的情况,无论持有人是否在直报系统中进行了更新。变更项目名称按直报系统中的项目名称填写。首次撰写年度报告应填写自直报系统注册时至本次撰写年度报告期间的所有变更。“是否在系统中更新”指持有人自上次撰写年度报告后,是否已经在直报系统中提交了更新信息。 2 药品信息 2.1 药品信息列表及销售情况 药品信息列表填写截至撰写年度报告时持有人所持有效药品批准证明文件的药品情况。药品信息列表应按药品首次注册日期由近及远的顺序排列,即最近时间批准的药品排在前面;如果同一通用名称下有不同规格产品且注册日期不同,则该药品排序以最近批准注册的日期为准。 药品通用名:准确、完整填写药品批准证明文件中的名称,不得使用简称。 批准文号:同一药品通用名有不同批准文号,填写在不同行。如果没有批准文号,填写注册证号。 包装规格:同一批准文号有多个包装规格均需填写,同一行可填写多个药品包装规格。 国内首次注册日期:指在中国首次获得该规格通用名药批准证明文件的日期。 注册分类:按药品批准证明文件上的注册分类填写,没有明确注册分类填写“未分类”。 是否进口:指报告年度内药品是否进口,以报告年度内完成进口通关手续为标准。 销量及单位:销量指报告年度内持有人或其经销商在境内销售的药品数量。没有销售填“未销售”。销量单位按制剂单位填写,如片、粒、支、袋等。销量如以万位计,保留至少三位有效数字,如1234万片、12.3万片。 2.2药品信息变更情况 是指自上一次撰写年度报告至本次撰写年度报告期间,直报系统中持有人维护的药品信息(“产品信息维护”模块)实际发生变更的情况,无论持有人是否在直报系统中进行了更新。一个通用名药有多个项目变更,填写多行。首次撰写年度报告应该填写自持有人在直报系统中注册至本次撰写年度报告期间,直报系统中持有人维护的药品信息发生变更的情况。 药品通用名:该名称如果发生变更,填写变更后的名称。 直报系统项目名称:按直报系统中“产品信息维护”的项目名称填写。 变更前(后)内容:如果药品是报告年度内新批准注册的,变更前内容应填写“无”,变更后内容应填写“所有”;如果是报告年度内注销药品注册证书的药品,变更前的内容应填写“所有”,变更后的内容应填写“无”。 是否在系统中更新:指持有人自上次撰写年度报告后,是否已经在直报系统中提交了更新信息。 变更原因:简述变更原因以及其他需要说明的问题。 3 药物警戒体系 3.1境内药物警戒负责人:填写当前信息。“药物警戒负责人”指持有人指定的具有一定领导职务,具备多年从事药物警戒工作经验,熟悉相关法律法规及政策,能够负责药物警戒体系的建立、运行和维护,确保药物警戒工作持续合规的人员,且该人员长期居住在中国境内。“职务”指在本持有人/代理人单位所任职务,如有多种职务,仅填写与药物警戒相关的职务。“药物警戒累计从业年限”指在任何地点从事药物警戒工作的累积年限。 3.2境内药物警戒专门机构:填写当前信息。“境内药物警戒专门机构”指持有人在境内指定的专门从事药物警戒工作的机构或部门。“同代理人”指代理人即是持有人指定的专门机构;“代理人相关部门”指专门机构是代理人内设的相关部门;“其他委托机构”指代理人委托的其他独立法人或机构。 3.3 药物警戒管理制度:填写报告年度信息。指持有人在报告年度是否建立了与境内药物警戒工作相关的管理制度。已有相关管理制度,不仅包括制定了制度文件,还包括对制度文件进行了落实,即制度已经实施。 3.4报告度内接受监管部门检查情况:检查是指报告年度内监管部门按照《药品不良反应报告和监测管理办法》《药品不良反应报告和监测检查指南》对境外持有人/代理人进行的检查。如有多次检查,填写报告年度内最近一次检查的情况。如果对代理人/境外持有人的检查延伸至委托机构,“检查类别”同时勾选“延伸检查”,并填写被检查单位名称。如果对持有人开展了境外检查,勾选“境外检查”。如有问题清单、整改报告,应随年度报告一并提交。 3.5 委托工作及其他情况:“委托工作情况”指持有人/代理人委托其他单位开展境内药物警戒相关工作的情况,请填写委托单位名称全称,简要填写委托内容,如“不良反应收集”“不良反应报告提交”“不良反应文献检索”等。境内外个例ADR上报方式中,“个例报告表”指通过在线填写《上市许可持有人药品不良反应/事件报告表》方式上报;“E2B传输”指按照ICH E2B格式传输上报;“行列表”是指按照《药品不良反应报告和监测管理办法》对境外报告的要求上报。 3.6药物警戒体系自评:持有人对其现有的药物警戒体系能否保障境内警戒工作有效开展进行自评,并简述报告年度内药物警戒体系已经改善的方面。 4 个例药品不良反应报告 4.1境内信息自主收集途径:指持有人根据《个例药品不良反应收集和报告指导原则》建立的自主收集境内药品不良反应信息的途径,不包括监管部门反馈信息包含的来源途径,例如持有人虽然收到监管部门反馈的医疗机构和经营企业的报告,但自主收集不包括这两个渠道,不能算建立了该途径。 4.2-4.3境内(外)报告 本部分汇总持有人所持进口药品的不良反应报告情况。境内报告是指进口药品在中国境内发生的不良反应报告;境外报告是指进口药品在境外(包括港、澳、台地区)发生的不良反应报告。以行列表形式提交的境外报告也应汇总。 境内(外)报告表应按通用名填写,同一通用名药填写一行。报告年度无论是否生产或销售,只要表中某项报告不为零,均应填写该表,所有项目均为零的药品无需填写该表。报告数量按病例计,跟踪报告不另计数。某项没有报告不填写。 自主收集的报告数量:指持有人从各种途径自主收集的个例报告数量的总和,不包括监管部门反馈的报告数量。 境内监管部门反馈的报告数量:指持有人通过直报系统接收的境内监管部门反馈的所有不良反应报告数量。填写年度反馈的总报告数量,以及持有人对反馈报告进行处理后又提交至直报系统中的报告数量。报告年度反馈给持有人的报告无论何时向直报系统提交,皆应算在本报告年度的报告数量中。 备注:持有人需要说明的其他问题。 5 定期分析评价 66号公告规定,持有人应定期对药品不良反应监测数据、临床研究、文献等资料进行评价,并按规定要求做好定期安全性更新报告(PSUR)的撰写及上报工作。 5.1 定期分析评价 定期分析评价是持有人发现药品风险的重要方式,持有人应根据药品上市时间、风险特征或监管部门要求,制定年度定期分析评价计划,并按计划开展工作。应综合所有安全性数据进行分析评价,包括全球数据。对于报告年度内已经开展了定期分析评价的药品(有分析报告支持),填写定期分析评价表。定期分析评价表按首次注册日期由近及远排序。PSUR相关情况不在此表中汇总。 药品名称:一般填写药品通用名称或活性成份名称,根据实际开展情况填写。 首次注册日期:如果该药品有多个首次注册日期,填写最早批准的日期。 计划分析周期:指持有人根据药品上市时间长短、药品风险特征或监管部门要求制定的分析评价周期。 实际分析次数:报告年度实际开展分析评价的次数。 是否发现重要风险:重要风险包括持有人自主发现或境内外监管部门告之的。重要风险可参考ICH E2C(R2)对重要已识别风险(Important identified risk)和重要的潜在风险(Important potential risk)的解释。发现的重要风险在第6项中进行描述。 备注:需要说明的其他内容,如未按计划开展分析评价的原因等。 5.2 定期安全性更新报告 本表汇总报告年度内应提交定期安全性报告(PSUR)的所有药品,应提交但未提交的也应列入。 药品名称:一般填写药品通用名称或活性成份名称,根据实际开展情况填写。 首次注册日期:如果该药品有多个首次注册日期,填写最早批准的日期。 提交PSUR的日期:指报告年度内向直报系统提交PSUR的日期。提交频率小于一年的,按实际情况填写多个提交日期,并在备注中说明原因。PSUR被退回后再次提交,仅填写第一次提交的日期。 是否按时提交:指PSUR是否按《药品不良反应报告和监测管理办法》要求的时限提交。按国际诞生日提交公司统一PSUR的,应在备注中说明,如果未延期提交,填写“是”。 是否发现重要风险:重要风险包括持有人自主发现或境内外监管部门告之的,重要风险可参考ICH E2C(R2)对重要已识别风险(Important identified risk)和重要的潜在风险(Important potential risk)的解释。发现的重要风险在第6项中进行描述。 备注:需要说明的其他内容,如未按时提交PSUR的原因。 6 风险评估和控制 填写报告年度新发现的重要风险(参见第5部分)以及既往重要风险的评估状态和控制情况的更新信息。未发现新风险或无更新信息,仅勾选“无新信息”,其他内容不填写。 编号:按四位年份(发现风险年份)+四位顺序号填写,如20180001。一个药品有多个风险,填写多个编号,一个编号占一行。某个药品的某个风险,其编号应始终保持不变。 药品名称:填写与重要风险相关的药品名称。 风险简述:简述重要风险的内容,可填写不良反应/事件名称。 评估状态:填写报告年度结束时该风险的评估状态。其中,“正在进行中”指正在开展分析评估、正在累积监测数据、正在开展安全性研究、正在制定风险控制措施等;“无需采取措施”指已经完成评估,但评估结果认为无需采取或更新风险控制措施;“已经采取措施”指已经完成评估,并已经采取或更新了风险控制措施;“后效评估中”指正在对风险控制措施的执行效果进行评估,以确定是否需要更新风险管理措施;“其他”指评估状态的其他情况,请简要叙述。 风险控制措施和控制措施描述:评估状态选择“已经采取措施”时,填写这两项。指针对重要风险持有人在中国已经采取的风险控制措施,勾选相应选项,并进行简单描述,有附件请注明。“说明书变更”指持有人因重要风险变更药品说明书的情况,且为已经批准或备案的变更;描述变更内容,如果内容过长,以附件形式提交变更说明表,包括变更的项目、变更前后内容对比、变更的详细原因;如果尚未在直报系统中提交更新的说明书,应在年度报告中以附件形式提交更新的说明书。“风险警示或沟通”指持有人通过适当的形式将风险信息有效传递给医务人员和患者,以达到风险告知和指导临床合理用药的目的;描述风险警示和沟通的方式,风险沟通内容应作为附件提交。“召回药品”指持有人主动或按监管部门要求采取的药品召回措施;描述召回原因、召回范围、召回批号和数量等。“暂停生产销售使用”指持有人主动或按监管部门要求暂停药品生产、销售或使用的情况;描述原因、暂停时间和范围等。“注销注册证书”指持有人主动注销或被监管部门注销药品注册证书的情况,描述注销原因、时间等。“其他”指除上述措施外持有人采取的其他措施,包括实施以药品限制性使用、受控使用为目的风险控制计划等;描述风险控制措施的主要内容,风险控制计划应作为附件提交。 信息公开情况:指向社会公开风险控制措施的情况,描述公开的时间、方式和平台。未公开不填写。 7 上市后安全性研究 年度报告中应汇总的上市后安全性研究包括持有人发起或赞助的,在全球任何地点开展的,以药品安全性为主要目的和终点的研究,如非临床研究、临床研究、流行病学研究、主动监测、对临床试验的荟萃分析等,但对文献不良反应的综述除外。 上市后安全性研究列表应填写报告年度启动的研究情况,并更新既往研究的状态及相关信息。未启动新研究或既往研究无更新信息,仅勾选“无新信息”,其他内容不填写。 研究编号:公司为研究分配的编号,无编号的可以填写顺序号。 研究标题:填写研究标题的中文全称。研究标题应包括主要研究药品的名称,或在备注中说明研究的药品。 研究动因:简述促使企业开展研究的原因,如按法规要求开展重点监测、注册批件要求、监管部门要求、主动开展、上市后承诺等。 启动时间:“启动”指报告年度已经制定了研究方案并且开始实施(如开始入组病例)。启动时间具体到月份。 研究状态:选择截至报告年度末研究处于的状态;因任何原因暂停或中止(研究未完成但不再继续)研究,在备注中简要说明原因;“完成”指报告年度研究已经结束并完成了最终的研究报告。 研究地点:在境内开展的研究填写研究涉及的省份,涉及省份较多可填写省份数量;境外开展的研究填写开展的国家或地区。 研究结论:研究状态选择“完成”的,概括重要的安全性研究结论,未完成不填写。 备注:研究状态选择 “暂停或中止”的应在备注中说明原因,并填写需要说明的其他问题。 8 药物警戒工作自评 持有人对报告年度境内开展的药物警戒工作进行自评,简要叙述报告年度在不良反应收集、报告、评价、控制等方面取得的主要进展和存在的主要问题,以及下一年度有何改进计划。 9 其他说明 持有人/代理人对年度报告中填写的内容需要说明的其他问题,没有填写“无”。 10 附件列表 与年度报告一起提交的附件列表。 附件:1.国产药品持有人年度报告模板
附件2.进口药品持有人年度报告模板
|
【本文地址】
今日新闻 |
点击排行 |
|
推荐新闻 |
图片新闻 |
|
专题文章 |
 返回搜狐,查看更多
返回搜狐,查看更多