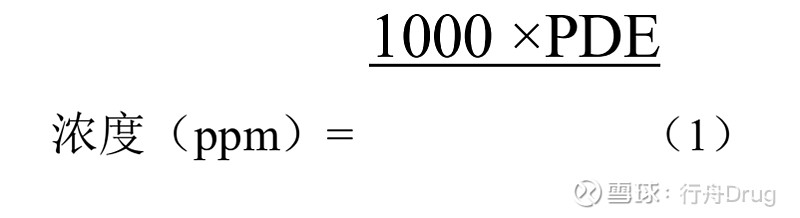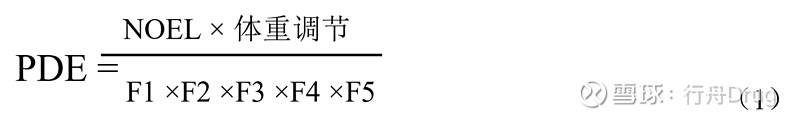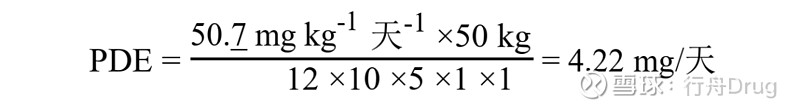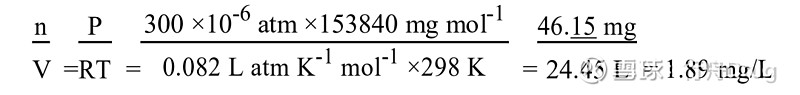CDE发布ICH Q3C(R8)《残留溶剂指导原则》实施建议,与2020版药典不同! 点击上方的 行舟Drug ▲ 添加关注 今日,国家药监局药品审评中心发布《关于公开征求ICH E14及问答和Q3C (R... |
您所在的位置:网站首页 › 乙腈英文缩写是什么 › CDE发布ICH Q3C(R8)《残留溶剂指导原则》实施建议,与2020版药典不同! 点击上方的 行舟Drug ▲ 添加关注 今日,国家药监局药品审评中心发布《关于公开征求ICH E14及问答和Q3C (R... |
CDE发布ICH Q3C(R8)《残留溶剂指导原则》实施建议,与2020版药典不同! 点击上方的 行舟Drug ▲ 添加关注 今日,国家药监局药品审评中心发布《关于公开征求ICH E14及问答和Q3C (R...
来源:雪球App,作者: 行舟Drug,(https://xueqiu.com/4396147139/201962407) 点击上方的 行舟Drug ▲ 添加关注 今日,国家药监局药品审评中心发布《关于公开征求ICH E14及问答和Q3C (R8)指导原则实施建议的通知》,为做好ICH指导原则转化实施工作,CDE拟定了ICH《E14及问答:非抗心律失常药物致QT/QTc间期延长及潜在致心律失常作用的临床评价及问答文件》和《Q3C(R8):杂质:残留溶剂》指导原则转化实施建议,同时发布了ICH Q3C(R8)指导原则中文翻译稿。如下:
ICH E14及问答和Q3C (R8)指导原则 实施建议 ICH指导原则名称 实施建议 E14及问答:非抗心律失常药物致QT/QTc间期延长及潜在致心律失常作用的临床评价及问答文件 自公告发布之日起12个月后启动的药物临床研究的相关要求适用E14及问答 Q3C(R8):杂质:残留溶剂 申请人需在现行药学研究技术要求基础上,按照ICH Q3C(R8)指导原则的要求开展研究;本公告发布之日2个月后开始的相关研究(以试验记录时间点为准),均适用该指导原则 该指导原则与我国2020版药典所载要求略有不同,中文翻译稿如下: ICH Q3C(R8)杂质:残留溶剂的指导原则 中文翻译稿 第一部分:杂质:残留溶剂的指导原则 在1997年7月17日的ICH指导委员会会议上进入ICH进程第四阶段,并建议ICH的三方监管机构采纳该指导原则 1引言 本指导原则旨在建议为保证患者安全而应规定的药物中残留溶剂的可接受量。本指导原则建议使用低毒的溶剂,并阐述了一些残留溶剂在毒理学上的可接受水平。 药物中的残留溶剂在此定义为在原料药或辅料的生产中以及制剂制备过程中使用或产生的有机挥发性化合物。这些溶剂在实际生产技术中不能完全除去。选择适当的溶剂合成原料药可提高收率或决定药物的性质,如晶型、纯度和溶解度。因此,溶剂有时可能是合成工艺的关键因素。本指导原则并不针对特意用作辅料的溶剂,也不针对溶剂化物。然而这些制剂中的溶剂也应进行评价,并论证其合理性。 由于残留溶剂没有治疗益处,故应尽可能除去所有残留溶剂,以符合制剂质量标准、生产质量管理规范(GMP)或其他质量要求。制剂的残留溶剂量不应高于安全性数据可支持的水平。除非在风险-收益评估中强有力地论证了使用这些溶剂的合理性,否则在生产原料药、辅料或制剂时,应避免一些已知会引起不可接受的毒性的溶剂(1类,表1)。对于一些毒性较不严重的溶剂(2类,表2),应进行限制,以防止患者出现潜在的不良反应。如切合实际,应尽可能使用低毒溶剂(3类,表3)。附录1中列出了本指导原则涵盖的全部溶剂。 表中所列溶剂并非详尽无遗,可使用其他溶剂并在日后补充到该列表中。第1、2类溶剂的建议限度或溶剂分类可能会在得到新的安全性数据时变更。含有新溶剂的新制剂其上市申请的支持性安全性数据应符合本指导原则或原料药指导原则(Q3A,新原料药中的杂质)或制剂指导原则(Q3B,新药制剂中的杂质)中所述的杂质控制原则,或者同时符合上述三者。 2指导原则的适用范围 本指导原则的范围包括原料药、辅料和制剂中所含的残留溶剂。因此,当已知生产或纯化工艺中会出现这些溶剂时,应进行残留溶剂检查。且仅有必要对原料药、辅料或制剂的生产或纯化中使用或产生的溶剂进行检查。生产商可选择检验制剂,也可根据制剂生产所用的各成分的残留溶剂水平,累积计算出制剂中残留溶剂整体水平。如果算出的结果等于或低于本指导原则建议的水平,则不需考虑对制剂进行该残留溶剂检查。但如果计算结果高于建议水平,则应对制剂进行检验,以确定制剂工艺是否将有关溶剂的量降至可接受水平。如果制剂生产中用到某种溶剂,也应对制剂进行检验。 本指导原则不适用于临床研究开发阶段所使用新原料药、辅料和制剂,也不适用于已上市的制剂。 本指导原则适用于所有剂型和给药途径。在特定情况下,如短期(如30天或更短)使用或局部使用时,允许存在更高的残留溶剂水平。应根据不同情况论证这些溶剂水平的合理性。 有关残留溶剂的其他背景资料,请参见附录2。 3通则 3.1 基于风险评估的残留溶剂的分类 “可耐受的日摄入量”(TDI)是国际化学品安全方案(IPCS)用于阐述毒性化合物暴露限度的术语,“可接受的日摄入量”(ADI)是世界卫生组织(WHO)及一些国家和国际卫生组织所用的术语。在本指导原则中,将新术语“每日允许暴露量”(PDE)定义为药学上可接受的残留溶剂摄入量,以避免与同一物质的ADI混淆。 将本指导原则中评价的残留溶剂按通用名和结构列于附录1。评价了其对人体健康的潜在危害,并将其分为以下三类: 1类溶剂:应避免的溶剂 已知的人体致癌物,强疑似人体致癌物,以及环境危害物。 2类溶剂:应限制的溶剂 非遗传毒性动物致癌物质,或可能导致其他不可逆毒性如神经毒性或致畸性的溶剂。 可能有其他严重但可逆的毒性的溶剂。 3类溶剂:低潜在毒性的溶剂 对人体低潜在毒性的溶剂,无须制定基于健康的暴露限度。3类溶剂的PDE为每天50 mg或50 mg以上。 3.2 建立暴露限度的方法 用于建立残留溶剂的“每日允许暴露量”(PDE)的方法见附录3。用于建立限度的毒理学数据总结参见Pharmeuropa第9卷第1增补版,1997年4月。 3.3 2类溶剂限度的表示方法 制定2类溶剂的限度时有两种选择。 方法1:可以使用表2中列出的浓度限度(ppm)。假定某制剂的日给药量为10 g,用以下公式(1)计算。
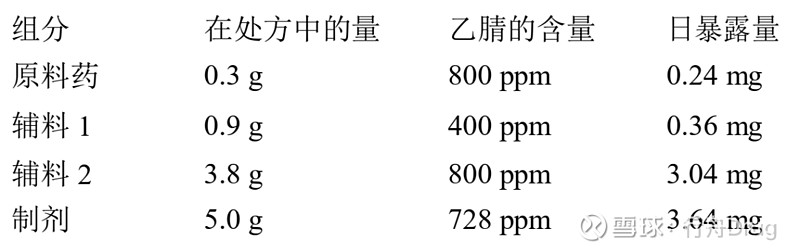
其中,PDE的单位为mg/天,剂量的单位为g/天。 认为这些限度适用于所有原料药、辅料和制剂。因此,若日摄入总量未知或未定,可采用这种方法。若处方中的所有辅料及原料药都符合方法1的限度,则这些组分可按任意比例使用。只要日摄入总量不超过10 g,就无须进一步计算。若制剂的给药剂量超过10 g/天,则应按方法2考虑。 方法2:认为制剂的各种成分不必都符合方法1的限度。可用表2中注明的PDE(mg/天)、已知最大日摄入总量和公式(1)来确定制剂中允许的残留溶剂的浓度。在证明已尽力降低该残留溶剂至实际可达到的最低水平的前提下,可接受这些计算所得限度。这些限度在分析精密度、生产能力和生产工艺的合理变异方面应现实可行,并应反映当前的生产技术水平。 应用方法2时可将制剂各成分所含的残留溶剂累加。每天的溶剂总量应低于PDE给定的值。 下面举例说明如何将方法l和2应用于制剂中的乙腈。乙腈的每日允许暴露量是4.1 mg/天,因此方法1限度是410 ppm。制剂的日最大给药量是5.0 g,含两种辅料。制剂中的成分和算出的最大乙腈残留量见下表。
辅料1符合方法1限度,但原料药、辅料2和制剂不符合方法1限度。而制剂符合方法2限度,即4.1 mg/天,故符合本指导原则的建议。 再考虑以乙腈作为残留溶剂的另一示例。制剂的日最大给药量是5.0 g,含两种辅料。制剂中的成分和算出的最大乙腈残留量见下表。
在该示例中,根据累加结果,该制剂既不符合方法1也不符合方法2限度。生产商可对制剂进行检测,确定处方工艺能否降低乙腈的水平。如果在制剂过程中不能将乙腈水平降至允许限度,制剂生产商应采取其他措施来降低制剂的乙腈含量。若所有措施均 不能降低残留溶剂的水平,在特殊情况下,生产商可提供工作总结报告,说明为将残留溶剂降低到符合指导原则值所作的努力,提供风险-收益分析,为允许使用残留溶剂量较高的制剂提供支持。 3.4 分析方法 残留溶剂通常用色谱技术(如气相色谱法)测定。如可能,应采用药典规定的统一残留溶剂测定方法。生产商也可根据特定申请自由选择适宜的经验证的分析方法。若仅存在3类溶剂,可用非专属性的方法如干燥失重来检查。 残留溶剂的方法学验证应遵循ICH指导原则:《分析方法验证》正文及增补部分。 3.5 残留溶剂的报告水平 制剂生产商需要了解原料药和辅料残留溶剂的某些信息,以符合本指导原则的标准。以下阐述了这些信息(应由原料药或辅料供应商提供给制剂生产商)可接受的例子供应商可视情况选择以下一项: 仅可能存在3类溶剂。干燥失重小于0.5 %。 仅可能存在2类溶剂,X、Y……。全部低于方法1的限度。(这里供应商可将2类溶剂用X、Y……来表示) 仅可能存在2类溶剂X、Y……和3类溶剂。残留的2类溶剂低于方法1的限度,残留的3类溶剂低于0.5 % 如果可能存在1类溶剂,应进行鉴定并定量。 “可能存在”系指用于工艺最后一步,以及用于较前几步生产工艺、用经验证的工艺不能一致地除尽的溶剂。 如果2类溶剂高于方法1的限度或3类溶剂高于0.5 %,应对其进行鉴定和定量。 4残留溶剂的限度 4.1 应避免的溶剂 由于1类溶剂具有不可接受的毒性或对环境造成危害,原料药、辅料及制剂生产中不应使用该类溶剂。但是,为了生产一种有显著治疗优势的制剂而不得不使用时,除非经过论证,否则应按表1进行控制。1,1,1-三氯乙烷因危害环境而列入表1,其限度1500ppm是基于安全性数据而定的。 表1:制剂中的1类溶剂(应避免的溶剂)。
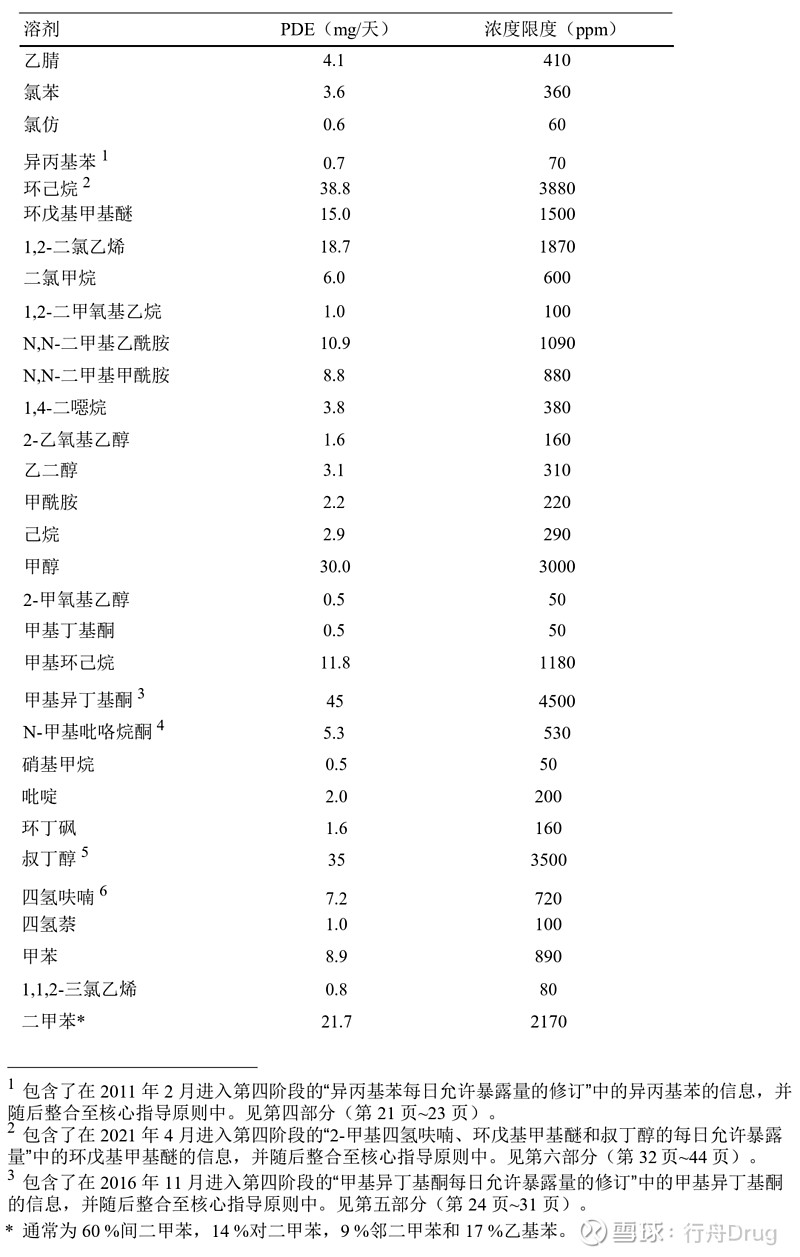
4.2 应限制的溶剂 由于表2所列溶剂的固有毒性,应限制其在制剂中的使用。规定PDE约为0.1 mg/天,浓度约10 ppm。所列值并不反映测定方法所必需的分析精密度。精密度的测定应作为方法学验证的一部分。 表2:制剂中的2类溶剂。
4.3 低潜在毒性的溶剂 类溶剂(见表3)可视为低毒、对人类健康危害风险较低的溶剂。3类溶剂不包括药学常见水平对人类健康有危害的溶剂。然而,许多3类溶剂没有长期毒性或致癌性研究。现有数据表明,其在急性或短期研究中毒性较小,遗传毒性研究结果呈阴性。因此认为每日50 mg或更少量(用方法1计算时,对应于5000 ppm或0.5 %)时无须论证即可接受。如符合生产能力和GMP的实际情况,也可接受更大的残留量。 表3:应受GMP或其他质量要求限制的3类溶剂。
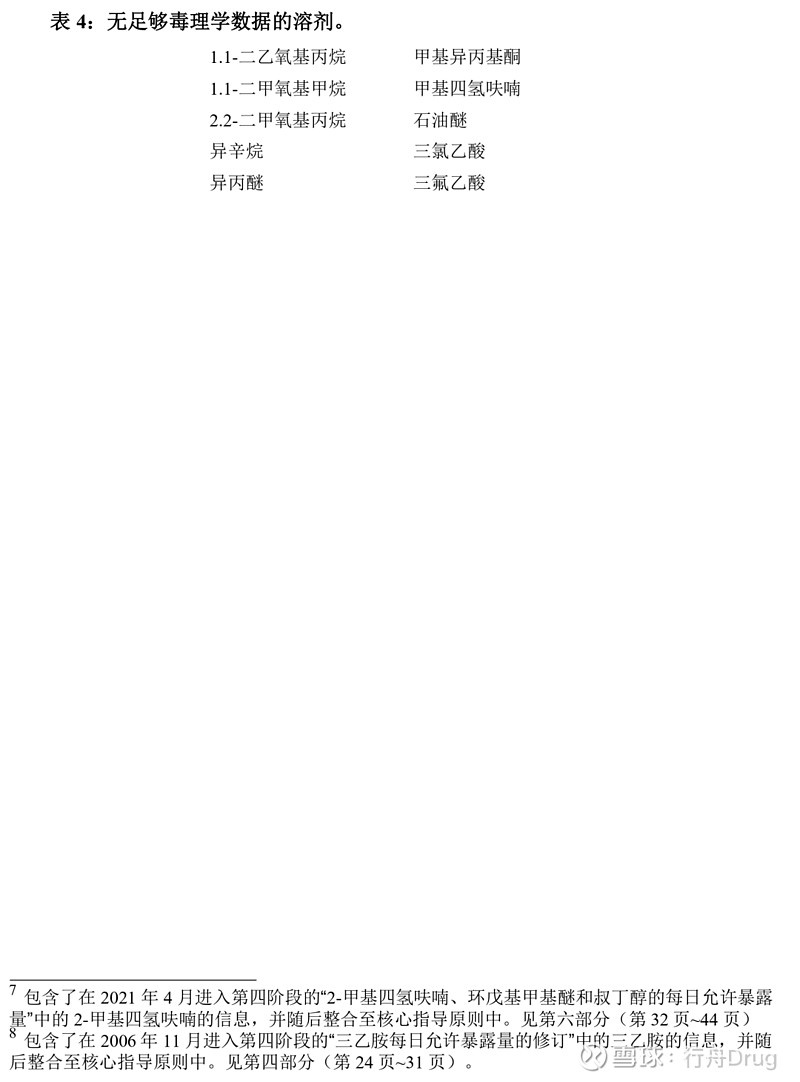
4.4 没有足够毒理学数据的溶剂 生产商在辅料、原料药和制剂生产中还可能会采用以下溶剂(表4)。但尚无足够的毒理学数据,故无PDE值。生产商应论证这些溶剂在制剂中的残留量的合理性。 表4:无足够毒理学数据的溶剂。
词汇表 遗传毒性致癌物(Genotoxic Carcinogens):指通过影响基因或染色体而致癌的物质。 LOEL:观察到作用的最低水平“lowest-observed effect level”的缩写。 观察到作用的最低水平(lowest-observed effect level):在一项研究或一组研究中,在人或动物暴露于某物质后任何生物学效应发生频率或严重程度显著增加的最低暴露量。 校正因子(Modifying Factor):毒理学家通过专业评判确定的一个独立因子,用于关联生物测定数据与人体安全性数据。 神经毒性(Neurotoxicity):某种物质引起神经系统不良反应的能力。 NOEL:未观察到作用水平“no-observed-effect level”的缩写。 未观察到作用水平(No-Observed Effect Level):暴露于某种物质的人体或动物其反应频率或严重性在生物学上无显著增加的最高物质剂量。 PDE:每日允许暴露量“permitted daily exposure”的缩写。 每日允许暴露量(Permitted Daily Exposure):指药物中残留溶剂每日可接受的最大摄入量。 可逆毒性(Reversible Toxicity):某种物质导致有害作用发生,停止暴露于该物质时反应消失。 强疑似人体致癌物(Strongly Suspected Human Carcinogen):一种没有明确致癌作用的流行病学证据,但遗传毒性数据呈阳性,在啮齿动物中有明确致癌性证据的物质。 致畸性(Teratogenicity):在怀孕期间使用某物质时造成胎儿发育产生结构性畸形的现象。 附录1:指导原则中包括的溶剂列表
附录2:其他背景 A2.1环境领域对有机挥发性溶剂的监管 在环境健康标准(EHC)专论和综合风险识别系统(IRIS)中,将几种经常用于药物生产的残留溶剂列为有毒化学物质。国际化学品安全方案(IPCS)、美国环境保护署(USEPA)和美国食品药品监督管理局(USFDA)等组织的目标包括确定可接受的暴露水平。目的是防止长期暴露于化学品后可能对人体健康和对整个环境造成危害。估计最大安全暴露限度的方法通常基于长期研究。当没有长期研究数据时,可使用较短期的研究数据,此时需调整计算方法(例如使用较大的安全因子)。其中所述方法主要涉及一般人群在周围环境(即环境空气、食物、饮用水和其他介质)中的长期或终身暴露。 A2.2药物中的残留溶剂 本指导原则中的暴露限度是参考EHC和IRIS专论中的毒性数据和方法学而建立的。但在建立暴露限度时,应考虑药物的合成和制剂处方中所用溶剂残留的一些特定假设。即: 1)患者(不是一般人群)使用药物是为了治疗疾病或预防疾病,以免受感染和患病。 2)对大多数药物来说不必假设患者终身暴露,但可能适合作为一种假设情形来降低对人体健康产生危害的风险。 3)残留溶剂是药物中不可避免的成分,常常是制剂的一部分。 4)除特殊情况外,残留溶剂不得超过推荐水平。 5)用于确定残留溶剂可接受水平的毒理学研究数据应采用合适的方案得到,如OECD、EPA和FDA红皮书的示例所述的方案。 附录3:建立暴露限度的方法 Gaylor-Kodell风险评估方法(Gaylor,D, W. And Kodell, R. L.: Linear Interpolation algoeithm for low dose assessmentof toxic substance. J Environ. Pathology, 4, 305, 1980)适合1类致癌溶剂。只有掌握了可信赖的致癌数据,才可以用数学模型外推来建立暴露限度。1类溶剂的暴露限度应基于未观察到作用水平(NOEL)并使用较大的安全因子(如10000到100000)来确定。这些溶剂的检测和定量应采用先进的分析技术。 根据设定药物中溶剂暴露限度的方法(药典论坛,1989年11月~12月)和IPCS用于评估化学品对人体危害的方法(环境卫生标准170,WHO,1994)计算PDE值,建立了本指导原则中2类溶剂的可接受暴露限度。这些方法与USEPA(IRIS)和USFDA(红皮书)采用的方法及其他一些方法相似。在此概述这种方法有助于更好地理解PDE值的由来。在使用本文件第4节表中的PDE值时不必再进行这些计算。 PDE是由大多数相关动物研究中的未观察到作用水平(NOEL)或观察到作用的最低水平(LOEL)得出的,如下:
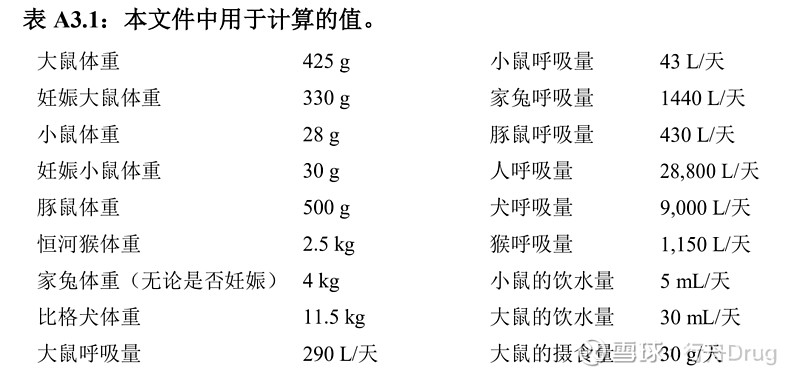
PDE首选用NOEL得出计算。如果没有NOEL值,可用LOEL。此处用于将数据与人体关联起来的校正因子与环境卫生标准(环境卫生标准170,世界卫生组织,日内瓦,1994年)中的“不确定系数”及药典论坛中的“校正因子”及“安全因子”属于同一类。 无论何种给药途径,在所有计算中均假定全身暴露量为100 %。 校正因子如下: F1 =考虑物种间差异的因子 F1 = 5,适用于从大鼠外推到人 F1 = 12,适用于从小鼠外推到人 F1 = 2,适用于从犬外推到人 F1 = 2.5,适用于从家兔外推到人 F1 = 3,适用于从猴外推到人 F1 = 10,适用于从其他动物外推到人 F1考虑了相关物种及人的表面积与体重的比值。体表面积计算公式如下:
其中,M =体重,常数K取10。公式中的体重见表A3.1。 F2 = 10,考虑个体差异的因子 所有有机溶剂一般取因子10,本指导原则中一致地采用10。 F3 =考虑短期暴露的毒性研究的可变因子 F3 = 1,研究时间至少为动物寿命一半(啮齿动物或兔为1年,猫、狗和猴为7年)。 F3 = 1,涵盖整个器官形成期的生殖研究。 F3 = 2,为期6个月的啮齿动物研究,或为期3.5年的非啮齿动物研究。 F3 = 5,为期3个月的啮齿动物研究,或为期2年的非啮齿动物研究。 F3 = 10,持续时间更短的研究。 在所有情况下,对研究时间介于上述时间点之间的研究应用较大的因子,如对为期9个月的啮齿类动物毒性研究采用因子2。 F4 =在诸如非遗传毒性致癌性、神经毒性或致畸性等严重毒性的情况下可应用的因子。在生殖毒性研究中采用以下因子: F4 = 1,与母体毒性有关的胎儿毒性 F4 = 5,无母体毒性的胎儿毒性 F4 = 5,有母体毒性的致畸反应 F4 = 10,无母体毒性的致畸反应 F5 =未确定无反应水平时可应用的可变因子 在只有LOEL可用时,根据毒性的严重程度,可以使用高达10的因子。 体重调整假设任何成年人的体重为50 kg(不论性别)。相对于这类计算中常用的60 kg或70 kg标准体重,较小的体重提供了额外的安全因子。有些成年患者体重小于kg。在确定PDE时,对这些患者应考虑对固有的安全因子进行调整。如果专供儿童使用的处方中含有溶剂,针对较轻的体重进行调整或许是合适的。 举例说明该公式的应用,考虑小鼠中乙腈毒性研究(总结于Pharmeuropa第9卷第1增补本,1997年4月,第S24页)。算出NOEL为50.7 mg/kg/天。本研究中乙腈的PDE计算如下:
在本例中, F1 = 12,考虑从小鼠外推到人 F2 = 10,考虑人的个体差异 F3 = 5,因为研究的持续时间只有13周 F4 = 1,因为未发现严重毒性 F5 = 1,因为已测得无反应水平 表A3.1:本文件中用于计算的值。
用理想气体方程(PV=nRT)将吸入研究中采用的气体浓度的单位由ppm转换为mg/L或mg/m3。以大鼠吸入四氯化碳(分子量153.84)的生殖毒性研究(见 Pharmeuropa第9卷第1增补本,1997年4月,第S9页)为例。
用1000 L = 1 M3将单位转换为mg/m3。 文章信息源于公众号NMPA,登载该文章目的为更广泛的传递行业信息,不代表赞同其观点或对其真实性负责。文章版权归原作者及原出处所有,文章内容仅供参考。本网拥有对此声明的最终解释权,若无意侵犯版权,请联系小编删除。 学如逆水行舟,不进则退; 心似平原走马,易放难收。
行舟Drug 每日更新 欢迎订阅+ 医药大数据|行业动态|政策解读 |
【本文地址】
今日新闻 |
点击排行 |
|
推荐新闻 |
图片新闻 |
|
专题文章 |