【科技前沿】Life Metabolism |
您所在的位置:网站首页 › mtor和ampk › 【科技前沿】Life Metabolism |
【科技前沿】Life Metabolism
mTOR是细胞内的关键代谢调控因子,它能够形成两个复合体——mTORC1和mTORC2。其中mTORC1能响应葡萄糖、氨基酸等营养物质,并在它们充足时被激活,进而通过调节其下游底物,促进脂肪酸、蛋白质、胆固醇的合成代谢以及营养物质的储存,从而促进细胞生长【1】。当葡萄糖水平下降时,机体需要快速有效地抑制mTORC1的活力,以避免高强度的合成代谢所造成的细胞能量水平下降【2】。 目前已经发现,葡萄糖水平下降所引起的mTORC1的抑制至少可以被两个“轴”所调控。其一是通过林圣彩课题组发现的醛缩酶-TRPV-v-ATPase-Ragulator-RAGs轴:低葡萄糖引起糖酵解产物果糖1,6-二磷酸(FBP)和磷酸二羟丙酮(DHAP)水平的下降,使其感受器醛缩酶处于不被二者(底物)结合的状态【3,4】(详情请见:林圣彩专题)。进一步地,醛缩酶抑制了内质网上的TRPV通道,后者又引起了溶酶体上的v-ATPase质子泵活力的下降,导致了同样定位在溶酶体上的Ragulator复合体被抑制,使得与Ragulator相结合的小G蛋白RAGs被抑制【5-7】。失去活力的RAGs不再能结合mTORC1,也离开了它的另一关键激活因子——主要定位在溶酶体上的小G蛋白Rheb,使得mTORC1离开溶酶体,最终使得mTORC1被抑制【8】。其二是通过机体内另一代谢关键调控因子AMPK:葡萄糖水平下降引起AMPK的激活,后者可以通过磷酸化mTORC1上的Raptor亚基直接抑制mTORC1的活力,或者通过磷酸化并激活Rheb的GAP——TSC2,引起mTORC1的抑制【9, 10】。AMPK还能够通过活化ULK1,或者抑制GATOR2等因子的方式,介导mTORC1的抑制【11, 12】。然而,这两个轴之间的关系,比如它们谁更关键(缺了就不行)、谁的作用又更强,却一直未能弄清,甚至有争议。例如,多个研究表明,AMPK缺失后,葡萄糖水平的下降仍能引起mTORC1的抑制【13, 14】;但另一些研究则表明激活AMPK本身对于mTORC1的抑制是至关重要的,因为Raptor和TSC2上的AMPK磷酸化位点的突变,几乎能够完全阻止mTORC1的抑制【15】。 近日,林圣彩课题组在Life Metabolism杂志上发表了题为 Hierarchical inhibition of mTORC1 by glucose starvation-triggered AXIN lysosomal translocation and by AMPK 的文章,初步揭示了上述这两个轴对mTORC1抑制的在功能上的异同。他们发现,葡萄糖水平下降时,醛缩酶-TRPV-v-ATPase-Ragulator-RAGs轴介导的mTORC1离开溶酶体是mTORC1抑制所必需,而AMPK则在此基础上加快了对mTORC1活力本身的抑制(图1)。  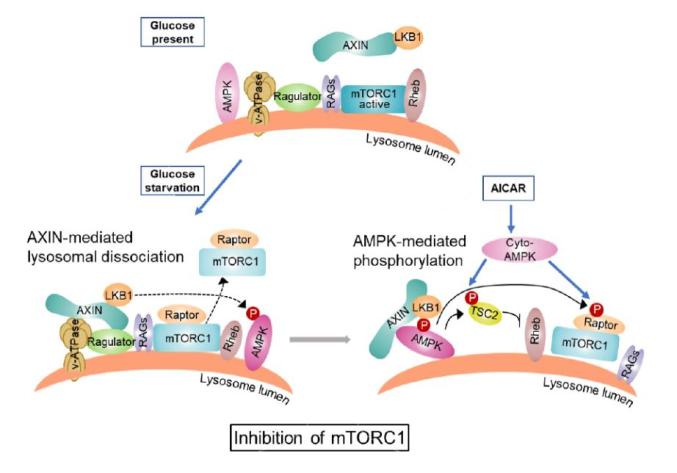 图1 低葡萄糖条件下,mTORC1受到不同层次的抑制作用 为了得到全面而准确的、两个轴抑制mTORC1的效果的信息,作者们选择分析mTORC1在低葡萄糖情况下的抑制的动力学过程,即比较了mTORC1活力下降的速率。同时,他们选择在同一株细胞中分别阻断两个轴——敲除AMPK,和引入组成型激活的RAGs(敲除RAGs后再引入组成型激活的RAGB,即RAGBGTP),如此避免了不同细胞株里的mTORC1本身被抑制的速率就可能不同的问题。在此基础上,他们还引入了一个和两个轴都有关系的因子——AXIN,以进一步分析这两个轴之间的关系。AXIN是作者们先前发现的低葡萄糖条件下AMPK激活的必需因子:当上述v-ATPase-Ragulator复合体被抑制时,AXIN带着和其结合的AMPK上游激酶LKB1迁移到溶酶体表面与v-ATPase-Ragulator结合,从而使LKB1激活溶酶体附近的AMPK【6, 16】。同时,AXIN结合到v-ATPase-Ragulator上,还能加快Ragulator的抑制,进而使mTORC1更快地被抑制【6】。作者们发现,敲除AMPK确实不能完全阻止mTORC1的抑制,但能够显著延缓这一过程:使mTORC1活力的半衰期由15分钟延长至30分钟;敲除AXIN,能够更加显著地延缓这一过程:使mTORC1的半衰期延长至60分钟;而组成型激活的RAGs,则完全阻止了mTORC1。这说明,低葡萄糖条件下,细胞抑制mTORC1依赖于mTORC1与溶酶体的分离(从零到一),而AMPK的作用则是加快对mTORC1活力的抑制(从一到多)。那么AXIN呢?作者们发现AXIN之所以能够引起比AMPK更显著的抑制mTORC1的作用,是因为其除了能够介导AMPK的激活以外,还能促进mTORC1离开溶酶体,而AMPK的激活则不能使mTORC1离开溶酶体。该结果进一步说明了mTORC1的溶酶体定位和其胞内活性的密切关系。 在此基础上,作者进一步使用了AICAR——一种进入细胞后能够产生AMP的类似物以激活AMPK的化合物,并比较了其与低葡萄糖对mTORC1的抑制机制的差异。不同于低葡萄糖,AICAR并不能引起mTORC1与溶酶体的分离。在此作者们发现,AICAR引起的mTORC1的抑制完全依赖于AMPK。类似地,敲除TSC2和Raptor,再引入不能被AMPK磷酸化的Raptor突变体,也起到了和AMPK敲除相像的,完全阻止mTORC1抑制的效果。AICAR引发的AMPK激活也依赖于AXIN,只不过在这里AXIN不再转移到溶酶体上激活溶酶体附近的AMPK,而是介导LKB1对细胞质内的AMPK的激活。而作者们也发现,敲除AXIN完全阻止了AICAR对mTORC1的抑制。该结果进一步说明,在AMPK活化的溶酶体途径不参与的情况下,胞质的AMPK完全掌控了对mTORC1的抑制作用。 那么新的问题又来了,为什么低葡萄糖条件下,mTORC1只要待在溶酶体上,它就能一直保持着活力——即使是AMPK已被激活,但到了AICAR处理的时,溶酶体定位这个“保护伞”就被AMPK攻破了?作者们猜测,这很可能是由于AICAR引起的(细胞质的)AMPK激活的程度要强于低葡萄糖引起的(溶酶体上的)AMPK激活,使得此时AMPK可以凌驾于溶酶体上的mTORC1,介导其抑制。的确,前人的结果也表明,即使是引入了组成型激活的RAGs,AICAR仍能直接介导mTORC1的抑制【14】。换句话说,AMPK和RAGs这两个轴对于mTORC1的调节作用是具有“当量性(stoichiometry)”的,哪个轴强度大,就有可能盖过对方的“风头”,起到主要作用。为了验证这个结论,作者们敲除了RAGs,从而移除了RAGs轴的影响(注意和组成型激活的RAGs区分——此时是RAGs轴持续性地“输出”对mTORC1活力的维持)。果然,他们发现在没有RAGs的条件下,低葡萄糖引发的mTORC1的抑制完全依赖于AMPK。根据前人的观点,此时AMPK调节的有可能是那些定位在除了溶酶体以外的、其它细胞结构上定位的Rheb【17】。类似地,他们在野生型细胞中过表达了组成型激活的Rheb,发现只要Rheb的表达量高到一定程度,AMPK就能够代替RAGs,起到对mTORC1调节的主导作用。这个发现也提示了前人的结果中出现的争议,有可能是由于不同组织、细胞类型中的两个轴的表达量以及组装形式的不同所导致的,提示我们在今后的分析中需要注意这个问题。 综上,作者们通过对mTORC1活力抑制的动力学过程的细致分析,巧妙区分了溶酶体定位的调控和AMPK活力本身的作用,初步展现了在低葡萄糖条件下,mTORC1所受到的相对不同层次的抑制作用(图1)。需要说明的是,除了这两个轴以外,人们已经发现了越来越多的,感受低糖水平“汇聚”到mTORC1并引发其抑制的机制,这些机制共同确保了mTORC1在低糖时的有效抑制,并很有可能像这两个轴一样,起到对mTORC1精密而准确的调控过程,而这其中的精彩和奥秘,还有待于我们将来去慢慢发现。 原文链接:https://doi.org/10.1093/lifemeta/load005 参考文献 1. S. Battaglioni, D. Benjamin, M. Walchli, T. Maier, M. N. Hall, mTOR substrate phosphorylation in growth control. Cell 185, 1814-1836 (2022). 2. A. Gonzalez, M. N. Hall, S. C. Lin, D. G. Hardie, AMPK and TOR: The Yin and Yang of Cellular Nutrient Sensing and Growth Control. Cell metabolism 31, 472-492 (2020). 3. M. Li et al., Aldolase is a sensor for both low and high glucose, linking to AMPK and mTORC1. Cell Res, (2020). 4. J. M. Orozco et al., Dihydroxyacetone phosphate signals glucose availability to mTORC1. Nat Metab 2, 893-901 (2020). 5. M. Li et al., Transient Receptor Potential V Channels Are Essential for Glucose Sensing by Aldolase and AMPK. Cell metabolism 30, 508-524 e512 (2019). 6. C. S. Zhang et al., The lysosomal v-ATPase-Ragulator complex Is a common activator for AMPK and mTORC1, acting as a switch between catabolism and anabolism. Cell Metab. 20, 526-540 (2014). 7. L. Bar-Peled, L. D. Schweitzer, R. Zoncu, D. M. Sabatini, Ragulator is a GEF for the rag GTPases that signal amino acid levels to mTORC1. Cell 150, 1196-1208 (2012). 8. Y. Sancak et al., Ragulator-Rag complex targets mTORC1 to the lysosomal surface and is necessary for its activation by amino acids. Cell 141, 290-303 (2010). 9. D. M. Gwinn et al., AMPK phosphorylation of raptor mediates a metabolic checkpoint. Mol. Cell 30, 214-226 (2008). 10. K. Inoki, T. Zhu, K. L. Guan, TSC2 mediates cellular energy response to control cell growth and survival. Cell 115, 577-590 (2003). 11. I. Yoon et al., Glucose-dependent control of leucine metabolism by leucyl-tRNA synthetase 1. Science 367, 205-210 (2020). 12. X. Dai et al., AMPK-dependent phosphorylation of the GATOR2 component WDR24 suppresses glucose-mediated mTORC1 activation. Nat Metab, (2023). 13. A. Kalender et al., Metformin, independent of AMPK, inhibits mTORC1 in a rag GTPase-dependent manner. Cell Metab. 11, 390-401 (2010). 14. A. Efeyan et al., Regulation of mTORC1 by the Rag GTPases is necessary for neonatal autophagy and survival. Nature 493, 679-683 (2013). 15. J. L. Van Nostrand et al., AMPK regulation of Raptor and TSC2 mediate metformin effects on transcriptional control of anabolism and inflammation. Genes Dev 34, 1330-1344 (2020). 16. C. S. Zhang et al., Fructose-1,6-bisphosphate and aldolase mediate glucose sensing by AMPK. Nature 548, 112-116 (2017). 17. B. Angarola, S. M. Ferguson, Weak membrane interactions allow Rheb to activate mTORC1 signaling without major lysosome enrichment. Mol Biol Cell 30, 2750-2760 (2019). (可上下滑动阅览) 本文转载自公众号“BioArt” 中国生物物理学会官方订阅号,为BSC会员及生物物理领域专业人士服务。 投稿及授权请联系:[email protected]。 原标题:《【科技前沿】Life Metabolism | 林圣彩课题组解析低糖条件下mTORC1被抑制的层次性—葡萄糖调控代谢平衡的自主性》 阅读原文 |
【本文地址】
今日新闻 |
点击排行 |
|
推荐新闻 |
图片新闻 |
|
专题文章 |