| 黄芪甲苷新型给药系统的研究进展 | 您所在的位置:网站首页 › 黄芪甲苷皂苷的功效与作用 › 黄芪甲苷新型给药系统的研究进展 |
黄芪甲苷新型给药系统的研究进展
|
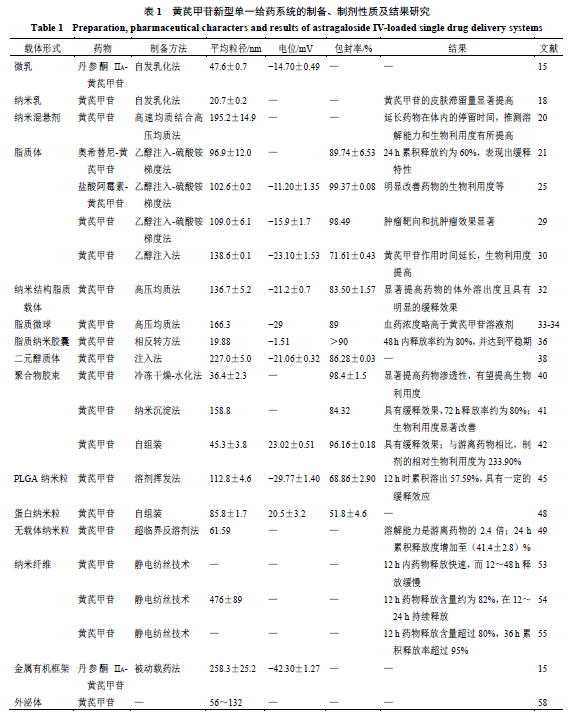
1黄芪甲苷单一给药系统 1.1 微乳与纳米乳 微乳是由水相、油相和乳化剂混合后自发形成的透明且热力学稳定的胶体体系,可用于亲脂性药物的递送,改善其溶解度[14]。李霞等[15]将微乳作为载体,构建了丹参酮IIA-黄芪甲苷微乳。在细胞实验中,药物质量浓度为15.6~250.0 μg/mL时,丹参酮ⅡA-黄芪甲苷微乳处理的小鼠血管内皮bEnd.3细胞存活率可达80%,而在质量浓度为500 μg/mL时,对小鼠肝癌H22细胞产生了明显抑制作用。 根据乳滴的粒径大小,微乳可分为亚微乳和纳米乳,其中纳米乳粒径为10~200 nm,稳定性和生物利用度较高[16]。郁梅[17]利用伪三元相图法优化了黄芪甲苷纳米乳处方,最终确定处方比例为卵磷脂-聚山梨酯80-无水乙醇-肉豆蔻酸异丙酯-水为4.8∶19.2∶12.0∶4.0∶60.0,为后续药理学和药动学研究奠定了基础。陈筱瑜等[18]以平均粒径、多分散指数和载药量为指标,采用单纯形网格法优化黄芪甲苷纳米乳处方。透皮实验发现,该纳米乳的皮肤滞留量是黄芪甲苷混悬水溶液的8.8倍,表明纳米乳能有效提高黄芪甲苷的皮肤滞留量,延缓皮肤光老化。 1.2 纳米混悬剂 纳米混悬剂是将药物分散于液体形成的胶态分散体系。由于较大的表面积和较小的粒径,纳米混悬剂可提高药物的溶出度和生物利用度[19]。姜佳琦等[20]利用高压均质结合高速均质法制备了黄芪甲苷纳米混悬剂。在药效学实验中,黄芪甲苷纳米混悬剂抗胃黏膜损伤作用优于原料药,其原因可能是纳米混悬剂易于透过黏膜屏障及易黏附于胃黏膜,延长了药物在体内的停留时间。 1.3脂质载体 1.3.1脂质体脂质体是由类脂质双分子定向排列而成的微型泡囊体,能增加药物在靶组织中的蓄积量,实现药物控释等。贺艳[21]构建了奥希替尼-黄芪甲苷共载脂质体,透射电镜观察呈球形结构,并具有较好的稳定性和明显的缓释作用,共载脂质体可显著抑制人肺腺癌NCI-H1975细胞和奥希替尼耐药NCI-H1975/OSIR细胞的增殖,及荷瘤小鼠肿瘤的生长。 阿霉素是抗肿瘤一线化疗药物,但存在多药耐药性问题[22]。研究发现,黄芪甲苷既能逆转肿瘤细胞对阿霉素的耐药性,还能产生协同治疗作用[23-24]。王成祥等[25]优化了共载阿霉素-黄芪甲苷脂质体处方工艺,测得阿霉素和黄芪甲苷的载药量分别为(4.62±0.02)%和(14.45±0.04)%。岳贵娟等[26]构建了阿霉素-黄芪甲苷共载脂质体,并评价了其对人乳腺癌阿霉素耐药MDA-MB-231/DOX细胞的逆转作用,结果表明游离阿霉素/黄芪甲苷的半抑制浓度(half maximal inhibitory concentration,IC50)为(0.277±0.003)μmol/L,而共载脂质体的IC50下降为(0.238±0.007)μmol/L,表明共载脂质体可有效逆转耐药细胞对阿霉素的耐药性。 与传统脂质体相比,配体修饰的脂质体具有更优的靶向性。由于叶酸受体在肿瘤细胞表面高表达,因此小分子叶酸可作为配体增强脂质体的肿瘤靶向性[27]。八精氨酸多肽是一种具有跨膜性的细胞穿透肽,可促进细胞摄取,实现药物高效递送[28]。基于此,Yue等[29]构建了叶酸和八精氨酸双修饰的新型靶向脂质体,用于共递送阿霉素和黄芪甲苷。这种设计提高了脂质体的肿瘤靶向能力和细胞摄取能力,显著抑制了MDA-MB-231/DOX细胞的增殖及体内肿瘤的生长。杨婉露[30]通过乙醇注入法构建了乳铁蛋白修饰的黄芪甲苷脂质体,表现出良好的缓释性能。药动学研究表明,与游离黄芪甲苷相比,修饰脂质体延长了黄芪甲苷在体内的循环时间,有效提高了生物利用度。 1.3.2纳米结构脂质载体纳米结构脂质载体是由固体脂质和液体脂质组成的脂质给药系统。除了具有药物溶解度增加、机体滞留时间延长等优点,还具有灵活的药物释放调节性[31]。陈敏燕等[32]发现,黄芪甲苷原料药在3 h内即达到了溶出平衡(累计释放率为31.4%),而构建的黄芪甲苷纳米结构脂质体的释放延长至36 h,累积释放率达72.8%。在药效学实验中,黄芪甲苷纳米结构脂质体增强了黄芪甲苷的抑瘤效果。 1.3.3脂质微球脂质微球是将药物溶于脂肪油,经磷脂膜包被,再乳化分散于水相制成的微粒分散体系。刘爱娜等[33-34]先用磷脂分子制成黄芪甲苷磷脂复合物,再制备了黄芪甲苷脂质微球注射液,结果发现磷脂用量为1.2%时,黄芪甲苷脂质微球的包封率达到80%以上,黄芪甲苷脂质微球在40℃避光放置10 d、4 ℃避光放置6个月均稳定。 1.3.4脂质纳米胶囊脂质纳米胶囊是由“核”油相和“壳”表面活性剂组成的新型系统[35]。Sun等[36]制备了粒径为19.88、49.39、92.89 nm的黄芪甲苷脂质纳米胶囊,用于老年性黄斑变性治疗,结果发现,不同粒径的黄芪甲苷脂质纳米胶囊在48 h内药物释放率均达到80%,但粒径最小的脂质纳米胶囊治疗作用最强,能将细胞凋亡率从对照组的5.12%降至0.53%,并可保护视网膜的形态和功能。 1.3.5二元醇质体醇质体是一种含有高浓度低分子醇,呈囊泡结构的给药载体。与之不同的是,二元醇质体还含有胆固醇和赋予脂质双层膜弹性的增塑剂,能增加药物透皮深度和皮肤内的药物滞留量[37]。吴少媛等[38]采用星点设计-响应面法优化了黄芪甲苷二元醇质体处方,结果发现黄芪甲苷二元醇质体呈球形或类球形,在4 ℃稳定性良好。 1.4 聚合物胶束 聚合物胶束是由高分子材料组装而成的两亲性聚合物,可负载疏水性药物,以增强药物稳定性和主动靶向性,并降低药物不良反应[39]。黄昭峰等[40]将Pluronic F127和D-α-维生素E聚乙二醇琥珀酸酯形成的复合胶束为载体,构建了黄芪甲苷纳米胶束,在人结直肠腺癌Caco-2细胞单层渗透性实验中,黄芪甲苷原料药易被外排,而黄芪甲苷纳米胶束能促进药物吸收,减少药物外排。杨珂等[41]将黄芪甲苷负载于三苯基膦修饰的聚乙二醇-聚丙交酯乙交酯纳米胶束中,构建了线粒体靶向的黄芪甲苷胶束,并考察了药物的释放特性和治疗作用。发现黄芪甲苷靶向胶束在72 h释放率达到80%,实现“心脏-线粒体”的双重靶向,提高了黄芪甲苷的生物利用度和心脏保护活性。Xi等[42]制备了阿仑膦酸盐修饰的黄芪甲苷骨靶向胶束,药动学结果显示,与游离黄芪甲苷相比,骨靶向胶束的相对生物利用度提高至233.9%。此外,骨靶向胶束具有良好的骨组织靶向能力,且能降低血清骨代谢相关指标水平,恢复骨微结构,显示出优异的骨质疏松症治疗作用。 1.5纳米粒 1.5.1聚乳酸羟基乙酸共聚物[poly(D,L-lactide- co-glycolic acid),PLGA] 纳米粒质量源于设计(quality by design,QbD)是通过药品的设计与研发来预测确定药品质量来达到优化药物输送系统效果的一种方法[43]。PLGA是一种具有生物降解性、安全性与生物相容性的高分子聚合物,可形成纳米粒延长药物的作用时间,增强药物稳定性等[44]。李姿锐等[45]基于QbD理念,通过乳化溶剂挥发法制备了黄芪甲苷纳米粒。研究发现其体外释药行为符合Riger-Peppas释药方程模型,有望提高对缺血性心脏病的疗效。 1.5.2 蛋白纳米粒自然界中存在大量的植物蛋白,部分蛋白如提取过程中的中药蛋白可自发组装形成纳米颗粒[46-47]。Zhou等[48]研究发现,甘草经提取后可形成粒径为(74.1±0.7)nm的蛋白纳米粒,可作为天然药物载体。因此研究者进一步构建了黄芪甲苷蛋白纳米粒,发现其粒径与甘草蛋白纳米粒接近,使黄芪甲苷的溶解度提高了5倍。 1.5.3无载体纳米粒Chen等[49]基于超临界反溶剂法制备了无载体黄芪甲苷纳米粒,纳米粒中药物的状态由结晶形式变为无定形形式。药物释放研究表明,无载体黄芪甲苷纳米粒的释放度明显提高,可能是由于粒径减小和结晶度改变所致。体外抗肿瘤实验发现,黄芪甲苷纳米粒比游离药物表现出更有效的细胞增殖抑制作用。 1.6 静电纺丝纳米纤维 静电纺丝是近年来制备纳米纤维材料的一种新技术,已被广泛应用于各大领域,尤其是生物医学工程和药物传递[50]。丝素蛋白是从蚕丝中提取的天然蛋白,具有良好的生物相容性和生物降解性[51]。明胶是一种天然可降解的水溶性蛋白质,因其降解速度快而应用于生物医用领域[52]。单颖慧[53]以丝素蛋白和明胶为载体,利用静电纺丝技术制备了黄芪甲苷纳米纤维敷料。该纳米纤维敷料可抑制成纤维细胞中α平滑肌肌动蛋白的表达,抑制疤痕增生。Shan等[54]优化了丝素蛋白和明胶的比例25∶75,制备的黄芪甲苷静电纺纳米纤维可显著促进细胞黏附和增殖,加速伤口愈合,抑制体内瘢痕形成。在此基础上,Zhang等[55]进一步研究发现,黄芪甲苷静电纺纳米纤维能促进伤口愈合,并可通过调节胶原蛋白的排列、促进血管生成、增加伤口免疫功能而抑制瘢痕形成。 1.7 金属有机骨架 金属有机骨架是一类二维或三维多孔晶体材料,具有多孔结构和均匀催化位点,可实现多种药物的负载[56]。李霞等[15]制备了丹参酮IIA-黄芪甲苷金属有机骨架,并研究其对血管内皮细胞、T淋巴细胞和肝癌细胞增殖能力的影响,结果发现丹参酮IIA-黄芪甲苷金属有机骨架3.9 μg/mL时,可显著抑制bEnd.3细胞的增殖,而在3.9~62.5 μg/mL,可促进小鼠T细胞CTLL-2细胞的生长。 1.8外泌体 外泌体是由细胞分泌的一种生物细胞外囊泡,直径约为50 nm。作为一种内源性天然载体,外泌体具有优异生物相容性、渗透性和低毒性,可用于药物和基因的传递[57]。Zou等[58]制备了内皮祖细胞衍生的黄芪甲苷外泌体,用于改善糖尿病并促进血管生成,细胞染色结果表明,高糖诱导的人脐静脉内皮HUVEC细胞能有效摄取黄芪甲苷外泌体。此外,黄芪甲苷外泌体还能减轻细胞损伤作用,并促进血管生长相关蛋白的表达。 黄芪甲苷新型单一给药系统的制备、性质及结果见表1。
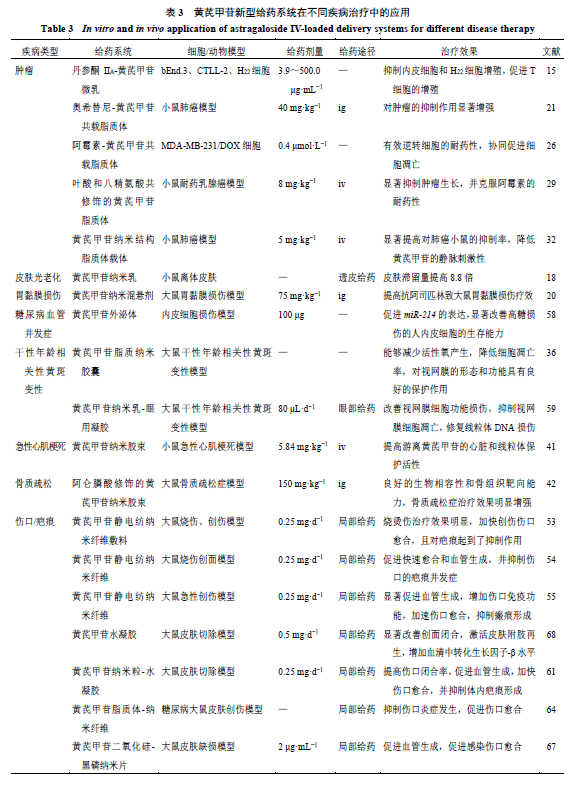
2 黄芪甲苷复合给药系统 2.1 纳米乳-凝胶 凝胶可增加制剂黏度和生物黏附性,从而延长药物在眼部的停滞时间,提高疗效。许凯[59]将纳米乳作为黄芪甲苷的核心载体,构建了黄芪甲苷纳米乳-眼用凝胶,观察其对大鼠干性年龄相关性黄斑变性(age-related macular degeneration,AMD)眼病的保护作用,结果发现黄芪甲苷纳米乳-眼用凝胶可有效保护干性AMD大鼠的视网膜,改善视网膜功能和病理组织损伤,并抑制视网膜细胞的凋亡,修复线粒体DNA损伤。 2.2 纳米粒-水凝胶 Chen等[60]首先采用疏水自组装法制备了黄芪甲苷纳米粒,再将其与金纳米棒负载于由聚乙二醇二丙烯酸酯、4-乙烯基苯硼酸和硫醇透明质酸组成的水凝胶中,体外研究表明,该凝胶系统表现出与天然心脏相似的导电性,并具有良好的药物释放特性。体内研究发现,黄芪甲苷纳米粒-水凝胶有效抑制了大鼠心肌梗死后的左心室重塑和心肌功能障碍,并促进了梗死边缘血管生成,减少细胞凋亡,增加间隙连接蛋白43的表达。 2.3 固体脂质纳米粒-水凝胶 基于固体脂质纳米粒的药物高渗透性和药物缓释性优势,Chen等[61]制备了新型固体脂质纳米粒-水凝胶来递送黄芪甲苷。在48 h时,固体脂质纳米粒和固体脂质纳米粒-水凝胶中黄芪甲苷累积释放率分别为80%和70%,表明水凝胶有效延缓了药物的释放。在体内研究中,与黄芪甲苷固体脂质纳米粒相比,固体脂质纳米粒-水凝胶复合系统显著促进了伤口愈合,并抑制了瘢痕形成。 2.4 脂质体-静电纺丝纳米纤维 静电纺丝纳米纤维可促进细胞迁移和黏附[62],因此常用于伤口愈合。目前,静电纺丝纳米纤维与其他制剂相结合是研究的热点[63]。Yue等[64]构建了荷载黄芪甲苷脂质体的黄芪多糖/聚乙烯醇纳米纤维膜。伤口愈合实验发现,术后第15天,空白载体黄芪多糖/聚乙烯醇纳米纤维膜的伤口愈合面积为(83.8 ± 11.9)%,而荷载黄芪甲苷脂质体的黄芪多糖/聚乙烯醇纳米纤维膜的伤口愈合面积达到(94.5 ± 6.1)%,表明静电纺丝纳米纤维膜与脂质体结合能促进黄芪甲苷的局部和持续递送,提高治疗效果。 2.5 介孔二氧化硅-黑磷纳米片 介孔二氧化硅纳米粒因其有序的孔道、较大的比表面积、可调节的尺寸等优点,广泛用于药物载体的开发[65]。黑磷是一种类石墨烯的二维层状材料,在电学、光学、机械领域和生物学有广阔的发展前景。通过超声剥离等方法制成的黑磷纳米片是一种新型二维纳米材料,具有优良的生物降解性和光热特性[66]。Liu等[67]将负载黄芪甲苷的介孔硅纳米粒与黑磷纳米片有机结合,构建了新型黄芪甲苷二氧化硅-黑磷纳米片。该体系对大肠杆菌和金黄色葡萄球菌的抗菌率分别高达99.58%和99.13%。体内伤口愈合实验发现,第7天时,黄芪甲苷二氧化硅-黑磷纳米片处理的伤口面积为56.3%,而第10天减少到12.5%,在所有实验组中疗效最佳。 黄芪甲苷复合给药系统的制备、性质及结果见表2。部分黄芪甲苷单一及复合新型给药系统进行了体内外药效学研究,证实了新型制剂的优势,具体结果见表3。
3 结语与展望 通过对近年来黄芪甲苷新型给药系统(新型制剂的构建、药物释放、靶向给药和治疗作用)进行综述,发现黄芪甲苷给药系统具有理想的制剂学性质,提高了黄芪甲苷的成药性,并在肿瘤、创伤、急性心肌梗死、骨质疏松、年龄相关性黄斑变性等多种疾病显示出良好的治疗效果,但仍有许多关键问题需要解决,以进一步提高黄芪甲苷新型制剂的治疗效率,并加快落地转化。 3.1 开发“药辅合一”型给药系统 “药辅合一”是中药制剂的用药经验与哲学智慧,可指导现代制剂的设计。Jin等[69]以三七皂苷为稳定剂,制备了“药辅合一”型灯盏花素纳米混悬剂,研究发现其抗血小板聚集活性显著高于传统纳米混悬剂(稳定剂为聚氧乙烯氢化蓖麻油),提示三七皂苷和灯盏花素可能产生了协同效应。此外,甘草酸[70]、绞股蓝皂苷[71]和川芎油[72]等中药有效成分/有效部位也作为辅料用于新型制剂的构建。然而,基于该理念的黄芪甲苷给药系统鲜有报道。因此,可利用中药的“药辅”双重作用,开发“药辅合一”型给药系统,用于黄芪甲苷的传递。 3.2 构建多药联合的精准给药系统 研究表明,单一药物的治疗作用往往欠佳,而多药联合可实现较为满意的治疗效果[73]。联合给药已成为当前研究热点,也是临床疾病治疗的主要趋势。目前,已有黄芪甲苷与其他药物(如丹参酮IIA、阿霉素、奥希替尼)联用的新型制剂报道[15,21,25],但研究还较少。实际上,不同药物干预的靶点和作用机制不尽相同,这就要求药物应在相应的“位置”(如作用于不同的细胞或细胞器)“各司其职”。而只有精心的载体设计,药物才能精确地传递至靶标,达到最佳协同效果。因此,今后的研究还需合理设计给药系统以精准递送机制不同的多种药物。 3.3 提高给药系统的“渗透”效率 尽管黄芪甲苷给药系统在动物模型取得了满意的效果,但由于人体疾病形成机制复杂,导致动物的治疗作用并不能真实反映患者的结果。如纳米药物到达肿瘤部位需同时克服多种生物障碍[74],限制 了纳米系统在肿瘤组织的富集。研究数据表明,只有0.7%的纳米药物能到达肿瘤部位,其中仅有0.001 4%能穿透肿瘤细胞[75],这主要是由于递送系统的低肿瘤靶向性和不足的穿透率导致。而目前的黄芪甲苷给药系统往往忽视了该问题,因此迫切需要进一步开发兼具“主动靶向”和“高渗透”特性的高递送效率传递系统。 3.4 促进给药系统的临床转化 较传统制剂而言,黄芪甲苷新型给药系统的处方和制备通常较为复杂,为批量生产带来困难。因此,减少辅料的种类及用量,并简化制备工艺显得尤为重要。与此同时,新型给药系统的结构、粒径、多分散性、表面性质和稳定性等对其药动学性质和体内治疗效果有重要影响[12],这要求制备过程应精确且可重复,严格进行质量控制,以确保黄芪甲苷给药系统性能的一致性。更重要的是,制剂的安全性是临床转化的首要前提,故还需重点研究辅料的过敏反应、药物相互作用、作用机制和生物安全性等。 综上,新型给药系统的发展为克服黄芪甲苷的缺陷提供了有利途径。随着中药学、中药制剂学、药剂学、材料学、药理学、生物学等多学科交叉研究,黄芪甲苷新型给药系统将在未来大放异彩,为守护人类生命健康做出重要贡献。 利益冲突所有作者均声明不存在利益冲突 参考文献(略) 来 源:罗开沛,江英杰,徐梦涵,杨文博,杨 露.黄芪甲苷新型给药系统的研究进展 [J]. 中草药, 2023, 54(18):6118-6127.返回搜狐,查看更多 |
【本文地址】