| 初高中化学知识衔接 | 您所在的位置:网站首页 › 高中化学部分酸、碱和盐的溶解性表背诵规律 › 初高中化学知识衔接 |
初高中化学知识衔接
|
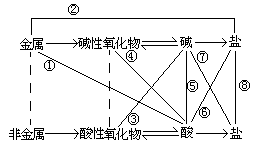
盐的物理性质: ⑴大多数的盐是白色固体 ⑵溶解性:钾钠铵盐都可溶,硝酸盐遇水影无踪, 硫酸盐不溶硫酸钡,氯化物不溶氯化银。 酸溶易,碱难溶,碳酸盐只溶钾钠铵 几种常见的盐:纯碱又称为苏达Na 2 CO 3 ,为白色粉末,易溶于水,常用作食品工业的添加剂,也常用于造纸,印刷等化工业,是很重要的工业原料。NaHCO 3 俗名小苏达,也常用于食品工业作添加剂。它们都能和酸反应产生二氧化碳。CuSO 4 ·5H 2 O俗名蓝矾或胆矾,蓝色晶体,易溶于水。常用作农药CuSO 4 +5H 2 O=CuSO 4 ·5H 2 O固体由白色变成蓝色,常用这个反应来鉴定水的存在。 BaSO 4 俗名重晶石,白色粉末,难溶于水,也难溶于稀盐酸等强酸,医院常用它来对病人进行胃肠的X射线检查,即俗称的“钡餐”。 FeSO 4 ·7H 2 O俗称绿矾,绿色晶体,易溶于水。 KAl(SO 4 ) 2 ·12H 2 O俗称明矾,能够作为净水剂除去水中悬浮的杂质。 氨盐常用作氮肥。氨盐都能跟碱反应产生氨气,故氮肥不能和草木灰同时使用。(草木灰的主要成份是K 2 CO 3 ) (5)氧化物: a.酸性氧化物:(又称为酸酐)能与碱反应生成盐和水的氧化物。 例:CO 2 、SO 2 、SO 3 等。 b.碱性氧化物:能与酸反应生成盐和水的氧化物。 例:CaO、Na 2 O 、CuO等。 c.两性氧化物:既能与强酸反应又能与强碱反应生成盐和水的氧化物,例:Al 2 O 3 d.不成盐氧化物:既不能与酸,又不能与碱反应生成盐和水的氧化物。 例:CO、NO等。 2. 酸、碱、盐之间的相互转化关系和转化规律
两条横线
注意: 1.在常见的酸性氧化物中,除二氧化硅(SiO 2 )外均可直接和水反应生成对应的含氧酸。 如: P 2 O 5 + H 2 O(热)= 2H 3 PO 4 SO 3 +H 2 O=H 2 SO 4 N 2 O 5 +H 2 O=2HNO 3 2.在常见的碱性氧化物中,只有K 2 O、Na 2 O、BaO、 CaO等少数几种强碱的碱性氧化物能跟水直接化合生成可溶性碱。 CaO+H 2 O=Ca(OH) 2 Na 2 O+H 2 O= 2NaOH BaO+H 2 O=Ba(OH) 2 3.酸和碱生成盐和水的反应叫做酸碱中和反应。酸和碱的反应中应至少有一个是可溶的。多元酸和碱的反应是分步进行的,控制酸和碱的比例不同即可得到正盐或酸式盐,如CO 2 和碱的反应,碱过量时生成正盐,碱不足时生成酸式盐。 CO 2 + 2NaOH = Na 2 CO 3 +H 2 O (CO 2 不足量) CO 2 + NaOH = NaHCO 3 (CO 2 过量) 2.四条纵线 金属+非金属→ 无氧酸盐→碱性氧化物+酸性氧化物→含氧酸盐 碱+酸→盐和水→盐+盐→新盐+新盐 注意: ①这里的非金属不包括氢和氧。 如:Cu+ Cl 2 CuCl 2 2Na+ Cl 2 = 2NaCl Fe + S FeS 一般来说金属性和非金属性越强反应越容易发生,反之越不容易。 ②碱性氧化物和酸性氧化物的反应,如对应的含氧酸酸性越强和对应的碱碱性越强,则反应越容易。如:Na 2 O +CO 2 = Na 2 CO 3 常温下就可以发生,而CaO和SiO 2 生成CaSiO 3 要在高温下才能进行。 CaO+SiO 2 CaSiO 3 ③盐和盐的反应要满足复分解反应发生的条件,即生成物中有沉淀、气体或有难电离的物质产生,但反应物必须均可溶(或生成物比反应物更难溶) 如: Na 2 CO 3 + H 2 SO 4 = Na 2 SO 4 +H 2 O+CO 2 ↑ BaCl 2 + H 2 SO 4 = BaSO 4 ↓+2HCl 2NaOH + H 2 SO 4 = Na 2 SO 4 +2H 2 O 3.四条交叉线 碱性氧化物+酸→盐和水 酸性氧化物+碱→盐和水 碱+盐→新盐+新碱 酸+盐→新酸+新盐 ①碱性氧化物和强酸反应, 如Fe 2 O 3 + 3H 2 SO 4 (稀) = Fe 2 (SO 4 ) 3 +3H 2 O ②酸性氧化物和强碱反应,注意必须是强碱。如:CO 2 + 2NaOH = Na 2 CO 3 +H 2 O ③碱和盐的反应应满足反应物两者皆可溶,而生成物应满足复分解反应发生的条件。如 (NH 4 ) 2 SO 4 + Ca(OH) 2 = CaSO 4 +2NH 3 ↑+2H 2 O ④酸和盐的反应比较复杂,共有四种情况 a.强酸和弱酸的盐反应可生成弱酸(即俗称的强酸可以制弱酸) 如:FeS + H 2 SO 4 (稀) = FeSO 4 + H 2 S↑ Na 2 CO 3 + H 2 SO 4 = Na 2 SO 4 +H 2 O+CO 2 ↑ Na 2 SO 3 +H 2 SO 4 = Na 2 SO 4 +H 2 O+SO 2 ↑ b.加热条件下,高沸点酸(浓溶液)和低沸点酸的盐(固体)可反应生成低沸点的酸(即俗称的难挥发的酸制易挥发的酸) 如:NaCl (固) + H 2 SO 4 (浓) NaHSO 4 +HCl↑ 2NaCl(固) + H 2 SO 4 (浓) Na 2 SO 4 +2HCl↑ NaNO 3 (固) + H 2 SO 4 (浓) NaHSO 4 +HNO 3 ↑ c.强酸盐的稀溶液和酸(强酸或弱酸)若能生成难溶于强酸的盐,则反应可以进行。如: H 2 S+ CuSO 4 = CuS↓+H 2 SO 4 d.多元弱酸能和该弱酸的正盐反应生成酸式盐。如 Na 2 CO 3 + CO 2 + H 2 O= 2NaHCO 3 Na 2 SO 3 +SO 2 + H 2 O= 2NaHSO 3 4.两条弯线 金属+盐→新金属+新盐 金属+酸→盐+氢气 ①一般是位于金属活动性顺序表前面的金属能置换出排在后面的金属,且盐溶液必须是可溶的。但很活泼的金属(如钾、钙、钠)与盐的反应,并不能把金属置换出来,而是先与水反应生成碱,再和盐起复分解反应。如: 钠与CuSO 4 溶液反应, 2Na+2H 2 O= 2NaOH+H 2 ↑ 2NaOH+CuSO 4 = Cu(OH) 2 ↓ +2H 2 O ②金属和酸反应,应满足金属排在金属活动性顺序表的氢以前,且酸应非强氧化性酸。如: 2Al + 3H 2 SO 4 = Al 2 (SO 4 ) 3 +3H 2 ↑ 【例题解析】 例1:稀释浓硫酸时应如何操作?为什么? 解析:稀释浓硫酸时,要沿着玻璃棒将浓硫酸缓慢地加入盛水的烧杯中,并同时搅拌以使混合均匀,并且散热。而不能将水加入到浓硫酸中,因为浓硫酸稀释是个放热过程,放出的热会使水沸腾而迸濺出来伤人。 例2:用玻璃棒沾取浓硫酸滴在纸片上,观察有什么现象?表现了浓硫酸的什么性质?实验室里可以用浓硫酸来干燥氯气、氢气等气体,是利用浓硫酸的什么性质? 解:观察到纸片变黒色。表现了浓硫酸的脱水性和强氧化性;利用了浓硫酸的吸水性。 例3:用一种试剂就能区分盐酸、食盐溶液、澄清的石灰水,这种试剂是 A.酚酞 B.石蕊试液 C.氯化铁溶液 D.氢氧化钠溶液 答案:B 例4:下表是某指示剂在一定的PH范围内所显示的颜色: 颜色 红 橙 绿 蓝 紫 PH范围 1~3 4~5 6~7 8~10 11~14 向滴有少量该指示剂的NaOH溶液中,逐滴加入稀盐酸,出现的颜色变化是( ) A.由蓝到绿 B.由绿到蓝 C.由橙到绿 D.由红到紫 答案:A 【强化训练】 一、选择题 1.下列物质按氧化物、酸、碱、盐、混合物的顺序排列的是( ) A.水、碳酸、硫酸铁、碳酸钠、空气 B.五氧化二磷、乙酸、氢氧化钙、硫酸镁、胆矾 C.氯酸钾、硝酸、氢氧化铜、硫酸亚铁、天然气 D.氧化铁、磷酸、氢氧化钾、氯化钠、石油 2.下列物质的变化,必须通过盐溶液才能反应实现的是( ) A.CuO CuCl 2 B.K 2 SO 4 KCl C.CaCO 3 CaCl 2 D.Mg(OH) 2 MgCl 2 3.甲、乙、丙、丁分别是氢氧化钙溶液、硝酸钾溶液、碳酸钠溶液、盐酸中的一种。已知甲和丙可以反应,甲和丁也可以反应,则下列说法正确的是 A. 甲一定是氢氧化钙溶液 B. 乙一定是硝酸钾溶液 C. 丙不可能是碳酸钠溶液 D. 丁只能是盐酸溶液 4.下列酸性氧化物和水化物的关系不对应的是( ) A.SiO 2 H 4 SiO 4 B.Cl 2 O HClO 4 C.Mn 2 O 7 HMnO 4 D.N 2 O 5 HNO 3 5.某物质有如下结构:R-O-H,则关于该物质性质的推测正确的是( ) A.一定呈碱性 B.一定呈酸性 C.可能呈碱性也可能呈酸性 D.若R为活泼金属,则为强碱 6.下列酸性氧化物和碱反应时,反应速率最慢的是( ) A.二氧化碳气体通入氨水中 B.二氧化硫气体通入澄清石灰水中 C.五氧化三磷投入溶液中 D.二氧化硅投入烧碱溶液中 7.下列碱和盐的反应能发生的是( ) A.氯化铜溶液中加入氢氧化铁 B.硝酸铝溶液中加入氨水 C.氢氧化钾溶液中加入硫化铜 D. 碳酸氨中加入氢氧化钾 8.已知三种酸的酸性HA >HB> HC则下列反应不正确的是( ) A.HA+ NaC=HC+ NaA B.HC+ NaB=HB+ NaC C.HB+ NaC=HC+ NaB D.HA+ NaB=HB+ NaA 9.下列反应能发生的是( ) A.氯化钠溶液和稀硫酸 B.氯化钠固体和浓磷酸共热 C.硝酸钠固体和浓盐酸 D.亚硫酸钠固体和中等浓度硫酸 10.已知金属硫化物和溶解性比较复杂,如K 2 S、Na 2 S为可溶性硫化物,FeS 、ZnS为难溶于水的硫化物,CuS 、Ag 2 S为既难溶于水又难溶于强酸的硫化物。下列硫化物和酸的反应不正确的是 A. Na 2 S+2HCl=H 2 S↑+2NaCl B. FeSO 4 + H 2 S=FeS↓+ H 2 SO 4 C.CuSO 4 + H 2 S= CuS↓ + H 2 SO 4 D. ZnS+2HCl=H 2 S↑+ ZnCl 2 【参考答案】 1.D 2.B 3.B 4.B 5.CD 6.D 7.BD 8.B 9.BD 10.B 准高一必看 ,了解更多学习内容 (必修一各版本知识总结、思维导图、单元课件……你需要的都在这里) ▎编辑:化学姐 ▎标签:初中化学知识点 资料领取方式 电子版领取方式: 对话框回复“ 新高一”即可获得 ▼ ◆2021中考成绩很惨的, 是这10类学生! 现在的初一初二生务必警醒 ◆衡水中学发布的暑假温馨提示,震惊中学圈! ◆147页初中化学人教版上册化学讲义,暑假预习必备! ◆2021年新初三化学第一单元重难点知识+例题整理,学会开学不慌张! ◆资深老教师推荐:新初三化学生暑假预习必看的1-7单元学习课件,建议收藏 ◆新高一必看!初升高化学衔接教材+限时训练+配套实验 ◆初中化学上下册沪教版知识点整理,暑假预习专用~ ◆全了!九年级上册鲁教版化学知识点总结,聪明人都在背! ◆新初三必看!初中化学的必记四张表! ◆初中化学25个精华点,准初三党开学前要吃透! → 点击高中化学公众号头像进入后台,回复【新高一】领取资料返回搜狐,查看更多 |
【本文地址】