| 活性模板法合成互锁纳米碳结构 | 您所在的位置:网站首页 › 飞环锁结构 › 活性模板法合成互锁纳米碳结构 |
活性模板法合成互锁纳米碳结构
|
活性模板法合成互锁纳米碳结构
自1991年碳纳米管(carbon nanotubes,CNTs)被发现以来,CNTs凭借在导电性和机械性能等方面的出色表现已成为国际学术界的研究热点。事实上,碳纳米结构引人注目的光电性质与碳原子精确的三维空间排列密切相关。尽管石墨烯、富勒烯以及碳纳米管(CNTs)有着相似的局部键合环境(即仅由sp2杂化的碳原子构成),但却展现出截然不同的物理性质,究其原因就在于它们具有完全不同的拓扑结构。近年来,随着自下而上的有机合成策略的发展,多种全新的碳纳米结构(如CNTs的子结构,也称作碳纳米环和碳纳米带)被合成分离出来。而利用有机合成策略来制备具有独特拓扑结构的碳纳米材料变得更加引人瞩目,特别是机械互锁的结构。2019年,Itami团队使用硅栓的策略,首次成功地合成了由对位苯环组成的索烃分子和三叶结分子(图1A)。虽然该索烃和分子结在结构上和[n]环对苯撑分子([n]CPPs)相似,但它们独特的拓扑结构使其动态运动和光学特征与原始的[n]CPPs有所不同。 2006年,Leigh团队通过活性模板(active template, AT)法成功地制备了机械互锁分子(mechanically interlocked molecules, MIMs),并得到了广泛的应用。然而,对于具有辐射状π体系的大环分子(如CPPs)而言,将其应用于AT法中却存在一定的挑战,这是因为它们缺乏内在的功能导向基团。近日,美国俄勒冈大学的Ramesh Jasti教授(点击查看介绍)团队发展了一种新策略,将大环CPP的前驱体分子用做活性模板法中的反应底物,从而成功地构建了一系列由π-共轭单元组成的机械互锁的碳纳米结构(索烃以及轮烷型,图1B)。该方法的优势在于可构建具有不同结构的前驱体分子,例如非苯环芳香体、杂环甚至反芳香性分子。另外,如果环状结构中包含环己二烯单元和两个边侧的吡啶环,那么该结构还可以作为一个通用的活性模板来制备一系列π共轭的机械互锁结构(图1C)。相关成果于近日发表在ChemRxiv 上。
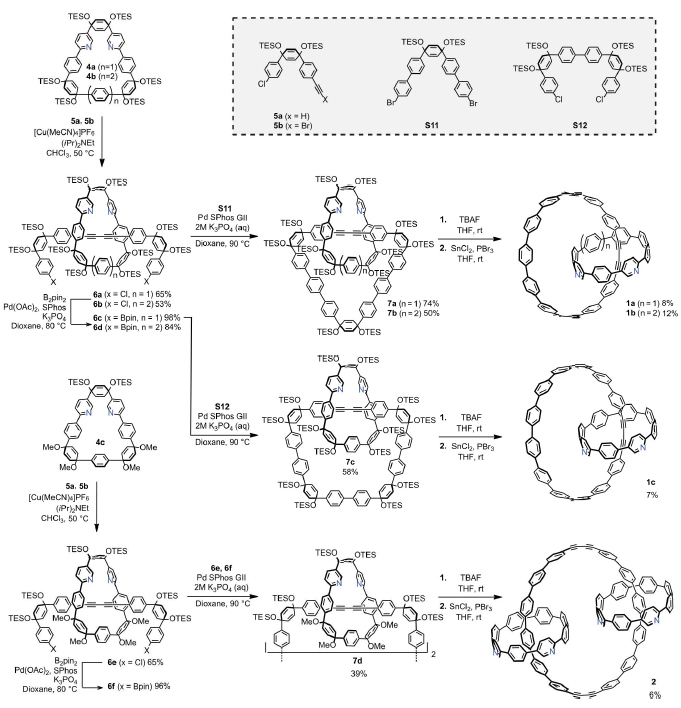
图1. A) 全苯环索烃分子和三叶结分子;B) 索烃分子结构1a-c, 2和[3]轮烷分子3;C)分子1a-c, 2和3的合成策略。图片来源:ChemRxiv 为了验证该方法的可行性,作者首先设计并合成了两个含吡啶的大环结构4a和4b(图2),以及常被用于合成CPP且带有炔基或炔溴的组分5a和5b。随后,4a和4b与2.5当量的5a和5b在Cu(I)的催化下进行AT-Cadiot-Chodkiewicz交叉偶联反应,分别以65%和53%的产率得到[2]轮烷分子6a和6b,后者经Miyaura硼化反应转化为相应的二硼酸酯6c和6d,接着在低浓度条件下与S11进行Suzuki-Miyaura偶联反应得到[2]索烃7a(产率74%)和7b(产率50%)。类似地,6c和S12在相似的条件下进行大环化反应,能以58%的产率得到[2]索烃7c。最后,作者采用Yamago等人发展的方法进行芳香化反应便可得到相应的1a、1b和1c。
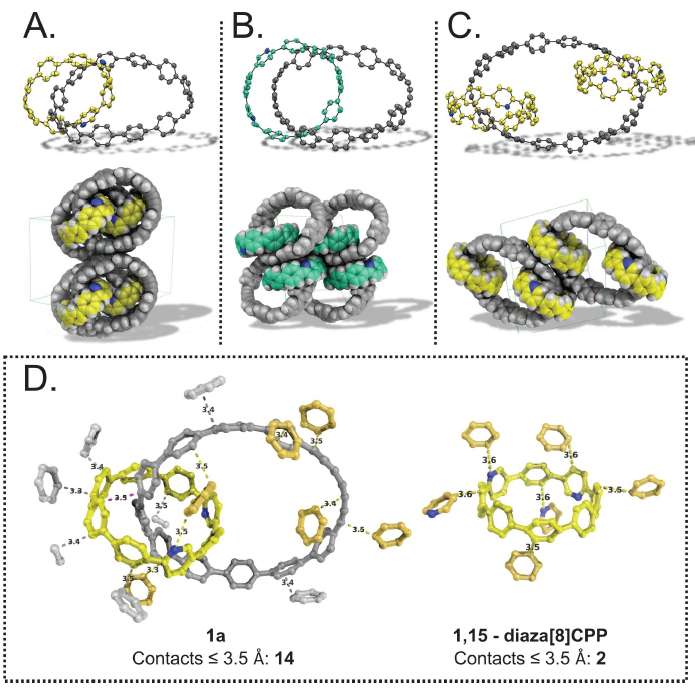
图2. 索烃1a-c和2的合成路径。图片来源:ChemRxiv 为了得到更高阶的互锁[3]索烃分子,6a和6在低浓度条件下进行Suzuki-Miyaura偶联反应,但是仅得到了一些复杂的低聚体。通过分析发现,两个大环上的TES基团间存在较大的空间阻力,因此更利于形成低聚物而不是环状产物。为了解决这个问题,作者使用模板大环分子4c制备了另外两个[2]轮烷分子6e和6f,其中TES基团被体积更小的甲氧基所替代。令人满意的是,随后的大环化反应可顺利进行,并以中等的产率(39%)得到[3]索烃7d,后者经芳香化便可生成分子2。需要指出的是,2是由[12+4]CPP(其中+4代表存在两个丁二炔单元)串连着两个氮杂[8]CPP组成的,这也是由全共轭成分组成的[3]索烃分子的首次报道。如图3所示,1a、1b和2的单晶结构清楚地确认了它们的索烃结构。
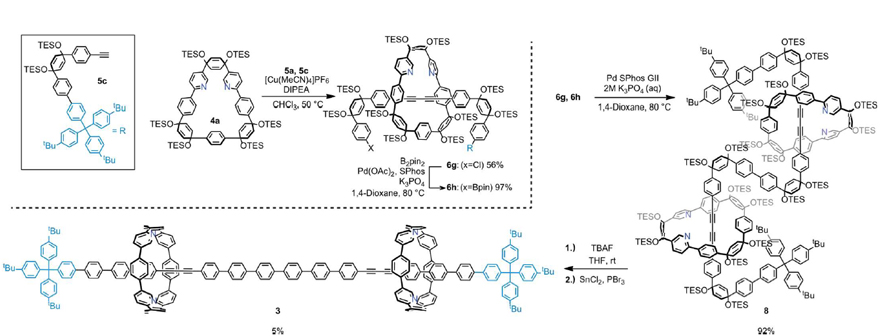
图3. 分子1a, 1b和2的晶体结构。图片来源:ChemRxiv 在成功合成索烃分子的经验上,作者推测类似于6a-6f的[2]轮烷前体也可被用作合成更高阶的全共轭轮烷分子([n]轮烷,n>2)的中间体。为此,作者合成了[2]轮烷6g和6h(图4),其中叔丁基取代的三苯基作为大位阻基团位于分子的末端。随后,6g和6h 通过Suzuki交叉偶联反应得到[3]轮烷分子8(产率:92%),后者经过芳香化反应便可得到全共轭组分构成的[3]轮烷分子3。值得注意的是,尽管分子3有14个未取代的苯环和两个间隔的丁二炔组分,但仍然具有非常好的溶解性,并可通过1H 和 13C NMR谱进行表征。
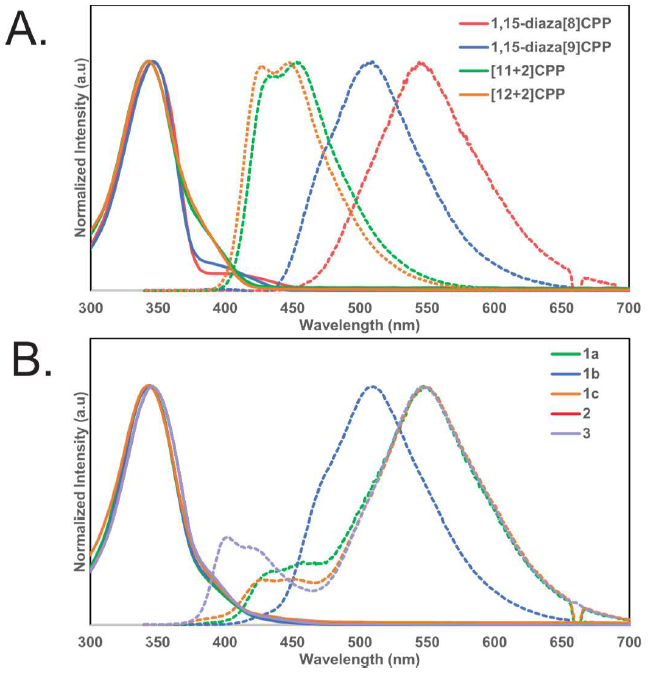
图4. [3]轮烷3的合成路径。图片来源:ChemRxiv 为了验证机械键合作用对这些分子光物理性质的影响,作者分别合成并且表征了氮杂[8]CPP、氮杂[9]CPP以及[11+2]CPP和[12+2]CPP。这些分子的光物理性质与其原始的CPPs分子基本一致。类似地,作者对分子1a-c、2和3进行了紫外-可见光吸收以及荧光光谱的表征。这些具有互锁结构的分子的紫外吸收与参照组的分子吸收展现出几乎相同的曲线,并且最大吸收峰位于345 nm左右。不同的是,机械互锁分子的发射曲线随着组分的不同而发生改变,其中1b的最强发射峰位于509 nm左右,而1a、1c、2和3的最强发射峰则在550 nm左右。
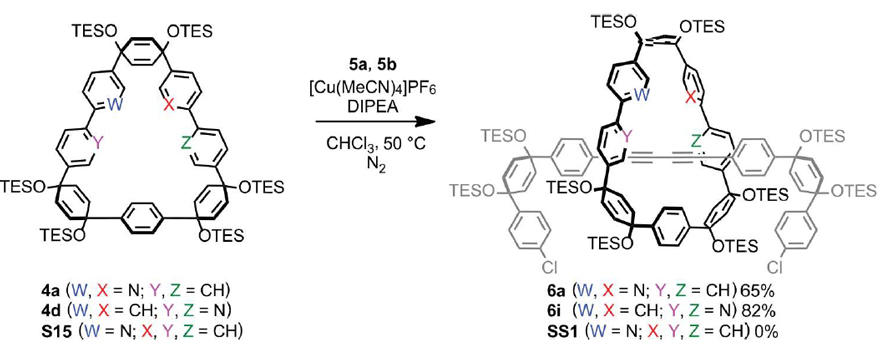
图5. A) 氮杂[n]CPPs (n= 8, 9)和[n+2]CPPs (n= 11, 12) (无互锁结构) 的紫外-可见光吸收(实线)以及发射光谱;B) 1a-c,2和3的紫外-可见光吸收(实线)以及发射光谱。图片来源:ChemRxiv 迄今为止,只有少量包含菲或者联吡啶单元的醚类大环可用AT法制备得到,究其原因就在于该方法对大环配体有较高的要求。相比之下,本文合成的大环配体4a和4b则显示出不同寻常的配位能力,因此作者想进一步了解这些分子与铜催化剂的相互作用,尤其是吡啶环的存在是否会影响该反应的活性。为了验证这个问题,作者设计并合成了另一个大环分子S15(图6),它与4a的唯一区别就在于少了一个吡啶环。有趣的是,随后进行的AT-CC反应发现产物中并没有互锁型分子的存在,这说明两个吡啶环共同存在时才能与铜离子在大环空腔内部有很好的配位作用。此外,为了探究配体的几何结构对AT法的影响,作者合成了大环4d(图6),它与4a的区别在于两个氮原子处在不同的位置。让人意外的是,4d在AT-CC反应中表现出的反应性能要优于4a,得到的产物6i产率高达82%。这表明双齿配体的结合模型可能是对更复杂/动态的相互作用的过度简化,同时也表明具有非典型配体结构的大环可能会比较有效地适用于AT法。但是,要想充分地了解这些非典型配体的本质特征还需要进一步的进行机理方面的调查研究。
图6. 大环配体4a,4d和S8进行AT-CC反应的对比。图片来源:ChemRxiv 总结 Ramesh Jasti教授报道了一种活性模版合成法,并利用该方法制备了一系列具有机械互锁结构的CPPs。这不仅极大地增加了拓扑纳米碳分子可进一步探索的结构空间,而且为制备更复杂的结构奠定了合成基础。虽然作者已经证实了这种方法对氮杂[8]CPP和[9]CPP前体的有效性,但他们预计,无论是较小还是较大的带有这些配体单元的大环都能有效地参与AT-CC反应,从而进一步分析环的尺寸对其性质的影响。此外,由于能较为简单地形成机械键,作者设想利用AT法可以制备更广泛的互锁结构,例如带有官能团甚至延展的聚合物材料。同时他们也期望,利用这种方法的通用性可以合成更多新型拓扑纳米碳结构。 原文(扫描或长按二维码,识别后直达原文页面,或点此查看原文):
Active Template Strategy for the Preparation of Interlocked Nanocarbons James H. May, Jeff M. Van Raden, Ruth L. Maust, Lev N. Zakharov, Ramesh Jasti ChemRxiv, 2022, DOI: 10.26434/chemrxiv-2022-qh5f3 导师介绍 Ramesh Jasti https://www.x-mol.com/university/faculty/3002 (本文由Finisher供稿) 如果篇首注明了授权来源,任何转载需获得来源方的许可!如果篇首未特别注明出处,本文版权属于 X-MOL ( x-mol.com ), 未经许可,谢绝转载! 点击分享 收藏 取消收藏 评论: 0 |
【本文地址】