| 一种药物中间体的合成方法及其在合成氯氟醚菌唑中的应用 | 您所在的位置:网站首页 › 酰氯反应条件 › 一种药物中间体的合成方法及其在合成氯氟醚菌唑中的应用 |
一种药物中间体的合成方法及其在合成氯氟醚菌唑中的应用
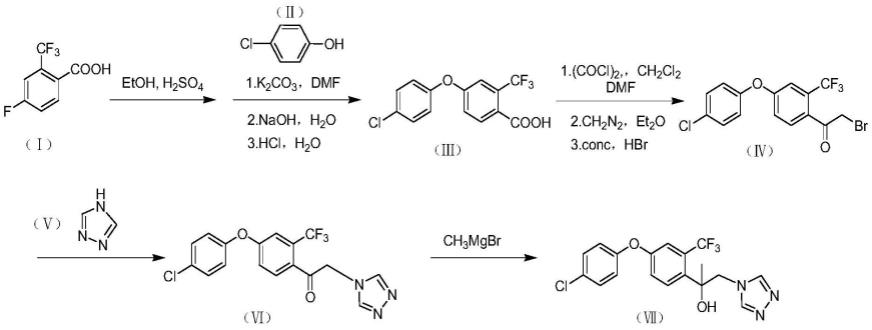 1.本发明属于药物合成领域,具体的涉及一种高效合成氯氟醚菌唑的药物中间体及合成氯氟醚菌唑药物的方法。 背景技术: 2.氯氟醚菌唑(2-[4-(4-氯苯氧基)-2-三氟甲基苯基]-1-[1,2,4]三唑-1-基丙-2-醇)是巴斯夫历时10余年、从4000多种候选活性分子中筛选而来的新型异丙醇三唑类杀菌剂。氯氟醚菌唑为脱甲基化抑制剂(dmi),通过阻止麦角甾醇的生物合成,导致细胞膜坍塌,抑制病菌细胞生长。国际杀菌剂抗性行动委员会(frac)将其归类为group 3中的g1亚组。氯氟醚菌唑能有效抑制孢子萌发、菌丝生长以及叶片表面真菌孢子的形成。其化合物中的异丙醇基团能使分子灵活旋转,从而与靶标紧密结合。[0003]研究表明,氯氟醚菌唑与靶标结合的强度平均比传统三唑类杀菌剂强100多倍。因此,该产品不仅表现出更加卓越的防效,而且还能抑制菌株转移,降低病菌突变,延缓抗性产生,是一款优秀的抗性管理工具。氯氟醚菌唑广谱、高效、速效,具有内吸性和保护、治疗、铲除作用;能较好地向顶传导,形成“叶内蓄水池”效应,提供稳定长效的保护作用,持效期长达21d。氯氟醚菌唑主要用于全球60多种作物,如谷物、玉米、水稻、马铃薯、大豆、果树、蔬菜、棉花、葡萄、油菜、咖啡以及观赏植物、草坪等,有效防治许多真菌病害,如小麦锈病、叶斑病、壳针孢菌引起的病害,水稻稻瘟病、纹枯病、穗腐病,由柱隔孢菌引起的大麦病害,由尾孢菌引起的玉米和大豆病害,链格孢菌引起的马铃薯和坚果树病害,苹果树黑星病,葡萄白粉病,甜菜褐斑病等。氯氟醚菌唑叶面喷雾、种子处理均可,具有优异的桶混灵活性。氯氟醚菌唑对作物安全,使用适期宽;药后很快被植物吸收,拥有较好的耐雨水冲刷和抗逆性。氯氟醚菌唑拥有较好的环境特性,先后获得欧盟、美国、澳洲等绿色、安全等级认证,符合现行全球农药管理的最高标准。其对哺乳动物无内分泌干扰作用,无致畸、致癌和生殖毒性,无神经毒性和遗传毒性;对无脊椎动物不敏感;对蜜蜂毒性较低,对蚯蚓无毒,对水生生物几乎无毒。其水溶性、挥发性均低,吸附力强,不会通过淋溶进入地下水。[0004]氯氟醚菌唑的制备方法文献及相关专利已有报道。存在的问题是:原料不易得、成本高,产率低。 技术实现要素: [0005]本发明的目的是提供一种药物中间体的合成方法及其在合成氯氟醚菌唑药物中的应用。[0006]本发明采用的技术方案如下:一种药物中间体的合成方法,所述药物中间体是2-溴-1-[4-(4-氯苯氧基)-2-三氟甲基苯基]乙酮,具有如(iv)所示的结构:[0007][0008]合成方法包括如下步骤:[0009]1)4-氟-2-(三氟甲基)苯甲酸,在浓硫酸存在的条件下,与乙醇(etoh)发生酯化反应,生成4-氟-2-(三氟甲基)苯甲酸乙酯;[0010]2)4-氟-2-(三氟甲基)苯甲酸乙酯与4-氯苯酚,在碱性条件下,以dmf为溶剂,先在120℃下搅拌反应5h,再于140℃下搅拌反应5h,反应结束后,冷却至室温,所得产物用二氯甲烷萃取,无水硫酸镁干燥,过滤,蒸发溶剂,得4-(4-氯苯氧基)-2-(三氟甲基)苯甲酸乙酯;[0011]进一步的,所述在碱性条件下,指在体系中加入碳酸钾。[0012]更进一步的,按摩尔比,4-氟-2-(三氟甲基)苯甲酸:4-氯苯酚:碳酸钾=1:1-2:1。[0013]3)4-(4-氯苯氧基)-2-(三氟甲基)苯甲酸乙酯,在碱性条件下,发生水解反应,将所得反应液经盐酸酸化处理,生成4-(4-氯苯氧基)-2-(三氟甲基)苯甲酸;[0014]进一步的,所述在碱性条件下,是指在氢氧化钠碱性条件下。[0015]4)4-(4-氯苯氧基)-2-(三氟甲基)苯甲酸与(cocl)2混合,以二氯甲烷作为溶剂,发生酰化反应后,生成4-(4-氯苯氧基)-2-(三氟甲基)苯甲酰氯;[0016]5)4-(4-氯苯氧基)-2-(三氟甲基)苯甲酰氯与重氮甲烷混合,在乙醚中反应生成4-(4-氯苯氧基)-2-(三氟甲基)苯甲酰重氮甲烷;[0017]6)4-(4-氯苯氧基)-2-(三氟甲基)苯甲酰重氮甲烷与浓缩氢溴酸发生歧化反应,生成2-溴-1-[4-(4-氯苯氧基)-2-三氟甲基苯基]乙酮。[0018]进一步的,上述的药物中间体的合成方法,4-氟-2-(三氟甲基)苯甲酸、4-氯苯酚、4-(4-氯苯氧基)-2-(三氟甲基)苯甲酸、(cocl)2、重氮甲烷、氢溴酸的摩尔比为1:1.0~2.0:1:1:1:1。[0019]本发明提供的药物中间体的合成方法在氯氟醚菌唑合成中的应用。[0020]一种氯氟醚菌唑合成方法包括如下步骤:[0021]1)4-氟-2-(三氟甲基)苯甲酸(i),在浓硫酸存在的条件下,与乙醇发生酯化反应,生成4-氟-2-(三氟甲基)苯甲酸乙酯;[0022]2)4-氟-2-(三氟甲基)苯甲酸乙酯与4-氯苯酚(ii)混合,加入碳酸钾,在碱性条件下,以dmf为溶剂,先在120℃下搅拌反应5h,再于140℃下搅拌反应5h,反应结束后,冷却至室温,所得产物用二氯甲烷萃取,无水硫酸镁干燥,过滤,蒸发溶剂,得4-(4-氯苯氧基)-2-(三氟甲基)苯甲酸乙酯;[0023]3)4-(4-氯苯氧基)-2-(三氟甲基)苯甲酸乙酯和氢氧化钠混合,在碱性条件下,发生水解反应,将所得反应液经盐酸酸化处理,生成4-(4-氯苯氧基)-2-(三氟甲基)苯甲酸(iii);[0024]4)4-(4-氯苯氧基)-2-(三氟甲基)苯甲酸(iii)与(cocl)2混合,以二氯甲烷作为溶剂,发生酰化反应后,生成4-(4-氯苯氧基)-2-(三氟甲基)苯甲酰氯;[0025]5)4-(4-氯苯氧基)-2-(三氟甲基)苯甲酰氯与重氮甲烷混合,在乙醚中反应生成4-(4-氯苯氧基)-2-(三氟甲基)苯甲酰重氮甲烷;[0026]6)4-(4-氯苯氧基)-2-(三氟甲基)苯甲酰重氮甲烷与氢溴酸发生歧化反应,生成2-溴-1-[4-(4-氯苯氧基)-2-三氟甲基苯基]乙酮(iv);[0027]7)2-溴-1-[4-(4-氯苯氧基)-2-三氟甲基苯基]乙酮(iv)与1,2,4-三氮唑(v),以thf为溶剂,在氢化钠存在下发生取代反应,生成1-[4-(4-氯苯氧基)-2-三氟甲基苯基]-2-[1,2,4]-三唑-1-基乙酮(vi);[0028]8)将lacl3·2licl的thf溶液与1-[4-(4-氯苯氧基)-2-三氟甲基苯基]-2-[1,2,4]-三唑-1-基乙酮(vi)混合,室温搅拌均匀后,缓慢滴加到甲基溴化镁中,发生格氏反应,得到氯氟醚菌唑(vii)。[0029]进一步的,上述的方法,2-溴-1-[4-(4-氯苯氧基)-2-三氟甲基苯基]乙酮、1,2,4-三氮唑、1-[4-(4-氯苯氧基)-2-三氟甲基苯基]-2-[1,2,4]-三唑-1-基乙酮、甲基溴化镁的摩尔比为2:2:1.0~1.5:1。[0030]氯氟醚菌唑(vii)的合成路线如下:[0031][0032]本发明的有益效果是:[0033]本发明以4-氟-2-(三氟甲基)苯甲酸为起始原料,通过高收率的酯化、水解、取代、酰基化、歧化反应和格氏反应等反应,合成的药物中间体化合物2-溴-1-[4-(4-氯苯氧基)-2-三氟甲基苯基]乙酮的产率高达87.0%,并成功实现氯氟醚菌唑的新的合成方法,其总产率可达69.7%。[0034]本发明提供的合成方法,原料易得,反应条件温和,路线短,收率高,合成成本低,是相对比较适宜的工业化路线,适合工业化生产。具体实施方式[0035]下面通过具体实施例对本发明作进一步的描述,但本发明的保护范围并不仅限于此。实施例1一种药物中间体的合成方法[0036]合成路线如下:[0037][0038][0039]方法包括如下步骤:[0040]1)将3.0mol 4-氟-2-(三氟甲基)苯甲酸(ⅰ),在浓硫酸存在的条件下,与1l乙醇(etoh)发生酯化反应,生成4-氟-2-(三氟甲基)苯甲酸乙酯。[0041]2)将所得4-氟-2-(三氟甲基)苯甲酸乙酯与3.0mol 4-氯苯酚(ⅱ)、3.0mol碳酸钾、2.5l dmf混合,先在120℃下搅拌反应5h,再于140℃下搅拌反应5h,反应结束后,冷却至室温,将所得产物用二氯甲烷萃取,无水硫酸镁干燥,过滤,蒸发溶剂,得到4-(4-氯苯氧基)-2-(三氟甲基)苯甲酸乙酯。[0042]3)将所得4-(4-氯苯氧基)-2-(三氟甲基)苯甲酸乙酯与氢氧化钠发生碱性水解反应,将所得反应液经盐酸酸化处理,得到固体物864.7g,即为4-(4-氯苯氧基)-2-(三氟甲基)苯甲酸(ⅲ),收率为91%。[0043]质谱:316.0109,1h-nmr:(400mhz,cdcl3)δ:2.60(s,3h)、6.98(d,2h)、7.10(d,1h)、7.30(s,1h)、7.35(d,2h)、7.50(d,1h)。[0044]4)将3.0mmol 4-(4-氯苯氧基)-2-(三氟甲基)苯甲酸(ⅲ)与3.0mmol (cocl)2混合,用二氯甲烷作为溶剂,发生酰化反应后,生成4-(4-氯苯氧基)-2-(三氟甲基)苯甲酰氯。[0045]5)将所得4-(4-氯苯氧基)-2-(三氟甲基)苯甲酰氯与3.0mmol重氮甲烷在乙醚中反应,生成4-(4-氯苯氧基)-2-(三氟甲基)苯甲酰重氮甲烷。[0046]6)将所得4-(4-氯苯氧基)-2-(三氟甲基)苯甲酰重氮甲烷与3.0mmol浓缩氢溴酸发生歧化反应,生成固体物1.13g,即为2-溴-1-[4-(4-氯苯氧基)-2-三氟甲基苯基]乙酮(ⅳ),收率为95.7%。[0047]质谱:391.9432,1h-nmr:(400mhz,cdcl3)δ:4.35(s,2h)、7.0(d,2h)、7.12(d,1h)、7.34(s,1h)、7.38(d,2h)、7.55(d,1h)。[0048]实施例2氯氟醚菌唑的合成方法[0049]合成路线如下:[0050][0051]方法包括如下步骤:[0052]1)将3.0mol 4-氟-2-(三氟甲基)苯甲酸(ⅰ),在浓硫酸存在的条件下,与1l乙醇(etoh)发生酯化反应,生成4-氟-2-(三氟甲基)苯甲酸乙酯。[0053]2)将所得4-氟-2-(三氟甲基)苯甲酸乙酯与3.0mol 4-氯苯酚(ⅱ)、3.0mol碳酸钾、2.5l dmf混合,先在120℃下搅拌反应5h,再于140℃下搅拌反应5h,反应结束后,冷却至室温,将所得产物用二氯甲烷萃取,无水硫酸镁干燥,过滤,蒸发溶剂,得到4-(4-氯苯氧基)-2-(三氟甲基)苯甲酸乙酯。[0054]3)将所得4-(4-氯苯氧基)-2-(三氟甲基)苯甲酸乙酯与氢氧化钠发生碱性水解反应,将所得反应液经盐酸酸化处理,得到固体物864.7g,即为4-(4-氯苯氧基)-2-(三氟甲基)苯甲酸(ⅲ),收率为91%。[0055]4)将3.0mmol 4-(4-氯苯氧基)-2-(三氟甲基)苯甲酸(ⅲ)与3.0mmol(cocl)2混合,用二氯甲烷作为溶剂,发生酰化反应后,生成4-(4-氯苯氧基)-2-(三氟甲基)苯甲酰氯。[0056]5)将所得4-(4-氯苯氧基)-2-(三氟甲基)苯甲酰氯与3.0mmol重氮甲烷在乙醚中反应,生成4-(4-氯苯氧基)-2-(三氟甲基)苯甲酰重氮甲烷。[0057]6)将所得4-(4-氯苯氧基)-2-(三氟甲基)苯甲酰重氮甲烷与3.0mmol浓缩氢溴酸发生歧化反应,生成固体物1.13g,即为2-溴-1-[4-(4-氯苯氧基)-2-三氟甲基苯基]乙酮(ⅳ),收率为95.7%。[0058]7)将2.0mol 1,2,4-三氮唑(v)缓慢分批加入2.0mol氢化钠与1.50l thf的混合物中,发生取代反应,室温下搅拌30min后,向该溶液中滴加溶解在2l thf的2.0mol 2-溴-1-[4-(4-氯苯氧基)-2-三氟甲基苯基]乙酮(ⅳ),室温下搅拌约2h。将所得反应物冷却至10℃,并缓慢滴加至冰冷水和氯化铵混合溶液中,将有机层用1.6l乙酸乙酯萃取3次,合并有机相,干燥并蒸发溶剂,由二异丙醚重结晶,得到白色固体561.2g,即为1-[4-(4-氯苯氧基)-2-三氟甲基苯基]-2[1,2,4]三唑-1-基乙酮(ⅵ),收率为87%。[0059]质谱:381.0489,1h-nmr:(400mhz,cdcl3)δ:5.42(s,2h)、7.05(d,2h)、7.15(d,1h)、7.38(s,1h)、7.42(d,2h)、7.60(d,1h)、8.0(s,1h)、8.25(s,1h)。[0060]8)将2.4l浓度为0.6mol/l的lacl3·2licl的thf溶液与5.0l含1.0mol 1-[4-(4-氯苯氧基)-2-三氟甲基苯基]-2-[1,2,4]-三唑-1-基乙酮(ⅵ)的thf溶液混合,并在室温下搅拌30min后,将所得混合溶液滴加到1.5l浓度为0.5mol/l的甲基溴化镁溶液中,搅拌30min;将所得反应液用10% hcl水溶液淬灭,并用mtbe萃取。有机相用盐水洗涤,干燥,蒸馏,在反相色谱柱上提纯之后,得到固体物366.1g,即为氯氟醚菌唑(2-[4-(4-氯苯氧基)-2-三氟甲基苯基]-1-[1,2,4]三唑-1-基丙-2-醇)(ⅶ),收率为92%,熔点为121~122℃。[0061]质谱:397.0808,1h-nmr:(600mhz,cdcl3)δ:8.00(s,1h,triazole-h),7.90(s,1h,triazole-h),7.61(d,j=8.9hz,1h,ph-h),7.38(d,j=2.5hz,1h,ph-h),7.34(d,j=8.8hz,2h,ph-h),7.03(dd,j=8.8,2.5hz,1h,ph-h),6.95(d,j=8.8hz,2h,ph h),4.66(d,j=14.2hz,1h,ch2-h),4.45(d,j=14.2hz,1h,ch2-h),1.64(s,3h,ch3)。 |
【本文地址】