| 三种常用的蛋白质浓度测定方法 – BioEngX | 您所在的位置:网站首页 › 蛋白浓度测定 › 三种常用的蛋白质浓度测定方法 – BioEngX |
三种常用的蛋白质浓度测定方法 – BioEngX
|
对很多人来说,检测蛋白质的浓度实在不是多困难的实验。但有时我们也不能太过自信,因为即使最简单的方法都有其复杂的机理。为了帮助大家选择正确并且简单的方法测定蛋白质的浓度,小编在这里简单介绍下三种常用的蛋白质含量测定方法的原理及注意事项。
BCA(Bicinchoninic Acid)法 BCA方法是近年来广泛应用的蛋白质定量方法。其原理是,在碱性环境下蛋白质与二价铜离子络合并将二价铜离子还原为一价铜离子。BCA与一价铜离子结合形成稳定的蓝紫色复合物。该复合物在562 nm处有较高的吸光值,并与蛋白质浓度呈正比。不方便的是这种方法需要提前制作标准曲线。BCA蛋白质测定方法灵敏度高,操作简单,试剂及其形成的颜色复合物稳定性俱佳。BCA方法适用于表面活性剂存在下的蛋白质浓度检测,可兼容高达5%的SDS,TritonX-100及Tween等。然而,由于BCA方法依靠铜离子进行显色反应,如果溶液中含有与铜离子反应的螯合剂比如EDTA或者还原性试剂比如DTT、β-巯基乙醇,结果将受到很大程度的影响。同时,BCA方法的检测结果也会受到蛋白质内半胱氨酸,酪氨酸,色氨酸含量的影响。
Bradford法
Bradford方法是由Bradford于1976年建立的。第一篇描述Bradford方法的文献目前已经被引用数千次,这充分说明了Bradford方法的价值。该方法的原理是,带负电的考马斯亮蓝染料与蛋白质中碱性氨基酸相互作用。考马斯亮蓝在溶液中显红色,吸收峰在465nm处,当与蛋白质结合后,其显蓝色,在595nm处有吸收峰。595nm处的吸光值与蛋白质的浓度呈正比。在应用Bradford方法时需要注意的是,由于不同蛋白质碱性氨基酸的含量不同,因此Bradford方法用于不同蛋白质测定时有较大的偏差,在制作标准曲线时通常选用g-球蛋白为标准蛋白质,以减少偏差。另外,不像BCA方法,Bradford方法受到SDS、Triton X-100等试剂的影响。
紫外分光光度法
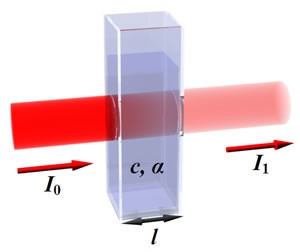
简单但常常不可靠。这个方法通过测量蛋白质中含有共轭双键的酪氨酸和色氨酸在280nm处吸光值来估测蛋白质的含量。蛋白质浓度根据Beer-Lambert定律计算。 A=E•C•l A代表吸光度,E代表消光系数,C代表蛋白质浓度,l代表光径长度。消光系数可以根据蛋白质序列估测。 这种方法之所以不可靠有两个原因。第一,不同的蛋白质含有不同的酪氨酸和色氨酸含量。故要准确测量,必须要有待测蛋白质的纯品作为参考。另外,这种方法会受到在280 nm处有吸光值的物质的影响,包括一些buffer离子,核酸,乙醇等等。其中尤以核酸的影响最为严重。核酸的最大吸收峰在260 nm。因此溶液中同时存在核酸时,必须同时测定OD260和OD280,然后根据两种波长的吸收度的比值,通过经验公式校正,以消除核酸的影响。本法操作简单迅速,且不消耗样品,多用于纯化的蛋白质的微量测定。 对于蛋白质浓度测定,了解测定方法的机理很有必要。小编简述了三种方法的原理及注意事项,希望对您有所帮助。如有任何建议,请在公众平台留言。 图片来自网络,内容由BioEngX原创,转载请注明! |
【本文地址】