| 基因编辑:腺病毒载体用于CRISPR | 您所在的位置:网站首页 › 腺相关病毒载体 › 基因编辑:腺病毒载体用于CRISPR |
基因编辑:腺病毒载体用于CRISPR
|
目前正在开发多种递送系统,包括病毒(AAV、腺病毒)和非病毒(脂质体、脂质纳米颗粒、聚合物载体等)。AAV在体内递送DNA形式的CRISPR-Cas, 一直是该领域研究中的强力“领跑者”,但其具有很大的缺点。而腺病毒在体内传递CRISPR-Cas系统具有一些独特的优势。 腺相关病毒(AAV)是小的非包膜病毒,需要其他病毒(如腺病毒)来进行复制。它们被认为对人类是非致病性的,可以优先整合到宿主基因组的AAVS1基因座中[3]。此外,AAVs在全身性给药后具有穿越血脑屏障(BBB)并将基因传递至中枢神经系统(CNS)的能力。但是宿主对AAVs的免疫反应,降低了其有效病毒浓度,从而需要更高的剂量才能实现有效的治疗,然而更高的剂量反过来会进一步引起免疫反应[4]。除了安全性问题外,AAV的基因组小,导致其转基因能力小于5 kb,很难用于递送CRISPR-Cas系统。 腺病毒是一种无包膜的双链DNA病毒,是生物学和临床研究最深入的病毒之一,其基因组大小约为36 kb,这个特点使得腺病毒载体具有很高的基因包装能力。此外,腺病毒的基因组不会整合到宿主基因组中,从而降低了其致癌性和遗传毒性。包裹基因组的腺病毒蛋白质衣壳主要由三种蛋白质组成:六邻体蛋白、五邻体蛋白和纤维蛋白(图2),这些蛋白质都被证明可以进行遗传修饰以改变病毒的特性[5]。同时,与其他载体(包括AAV)相比,Ads具有成本较低、可大规模生产的优势。
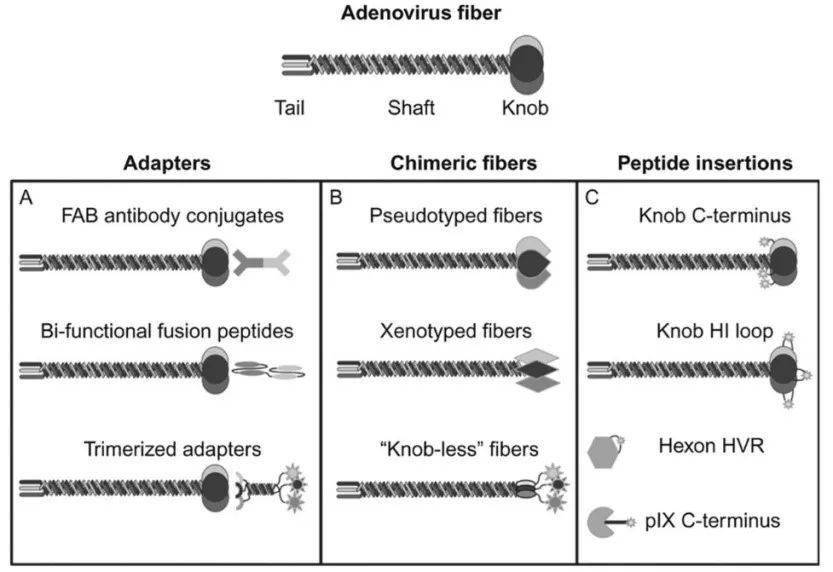
图2. 腺病毒的结构 野生型5型腺病毒(Ad5)的六邻体蛋白能与血液中的凝血因子X结合并直接转运至肝脏,从而导致肝毒性[6]。通过六邻体蛋白修饰或纤维蛋白的修饰消除这种作用,不仅可以避免肝毒性,而且可以将药物递送至其他不同的组织。 Ad5纤维蛋白介导与腺病毒受体(CAR)的结合,从而引起病毒颗粒被细胞内吞,启动病毒细胞感染的第一步[7]。虽然CAR在许多组织细胞中都有表达,但在癌细胞和造血干细胞等细胞中表达却很低。因此可以通过伪装病毒的技术,即去除全部或部分Ad5纤维蛋白基因,并以来自不同Ad血清型甚至非人类Ad的纤维蛋白基因替代,或者将Ad5纤维蛋白与肽配体、单抗和其他靶向分子融合,以改变Ad5的细胞靶向性(图3)。
图3. 改变腺病毒靶向性的策略 通过Ads或者改良的Ads载体在体内递送CRISPR-Cas系统后,利用NHEJ途径敲除突变的基因,或利用HDR途径敲入校正基因,可用于治疗一些遗传性疾病及癌症。由肿瘤特异性启动子驱动复制的Ads被称为“条件复制型Ads”,它可以选择性裂解破坏肿瘤细胞,同时保留非靶组织。同时,Ads固有的免疫原性进一步增强了针对癌症的免疫反应。 但是将Ads用于体内递送CRISPR-Cas系统时,仍然存在一些未解决的问题,即:1)降低脱靶编辑的程度和影响;2)减轻免疫反应。利用HDR途径敲入校正基因时可以选择远离快速复制基因、远离致癌基因并且不参与关键细胞过程的遗传安全港基因座,这些基因座可通过潜在地减少NHEJ的有害影响来减轻利用HDR敲入基因时遇到的某些风险。 Cas9在发挥作用后持续表达可能会导致脱靶编辑次数增加,可以通过使用抗Cas9肽、诱导表达型Cas9等来控制体内Cas9的活性。同时,也可以通过设计具有更高效率和特异性的Cas9或者在细菌中发现与Cas9具有不同特性的新Cas蛋白来降低脱靶编辑的风险。 腺病毒能够被进行合理的工程改造,以提高其基因表达效率并实现细胞特异性的靶向传递,是CRISPR-Cas理想的体内递送载体。未来使用新型载体和基因编辑技术将有可能治疗以前医学界无法治疗的疾病并显著改善人类健康。 参考资料: [1] M. Jinek, et al, A programmable dual-RNA-guided DNA endonuclease inadaptive bacterial immunity, Science. 337 (2012) 816–821. [2] J.D. Sander, et al, CRISPR-Cas systems forediting, regulating and targeting genomes, Nat. Biotechnol. 32 (2014) 347–350. [3] M.F. Naso, et al, Adeno-associated virus (AAV) as a vector for gene therapy, BioDrugs. 31 (2017)317–334. [4] P. Colella, et al, Emerging issuesin AAV-mediated in vivo gene therapy, Mol. Ther. Method Clin. Dev. 8 (2018)87–104. [5] M.S. Beatty, et al, Adenovirus strategies fortissue-specific targeting, Advances in Cancer Research, Academic Press Inc.,2012, pp. 39–67. [6] S.N. Waddington, et al, Adenovirus serotype 5Hexon mediates liver gene transfer, Cell. 132 (2008) 397–409. [7] S. Luisoni, et al, Biology of adenovirus cell entry: receptors, pathways, mechanisms, Adenoviral Vectors for GeneTherapy, Second edition, Elsevier Inc., 2016, pp. 27–58. 备注: 企业+姓名+职位 即可加入本次直播交流群 更有机会获得精美礼品 版 权 声 明 本公众号所有转载文章系出于传递更多信息之目的,且明确注明来源和作者,不希望被转载的媒体或个人可与我们联系([email protected]),我们将立即进行删除处理。所有文章仅代表作者观点,不代表本站立场。返回搜狐,查看更多 |
【本文地址】