| 生物促渗剂在经皮给药系统中的应用研究进展 | 您所在的位置:网站首页 › 胰岛素经皮给药制剂 › 生物促渗剂在经皮给药系统中的应用研究进展 |
生物促渗剂在经皮给药系统中的应用研究进展
|
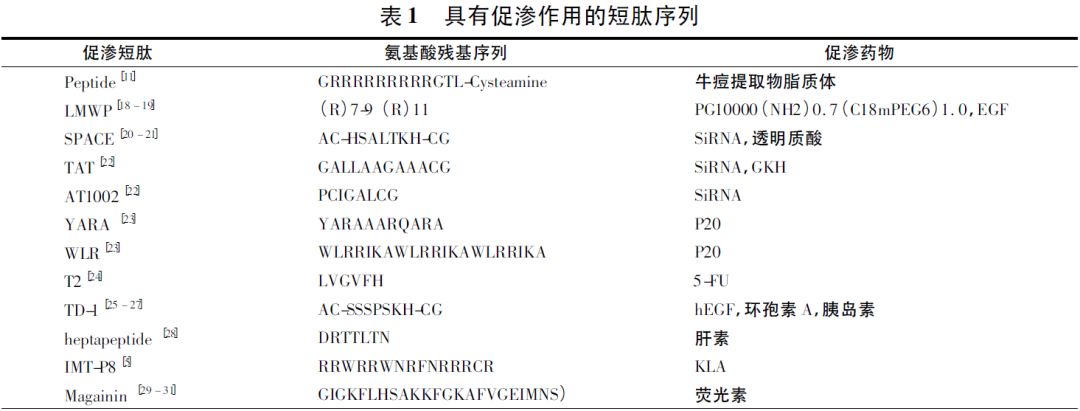
图1 药物转运通过角质层的途径 ① 跨细胞途径,药物通过角质细胞到达活性表皮,然后被真皮层中毛细血管吸收进入体循环,此过程需要经多次水/脂的分配过程,所以药物的跨细胞途径只占药物经皮吸收的极小的一部分。 ② 跨细胞间质途径,是药物穿过角质细胞间类脂双分子层,此途径是药物经皮吸收的主要途径。 ③ 跨皮肤附属器( 毛囊、汗腺和皮脂腺) 途径,当药物开始透过时,首先通过皮肤附属器途径吸收,直至达稳态,该途径是离子型和极性大分子药物经皮吸收的主要途径。 药物只能通过这3 条途径透过角质层,只有部分符合一定条件的药物能够顺利通过此途径进入体循环,这限制了亲水性和生物大分子药物的渗透。 为克服角质层的屏障作用,近年来研发了多种方法来促进药物的经皮吸收,包括物理学方法如离子导入、电致孔、超声导入、微针等; 药剂学方法如微乳、脂质体、纳米粒等; 生物化学法及促渗法的综合应用等。 其中促渗剂( penetration enhancer,PE) 以其成本低、处方设计灵活、工艺便捷等特点仍是增加药物经皮吸收的最佳选择。 传统的化学促渗剂( CPEs) 作用机制是通过改变皮肤特性,扰乱脂质的排列,使紧密的连接形成间隙从而增加角质层的含水量。其促渗过程无特异性,高浓度或长期使用会引起皮肤刺激性、过敏反应等不良反应。 理想的PE 应具备以下特点: ① 低毒无刺激性。② 起效快,易于皮肤吸收。③ 作用单向,只促进治疗药物透过皮肤,不影响内源性物质的体内过程。④ 与辅料及药物无相互作用。因此,发展新型PE 仍是该领域的研究热点。 近十几年来,人们发现了多种生物促渗剂( BPEs)能够有效地增加药物透皮吸收。相较于传统的CPEs,BPEs 具有良好的生物相容性、毒性低、对药物具有选择性、特异性的作用于角质层的某一位点,因而具有更优的应用潜力。 本文对BPEs 的种类、特点、作用机制、目前存在的问题及发展方向进行综述,以期为促渗剂的选择及经皮给药制剂的处方设计提供基础。 1 BPEs 种类和特点 BPEs 是一类能够增强药物经皮渗透性的内源性物质或其衍生物。目前为止,已经发现了多种BPEs,主要有以下几类: 促渗肽、代谢调节剂、氨基酸衍生物和神经酰胺及其类似物。 1.1 促渗肽 促渗肽是一类少于30 个氨基酸残基的短肽,能促进多肽、蛋白质、核酸、纳米粒以及其他生物活性分子穿透细胞膜或皮肤,发挥生物学作用。 因其生物相容性和促渗效果好,有选择性和特异性等优势,在经皮给药系统中的应用具有重要意义。 到目前为止已经发现了多种具有促渗作用的短肽( 见表1) ,它们具有一些共同的特点: ① 肽链相对较短,大多由10 ~ 30 个氨基酸残基构成,多含精氨酸和赖氨酸。② 具有水溶性,为阳离子和/或两亲性分子。③ 低摩尔浓度便能高效携带大量大分子穿过皮肤和体内外生物膜。
促渗肽与药物以物理混合、形成融合蛋白、共价连接和修饰载体等方式促进药物经皮渗透。物理混合的方法简单易行,主要用该方法促进生物大分子如荧光蛋白、胰岛素、人生长激素和肉毒神经毒素等的经皮渗透。 促渗肽可以直接或通过连接臂与药物共价结合,共价结合后相当于形成前药,促渗肽介导其透过皮肤屏障,到达靶部位后在pH 或酶的作用下共价键断裂释放出药物发挥疗效,但此方法要求药物具有羟基、羧基、氨基等可修饰的官能团。 通过基因重组技术使促渗肽与多肽和蛋白类药物形成融合蛋白后经皮给药,是促渗肽与治疗药物之间的另一种作用方式。 该方法首先将促渗肽的基因与具有治疗作用的蛋白的基因进行重组,得到2 个基因共同表达的融合蛋白,使其能够易于透过皮肤屏障发挥治疗作用。 但该方法相对复杂,特别是融合蛋白基因的构建以及目的蛋白的分离和纯化。促渗肽的另一种作用方式是作为配体修饰药物的纳米粒、脂质体等,从而提高药物的经皮渗透率。 促渗肽通常通过多肽固相合成的方法和噬菌体展示技术获得。多肽固相合成的原理是: 设计氨基酸序列,根据多肽序列依次添加氨基酸,延长肽链得到目标序列。 噬菌体展示技术是获取促渗肽的最常用方法,包括体外和体内2 种手段。体外噬菌体展示技术通常在Franz 扩散池装置中进行,首先将噬菌体展示肽文库涂覆于皮肤表面,扩增一定的时间后,在接收池中收集穿过皮肤的噬菌体,再将收集到的噬菌体再次涂覆于皮肤表明进行第2 轮筛选,经过3 次筛选后将接收池中收集到的噬菌体进行分离纯化,提取并进行DNA 测序,即可得到目标促渗肽。 体内噬菌体展示技术的原理与体外相同,其具体过程如图2 所示,将噬菌体展示肽文库涂覆于裸鼠腹部皮肤,眼眶取血收集扩增后的噬菌体,经过2 ~ 3 轮筛选分离纯化后即可得到目标促渗肽序列。
图2 噬菌体展示技术筛选具有经皮促渗作用的短肽 虽然已发现了多种具有良好促渗效果的透皮短肽,但其也具有一些缺点。绝大部分的促渗肽都是通过生物学手段获取,其分离纯化过程相对复杂,且将其应用于人可能会产生潜在的免疫和毒性反应。 影响促渗肽稳定性的因素较复杂,与其自身特性、被载药物和给药部位都有关,且与有效性密切相关。 到现在为止还没有使用促渗肽的透皮制剂品种获得FDA 批准上市,仅有部分产品进入临床研究,见表2。
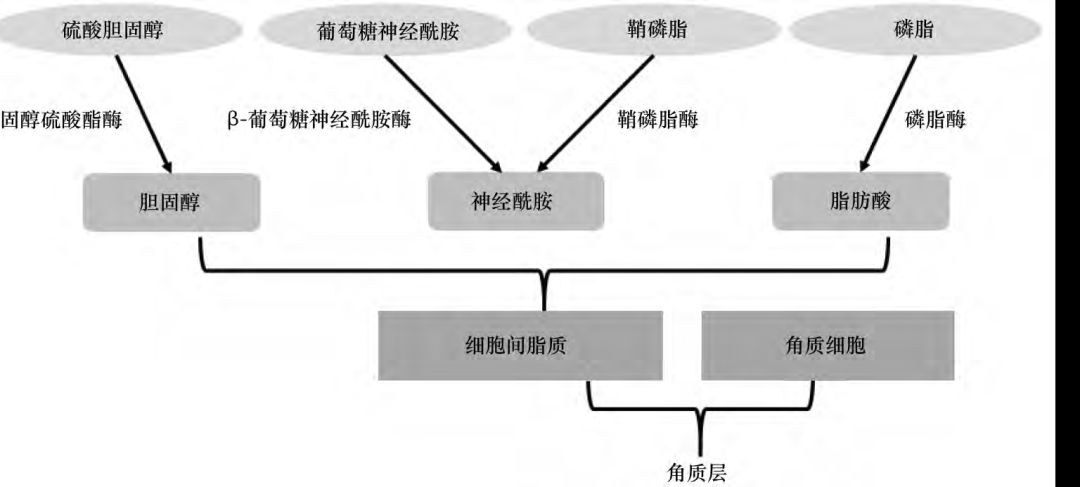
1.2 代谢调节剂 主要由神经酰胺、胆固醇和脂肪酸组成的皮肤角质层( stratum corneum,SC) 中的脂质在维持皮肤屏障功能中起着关键作用( 见图3) ,因此其中任一成分的减少都会改变保持皮肤正常屏障功能所需的摩尔比,从而破坏屏障的完整性,因此研究者们认为脂质代谢调节剂可以介导皮肤渗透性。
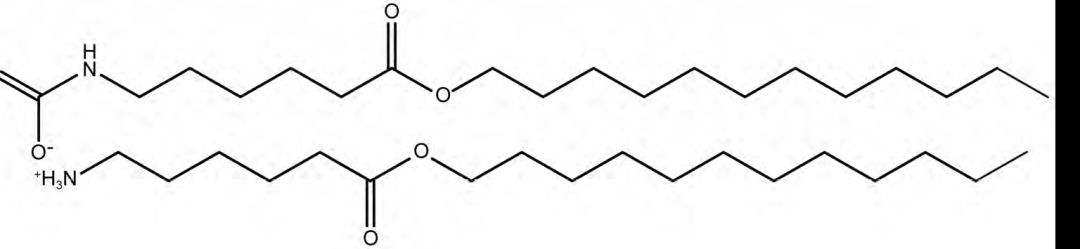
图3 角质层细胞间脂质的形成 研究显示,脂肪酸合成抑制剂( 如浅蓝菌素) 、胆固醇合成抑制剂( 伊伐他汀和氟伐他汀) 或神经酰胺合成抑制剂( 如β-氯丙氨酸) 能够延缓皮肤屏障功能的恢复,从而增强不同药物如咖啡因和盐酸利多卡因、左旋多巴和5-氟尿嘧啶的经皮吸收。 胰蛋白酶主要用于体外表皮分离和角质形成细胞分离的蛋白水解酶。Li 等首次发现胰蛋白酶可以作为生物促渗剂促进胰岛素的经皮吸收,进一步研究了胰蛋白酶促进胰岛素经皮吸收的途径,用三维培养的人表皮模型进行了体外渗透试验。 荧光显微镜观察结果显示: 胰蛋白酶通过细胞间途径和毛囊途径增加胰岛素的转运。ATR-FTIR实验表明胰蛋白酶通过改变SC 蛋白结构,从而影响皮肤屏障功能产生促渗效果。 1.3 氨基酸衍生物 具有经皮促渗作用的氨基酸衍生物主要是氨基酯类,Transkarbam 12( T12) 即为其代表性化合物。 Tomas 等合成了T12 的酮、酰胺和烷烃类似物,选择茶碱作为模型药物,用猪皮进行体外渗透试验,评价其渗透促进活性。 结果发现,用亚甲基和羰基替换酯基后,活性显著降低,酰胺类似物的活性与溶剂系统有关,但活性都不如T12。 因此酯和氨基甲酸铵之间的分子内氢键被认为是对T12 的促渗活性非常重要。Novotny 等进一步研究了酯基位置对T12 促渗活性的影响,发现当酯基与极性头部氨基甲酸铵之间相距2 ~ 4 个C 时,活性显著下降。 当酯基向末端移动时,活性增强,当酯基与极性头部氨基甲酸铵之间相距7 个C 时,活性最强,继续向末端移动则活性降低。进一步证明了,酯基对T12 的促渗活性有重要意义。 1.4 神经酰胺及其类似物 角质层脂质的50% 由神经酰胺类构成,它们共同的结构特征是含有相对较小的极性头部( 2 ~ 4 个羟基和酰胺基,有较强的形成氢键的能力) 和2 条长直饱和碳链,这使得神经酰胺能够形成稳定的氢键网络,从而形成层状结构。 因此研究者们提出了一个假说,结构与神经酰胺相似的分子可能有一定的促渗能力。 Veryser等用9 种植物神经酰胺衍生物,选择咖啡因、睾酮和布洛芬作为模型药物,采用相同厚度的人体皮肤通过Franz 扩散池进行研究。 结果发现神经酰胺对药物有选择性,所选的神经酰胺能够不同程度的促进咖啡因和睾酮的经皮渗透,然而对布洛芬没有效果。 2 生物促渗剂的促进药物经皮吸收的机制 2.1 作用于毛囊 毛囊、汗腺等皮肤附属器是药物经皮吸收的一条途径,其中毛囊约占人体皮肤面积的1. 2%,在药物经皮吸收中发挥着重要作用。 Chen 等通过噬菌体展示技术筛选了一个具有促渗作用的短肽TD-1 ( ACSSSPSKHCG) ,TD-1 能够有效地促进不同构象的胰岛素透过皮肤进入体循环。 用125 I 标记的胰岛素进行活体透皮研究发现,TD-1没有与胰岛素直接结合,且TD-1 对不同构象的胰岛素的促渗作用没有显著性差异,证明TD-1 不是通过改变胰岛素的空间构象增加其经皮渗透量。 作用时效研究结果提示,TD-1 可能特异性地使皮肤屏障打开瞬时通道。通过荧光显微镜观察皮肤切片发现,TD-1 通过作用于毛囊,从而介导胰岛素转运通过皮肤屏障。 2.2 作用于角质层 皮肤屏障功能通常指角质层的屏障结构,又称为渗透性屏障。BPEs 选择性的作用于角质层中的脂质双分子层、蛋白质、胆固醇等,从而改变角质层的结构促进药物透过角质层进入血液。 T12( 见图4) 是6-氨基己酸十二烷基酯与CO2反应得到的一种氨基酸衍生物,是一种新型低毒高效的促渗剂。
图4 Transkarbam 12 结构式图 其是由氨基甲酸盐构成的极性头部在酸性条件下不稳定,进入弱酸性的SC( pH 5.5)中后释放出CO2,CO2能够改变SC 脂质极性头基的氢键,从而高度扰乱脂质排列促进药物透皮吸收。 Vávrová 等合成了一系列分别含有不同极性头端和不同长度烷基链的神经酰胺类似物,并用猪皮进行了体外渗透性研究。 结果表明,类似物形成氢键的能力与其促渗活性有重要关系,即极性头基对其渗透性和与SC 脂质之间的相互作用有重要关系,而对作用机制没有影响,因此神经酰胺类似物具有相同的作用机制,即可能是通过改变SC 脂质极性头基之间的氢键作用,从而使神经酰胺类似物替换掉部分原有的脂质,扰乱脂质排列促进药物经皮渗透。 2.3 作用于活性表皮 活性表皮位于角质层与真皮层之间,厚度为50 ~ 100 μm,由活细胞构成,因此含有丰富的酶及蛋白质,是促渗剂的一个作用位点。 Babita 等用脂肪酸合酶抑制剂浅蓝菌素处理老鼠皮肤,以皮肤中甘油三酯( 脂肪酸合成的一个指标) 的浓度和左旋多巴的体外渗透率为指标观察其对左旋多巴经皮渗透行为的影响。 结果发现,浅蓝菌素能够抑制脂肪酸的合成长达48 h,且用浅蓝菌素处理后左旋多巴的皮肤透过率是未处理组的3 倍。 说明脂肪酸合酶抑制剂通过抑制表皮层中脂肪酸的合成减弱皮肤屏障作用,从而促进药物经皮渗透。 Uchida 等使用一种促渗肽AT1002 促进siRNA转运进入小鼠皮肤。使用AT1002 时,表皮中的紧密连接蛋白ZO-1 消失,除去AT1002 后蛋白ZO-1恢复正常。说明AT1002 通过作用于蛋白ZO-1 的紧密连接来增加siRNA 的经皮渗透,且该作用过程是可逆的。 3 小结与展望 BPEs 是增强药物经皮递送的一种新方法,其在促进水溶性小分子和多肽、蛋白等生物大分子药物渗透和穿过皮肤屏障等具有特殊价值,但在广泛应用之前至少有以下几个难题需要解决: ① 体内外相关性的建立。目前,对BPEs 活性研究大都采用体外模型,在动物和人体在体作用了解甚少,且由于皮肤的复杂性,难以在体外和体内皮肤渗透性之间建立可靠的相关性。 ② 成药性。BPEs 特别是促渗肽和代谢调节剂的活性研究都直接采用溶液载体,BPEs 是否可以配置成可接受的药物产品,例如贴剂和半固体制剂仍需要进一步研究。 ③ 量效关系的建立。关于BPEs 特别是促渗肽的研究,目前的工作主要集中在筛选和验证它们的活性,而很少有量效关系的研究。BPEs 用量和皮肤的渗透性之间的定量关系是实现药物控释的理论基础,因此建立其量效关系具有重要意义。此外,开发数学模型以描述和预测BPEs 促进药物经皮渗透行为也非常重要。 ④ 促渗机制的研究。由于BPEs 对不同的药物可能有不同的促渗机制,且与正常细胞膜不同,皮肤的最外层由富含角蛋白的死细胞组成,SC 中的脂质和角蛋白是BPEs 主要作用位点,在促渗过程中药物、促渗剂和SC 中组分之间的复杂相互作用不能仅通过机械的研究SC 的变化来解释。 ⑤ 安全性问题。对于BPEs 自身药理毒理及药动学的基础研究不足,它们自身以及进入皮肤后的代谢产物对皮肤的刺激性等仍然需要进一步研究。 小贴士 来源:中国新药杂志2018 年第27 卷第3 期返回搜狐,查看更多 |
【本文地址】