| 【指南速览】中国非小细胞肺癌患者EGFR T790M基因突变检测专家共识 | 您所在的位置:网站首页 › 肺癌基因突变图片 › 【指南速览】中国非小细胞肺癌患者EGFR T790M基因突变检测专家共识 |
【指南速览】中国非小细胞肺癌患者EGFR T790M基因突变检测专家共识
|
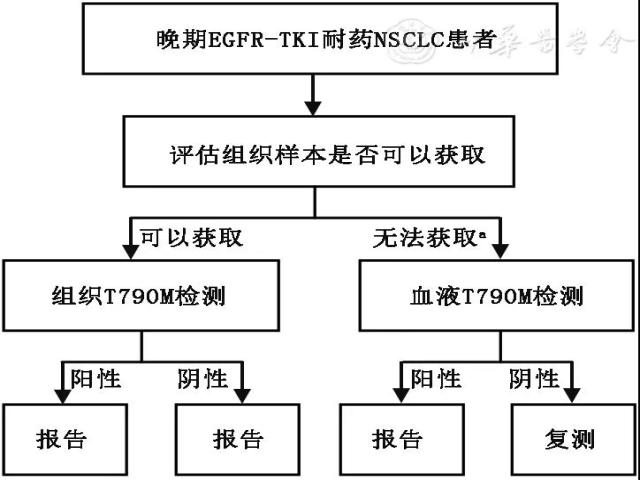
本文来源:中华医学杂志, 2018,98(32) : 2544-2551. 表皮生长因子受体(EGFR)基因突变是东亚人群中非小细胞肺癌(NSCLC)最常见的驱动基因突变,发生率为30%~40%。既往多项研究支持EGFR-酪氨酸激酶抑制剂(TKI)单药治疗是EGFR基因突变局部晚期或转移NSCLC患者的标准治疗方案,但大多数患者会在用药后9~14个月发生耐药,其中EGFR基因第20号外显子发生错义突变(即T790M突变)是耐药突变中最主要的类型。目前已报道的EGFR-TKI耐药后组织样本的T790M突变阳性率基本在60%左右,不同技术方法检测结果较为相似,但是血浆样本T790M突变阳性率基于不同方法差别较大,在23%~63%。 奥希替尼是一种口服、强效、不可逆,具有中枢神经系统活性,选择性抑制EGFR敏感突变和T790M突变的三代EGFR-TKI,同时对EGFR野生型细胞作用较弱,减少了相关不良事件的发生。一项随机Ⅲ期临床研究AURA3对比了奥希替尼和含铂双药化疗治疗一线EGFR-TKI耐药后组织T790M阳性的晚期NSCLC患者,结果显示,对比标准化疗,奥希替尼可显著延长中位无进展生存期(PFS)。Ⅱ期、开放性、单臂、中国注册临床研究AURA17显示了奥希替尼在EGFR-TKI耐药后组织T790M突变阳性亚太及中国人群中的疗效,客观缓解率(ORR)达63%,中位PFS 9.7个月。基于上述研究,奥希替尼于2017年3月22日被中国国家食品药品监督管理总局(CFDA)批准用于既往经EGFR-TKI治疗时或治疗后出现疾病进展,并且经检测确认存在EGFR T790M突变阳性的局部晚期或转移性NSCLC成人患者的治疗。目前,美国国立综合癌症网络(NCCN)、欧洲临床肿瘤协会(ESMO)指南、中国临床肿瘤学会(CSCO)原发性肺癌诊疗指南均推荐奥希替尼为局部晚期或转移NSCLC EGFR-TKI耐药后T790M突变阳性患者的标准治疗。 EGFR T790M突变的检测对EGFR-TKI耐药的晚期NSCLC患者的后续治疗具有重要的临床指导意义,但是我国目前尚无这方面的共识。应推荐何种人群进行T790M检测?如何掌握T790M的检测时机?如何选择检测样本?不同类型的样本在取材、固定和检测技术选择、应用时应该如何规范?这些临床检测实践问题亟待解决。 共识制定方法 本工作得到CSCO肿瘤生物标志物专家委员会的支持,由广东省人民医院吴一龙教授牵头,成立共识撰写专家组,组织国内相关领域的临床和病理学专家,对中国NSCLC患者EGFR T790M基因突变临床检测实践中涉及的上述问题进行反复讨论,基于现有的高质量循证医学证据和经专家广泛认可的临床经验,同时参考国内外最新相关指南达成如下专家共识,以规范国内T790M临床检测实践。 本共识中的推荐均有国内外高质量文献作为参考依据,在共识撰写时专家组对相关文献进行了系统性检索与分析,使用关键词"非小细胞肺癌/Non-small cell lung cancer/NSCLC","获得性耐药/acquired resistance","T790M","生物标志物/biomarker"等在PubMed, Google Scholar等公共数据库中进行文献检索。 本共识专家组证据或共识水平的定义:(1)1类:表示该推荐内容基于高水平的证据,具有明确的优势,并且在本共识专家组成员中具有广泛的共识,建议值得信赖。(2)2A类:表示该项基于临床经验在内的较低水平证据,需要权衡优势和劣势,本共识专家组成员达成共识,因此该推荐是可以信赖的。(3)2B类:表示该项推荐内容基于临床经验在内的较低水平证据,本共识专家组成员对于该建议的适宜性意见不一致,但无较大分歧。(4)3类:表示本共识专家组成员存在较大分歧。本共识中所推荐的证据级别除了少数做特别说明之外,均在2A类以上。 形成的共识 (一) EGFR T790M基因突变的检测人群及检测时机 【共识1】建议既往接受过EGFR-TKI治疗的局部晚期或转移NSCLC患者疾病进展后都应进行EGFR T790M突变检测,建议在影像学进展后,考虑T790M检测(1类)。 EGFR-TKI治疗后耐药的NSCLC患者中T790M的突变率约为60%,奥希替尼是各权威指南推荐的这类T790M突变阳性患者的标准治疗,为使患者尽可能地从最有效的治疗中受益,只要条件许可,所有既往接受过EGFR-TKI治疗的局部晚期或转移NSCLC患者都应尝试进行T790M突变检测。 多项动态血浆监测研究显示,T790M突变的发生早于实体瘤疗效评价标准(RECIST)评估的影像学进展,然而仍需要更多的研究去探索在影像学进展前检测到T790M耐药突变的患者中使用三代EGFR-TKI是否能更多获益。IMPRESS研究结果显示EGFR突变阳性经一代EGFR-TKI吉非替尼治疗后发生RECIST评估影像学进展的T790M突变阳性晚期NSCLC患者继续采用吉非替尼联合顺铂培美化疗较安慰剂联合化疗总生存期(OS)显著受损。提示一代EGFR-TKI治疗影像学进展后T790M阳性突变患者继续一代EGFR-TKI治疗有可能对患者产生损害。因此在临床实践中推荐在接受EGFR-TKI治疗并发生RECIST标准评估的影像学进展后进行T790M检测,以指导患者后续治疗选择。 (二)EGFR T790M基因突变检测标本 【共识2】建议首先评估患者是否可进行组织活检,如组织可获取,推荐先取组织用于检测T790M突变。检测路径推荐见图1(1类)。
注:a如果组织无法获取,也可使用细胞学样本替代 ▲图1 T790M基因突变检测路径推荐 国内外权威指南与共识均推荐T790M突变检测组织优先。2017年NCCN V9指南建议:NSCLC患者接受吉非替尼、厄洛替尼或阿法替尼等一代或二代EGFR-TKI治疗后发生耐药进展均应及时进行T790M突变检测,检测时优先进行组织检测,若组织活检不可及时,再考虑血浆检测,如果血浆T790M检测阴性,推荐重新进行基于组织的检测;2017年CSCO指南也指出"对于EGFR-TKI耐药病例,建议二次活检进行继发耐药EGFR T790M检测(ARMS方法,获批试剂盒);对于不能获取组织的患者,可行血浆ctDNA EGFR T790M检测"。 肿瘤组织仍然是目前耐药检测的首选样本,除了进行分子检测外,组织形态学的改变例如NSCLC向小细胞肺癌(SCLC)的转化,只能通过组织活检诊断。多项研究报道50%~80%的耐药患者可以接受二次活检。肺癌患者组织小样本取材根据方法不同,可主要分为经支气管镜取样和经皮肺穿刺活检,前者又主要包括经支气管腔内活检术、常规及支气管内超声引导下的经支气管针吸活检,其中通过支气管内超声引导的活检,可以有效地将气胸和出血等发生率控制在2%以下,其他小样本活检的具体要求及注意事项可以参考《肺癌小样本取材相关问题的中国专家共识》。 【共识3】在组织无法获取时,可考虑采用其他样本比如肿瘤细胞学样本或者血浆样本进行EGFR T790M检测(2A类)。 肺癌细胞学样本可以通过支气管肺泡灌洗术,或从胸腔积液、痰液、脑脊液等样本中获取。使用胸腔积液检测EGFR基因突变具有较高的敏感性和特异性,且使用胸腔积液或腹腔积液检测EGFR基因突变与组织相比有相似的阳性率和极高的一致性,因此在既往的EGFR基因突变检测共识中,均推荐细胞学样本的使用。2017年,美国病理学家协会(CAP)、国际肺癌研究协会(IASLC)、美国分子病理学会(AMP)联合更新的分子检测指南中推荐病理医师可以使用细胞团块或其他细胞学标本作为肺癌分子检测的合适标本。 细胞学样本也适用于EGFR T790M突变检测。研究报道既往接受EGFR-TKI治疗的EGFR突变阳性NSCLC患者的组织学及细胞学样本检测T790M突变一致性达到91.7%。无论采用哪种标本类型,均应保证包含足够的肿瘤细胞(推荐肿瘤细胞数量在200个以上),尽量剔除非肿瘤组织和细胞。 对于不能获取组织或细胞学样本的患者,还可收集血液样本、脑脊液或尿液,抽提ctDNA,用于EGFR T790M突变检测。EGFR-TKI耐药后血浆T790M突变阳性患者与肿瘤组织T790M阳性患者接受奥希替尼治疗有着相似的临床获益,推荐作为肿瘤组织不可获取时的首选样本。尿液样本提取的ctDNA也可用于T790M检测,尿液T790M阳性的患者接受三代EGFR-TKI治疗后的ORR和中位PFS与组织阳性患者相似。 【共识4】对于血浆检测阴性的患者建议密切关注患者的疾病状态,重新评估组织活检的可行性,视情况再行组织或者其他样本的EGFR T790M复测(2A类)。 既往多项奥希替尼的注册临床研究ARUA系列报道,血浆阴性但组织T790M阳性的患者接受奥希替尼治疗后仍然有较高的ORR(62%~70%)。AURA研究中血浆样本采用高敏感的BEAMing数字PCR方法进行T790M突变检测,104例血浆检测阴性患者中47例经组织样本cobas检测为阳性,这些患者的ORR (69%比25%)和平均PFS(16.5比2.8个月)显著高于血浆及组织样本检测均阴性的患者。AURA3研究基线血浆样本回顾性分析显示,T790M组织阳性患者的血浆中有23%~27%未能检测到EGFR ctDNA,进一步分析发现ctDNA释放情况与肿瘤大小相关,基线靶病灶较小( (三) EGFR T790M基因突变检测方法 【共识5】针对不同的样本类型和临床需求,建议采用不同的检测方法,推荐对血浆样本采用敏感度较高的方法进行检测(2A类)。 肿瘤组织可以获取时,临床上主要使用甲醛固定石蜡包埋(FFPE)的肿瘤组织样本进行检测,建议使用ARMS方法(检测阈值可达1%),目前市场上基于此技术的多个商业化组织EGFR基因突变检测试剂盒已获CFDA的批准,均可用于T790M检测。其中基于ARMS罗氏EGFR突变检测试剂盒(cobas®EGFR Mutation Test V2)作为奥希替尼临床注册研究患者入组所采用的T790M检测方法,在2016年经FDA批准作为奥希替尼的伴随诊断,并在2018年6月获得国内CFDA的批准。T790M突变是EGFR基因20号外显子上2369位C>T的碱基突变导致,在FFPE样本的制备过程中,甲醛固定会导致DNA发生脱氨基现象,胞嘧啶和5-甲基胞嘧啶分别脱氨基为尿嘧啶和胸腺嘧啶,导致极低丰度的C>T碱基突变,当使用接近0.1%的检测阈值检测FFPE样本可能产生假阳性,所以使用高敏感检测技术时,建议采用胸腺嘧啶DNA糖基化酶对FFPE抽提的DNA样本进行预处理移除脱氨基形成的尿嘧啶和胸腺嘧啶,并且采用经过验证的合理检测阈值进行组织T790M突变的阳性判读。 对于组织不可获取的患者,可采用细胞学或者血浆等抽提的ctDNA样本进行T790M突变检测。ctDNA丰度低、片段小的特性对检测平台提出了较高要求,推荐采用敏感度较高的方法进行检测。以组织为参照,血浆T790M检测ARMS法,比如凯杰的therascreen™ EGFR突变检测试剂盒、罗氏cobas® EGFR突变检测试剂盒V2以及厦门艾德Super-ARMS®人类EGFR基因突变检测试剂盒的敏感度为分别为29%、41%~64%和49%~61%。2018年1月19日,CFDA批准了Super-ARMS法产品用于血液EGFR基因突变(含T790M)检测,作为不易获取组织样本时的补充手段。以组织为参照,不同数字PCR平台(检测阈值可达0.1%)的敏感度分别为71%(BEAMing数字PCR)、56%~71%(伯乐液滴式数字PCR,ddPCR™)和69%(赛默飞QuantStudio™ 3D数字PCR),多个检测方法平行比较的研究均显示数字PCR法较普通ARMS方法更为敏感。二代测序(NGS)技术检测血液中T790M的阳性率在不同研究报道中有较大的差异(16.8%~54.0%)。在一定的测序覆盖深度下(有效深度超过1 000倍,检测阈值达0.1%)NGS血液检测基于组织的敏感度为65%~71%,也可应用于ctDNA中T790M突变的检测。但由于不同实验室采用不同NGS平台、操作规程、测序深度以及生物信息学判读标准,可能导致不同检测敏感度,因此选择NGS进行T790M检测时应充分关注NGS技术参数。基于数字PCR和NGS的EGFR检测平台也在CFDA申报过程中,未来临床会有更多的选择。 (四)EGFR T790M基因突变检测流程 【共识6】进行EGFR T790M突变检测的实验室和技术人员需具备相关的资质和认证(1类)。 进行EGFR T790M突变检测的实验室必须建立PCR标准实验室,通过国内外相关机构的认证,符合中国卫生管理机构和国际上的质量标准,定期参加相关技术的质控项目,如国内PQCC和国外EMQN等室间质评项目。检测人员应接受过严格的上岗培训,获得相关PCR上岗证书,对熟练掌握检测技术,严格按照标准操作规程进行操作。 【共识7】申请EGFR T790M突变检测时,建议提供既往用药史,既往EGFR检测史等信息(2A类)。 检测前,由临床医师发起送检申请,并规范填写送检单。送检单除了包括患者基本信息外,建议包括样本采集信息(肿瘤组织采集部位,采集时间等)、患者治疗史(包括有无进行EGFR-TKI治疗,若有,则建议提供用药起止时间、疾病进展时间、病灶转移情况、是否接受放化疗及起止时间等信息)和既往EGFR检测史(如有,包括样本类型、检测方法、检测时间和结果)。填写规范、信息全面准确的送检单是后续分子检测及患者治疗的重要参考依据,也有利于对检测结果进行合理解读。 【共识8】为保证EGFR T790M突变检测的成功率及检测结果的正确性,需对样本预处理和检测各环节进行严格的质控(1类)。 对不同类型样本的处理要求见表1。 表1 不同类型样本的处理和要求 注:横屏或网页版观看效果更佳 处理/要求 组织样本 细胞学样本 血液样本 取样/固定要求 离体30 min内固定 4%中性甲醛手术样本固定时间为6~48 h;活检样本固定时间为6~12 h在骨转移患者取样时需要注意优先活检存在转移病灶的软组织成分,脱时尽量采用温和的EDTA方法(2A类) 胸腔积液20~500 ml:用肝素抗凝痰液和支气管肺泡灌洗液:收集和处理前保存于4℃细胞学细胞涂片使用95%乙醇固定液,时间不少于15 min若需制备细胞学样本蜡块,使用4%中性甲醛固定,后续操作可参照活检小标本处理要求(2A类) 血液样本需谨防溶血发生使用EDTA抗凝管需在常温两小时内分离血浆使用常温采血管(Streck或BCT管)可常温保存3~7 d,但建议尽快分离、检测(2A类) 需要量 采用普通ARMS方法时,建议肿瘤细胞>200个 (当使用更为灵敏的技术,且该检测方法被充分验证时,可使用较少的细胞) 不同技术平台对于血量的要求不同,通常推荐10 ml全血(2A类) 肿瘤细胞比例≥10%时,可直接检测;肿瘤细胞时,需要在显微镜下仔细富集(2A类) DNA/血浆游离DNA抽提与定量 对于组织FFPE样本或者血浆样本的DNA抽提,建议使用经过验证的专门针对FFPE样本或cfDNA的提取试剂盒。大部分普通的DNA提取试剂盒对血浆样本的小片段ctDNA回收率非常低,因此血浆检测应选择对小片段回收率高的提取试剂盒,最好进一步浓缩ctDNA浓度,能有效提高检测敏感度(1类) 完成抽提后,应对组织DNA或血浆cfDNA进行定量,并对质量进行严格的质控。当DNA/cfDNA上样量不足或质量不合格时,不应继续检测,应重新进行提取或者重新取样(2A类) T790M检测对照设置和结果判读 需设置相关的野生型DNA阴性对照和T790M突变阳性对照。如果发现阴性对照和(或)阳性对照出现异常,或者任何一个检测环节质控不合格,均应进行复检。当检测结果是阳性时,如果样品检测结果落于阈值附近难以判断,建议采用另一种方法进行复检确认,或者填写检测报告中相关内容,并报告给临床医师;当检测结果是阴性时,需排除由于DNA样本质量问题和其他实验操作问题导致的假阴性,填写检测报告相关内容,并报告给临床医师;尤其当血液样本检测阴性时,应建议进行复测(2A类) 建议在血液检测T790M时同时包括EGFR敏感突变作为参照,EGFR突变阳性患者在接受EGFR-TKI治疗进展后,若原来的EGFR敏感突变亦未能检测出,可能提示ctDNA量不足或在血浆中未释放,为假阴性结果,建议复测以确认T790M状态(2A类) 注:EDTA:乙二胺四乙酸,血液抗凝剂等;cfDNA:游离DNA 【共识9】为尽快为患者提供治疗方案,建议从样本接收到发出检测结果报告的总时间不超过7个工作日(2A类)。 【共识10】建议规范检测报告内容,包括样本信息、检测内容、检测结果、结果解读、检测日期和签名(1类)。 检测报告样本信息应包括样本编号、接收日期、患者信息(姓名、性别、年龄)、样本具体信息(临床诊断,需注明初治或复发、标本来源与类型、标本质量与体积、病理分类、质控信息)。检测内容应包括检测项目与位点、检测技术、使用仪器及试剂、检测的敏感度和局限性。检测结果应包括对结果的描述,例如阳性、阴性或者需要复检,对于需要复检的样品需要提供复检原因。检测结果中指出检测结果的临床意义。检测报告应由检测人员和分子病理医师共同签字并签署检测日期。检测报告模板可参考图2。
展望 随着检测技术的不断进步,检测敏感度也逐步提升,使得血浆样本中极低含量ctDNA的突变检测成为可能。由于液体活检的方便及微创性,使其越来越广泛地被应用于肿瘤发生发展过程中各个阶段的检测。BENEFIT研究中发现,利用血浆动态检测,可较影像学检测提前2个月发现T790M突变;在Zheng等的报道中,同样发现可以在影像学进展前的2.2个月在血浆中检测到T790M突变。因此,EGFR-TKI治疗过程中也可使用血浆样本动态检测T790M,从而提前预测使用EGFR-TKI治疗后的疾病进展。另一方面在一些研究中发现,晚期初治的NSCLC患者存在原发性T790M突变;在EGFR-TKI治疗前的晚期NSCLC患者中,传统方法检测T790M的突变率为2%~3%。采用敏感度较高的检测方法,可以检测到更高的原发性T790M突变率,但是由于这些研究主要使用的是甲醛固定的肿瘤组织样本,这类样本中用超高敏感方法检测到的T790M突变也可能会是甲醛固定带来的假阳性,因此目前原发性T790M的真正突变率尚有争议。肿瘤组织中存在原发性T790M患者接受一代EGFR-TKI治疗的临床获益较差,而接受三代TKI治疗有明显获益,因此既往未接受过EGFR-TKI治疗的晚期NSCLC患者也可考虑进行T790M检测。 Ⅲ期FLAURA临床试验结果显示三代EGFR-TKI奥希替尼一线治疗EGFR突变晚期NSCLC患者的PFS优于标准的EGFR-TKI方案(中位PFS 18.9比10.2个月)。基于此奥希替尼已在2017 NCCN V9指南中被推荐为EGFR突变阳性晚期NSCLC患者的一线治疗,目前CFDA已批准了奥希替尼在既往经治并携带T790M突变的晚期NSCLC患者的二线适应证。基于奥希替尼在一线治疗的优秀表现,未来有望在国内上市其在晚期NSCLC患者的一线适应证。未来面对多种一代/二代/三代EGFR-TKI,应该直接一线使用三代EGFR-TKI还是采取一代/二代+三代EGFR-TKI贯序治疗始终是临床医师最为关注的问题。欧洲正在进行的APPLE研究纳入晚期EGFR突变且未使用过EGFR-TKI治疗的NSCLC患者,将对比一线接受奥希替尼治疗以及接受吉非替尼治疗后在出现ctDNA T790M阳性时或出现RECIST评定的疾病进展后转换使用奥希替尼的三组患者的疗效差异,从而探索使用三代EGFR-TKI奥希替尼的最佳时机。未来初治患者的T790M检测以及治疗过程中T790M的动态检测可能会对临床医师选择最适合患者的治疗策略产生重大影响。本共识将根据未来新的临床研究结果、实践改变及检测技术的进展进行定期更新,为进一步优化NSCLC患者EGFR T790M突变检测的临床实践提供指导和建议。 本共识制定专家组(按单位名称汉语拼音排序):北京大学肿瘤医院病理科(林冬梅);北京协和医院病理科(梁智勇);福建省肿瘤医院胸部肿瘤科(黄诚);广东省人民医院(广东省医学科学院)肿瘤治疗中心肺一科(吴一龙),肺癌研究所(张绪超);解放军南京总医院病理科(周晓军);上海交通大学附属胸科医院肿瘤内科(陆舜);四川大学华西医院病理科(刘卫平);郑州大学附属肿瘤医院河南省肿瘤医院肿瘤内科(马智勇);中南大学湘雅医院呼吸内科(胡成平) |
【本文地址】
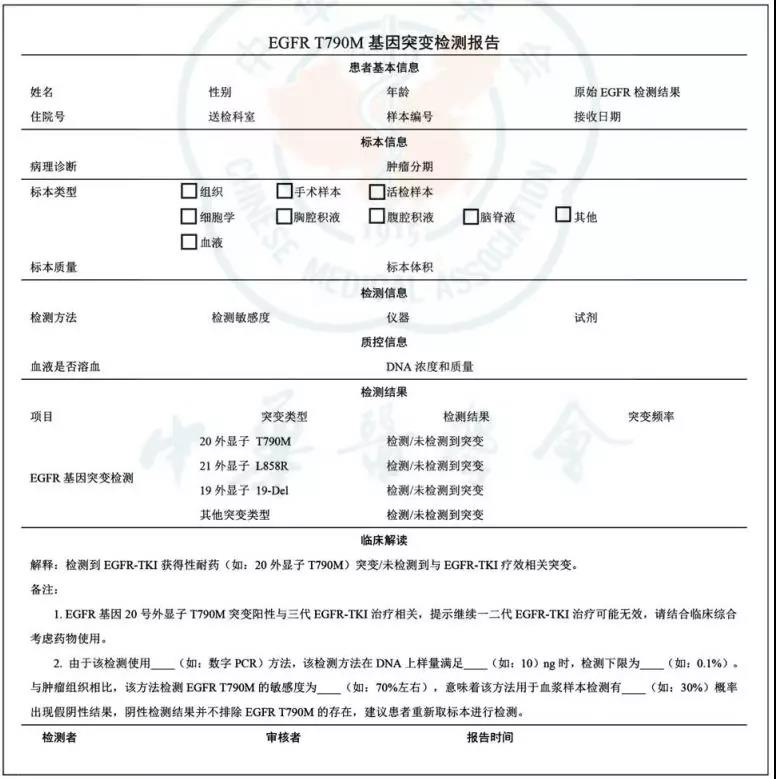 ▲图2 EGFR T790M基因突变检测报告模板
▲图2 EGFR T790M基因突变检测报告模板