| 知识 | 您所在的位置:网站首页 › 简单立方晶格常数如何计算公式 › 知识 |
知识
|
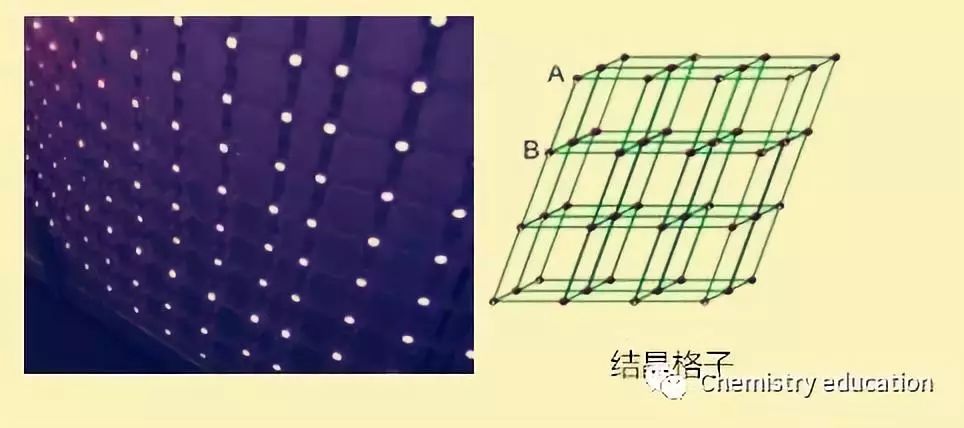
(4)晶体可以使X光发生有规律的衍射。宏观上能否产生X光衍射现象,是实验上判定某物质是不是晶体的主要方法。 (5)晶体相对应的晶面角相等,称为晶面角守恒。 晶体按其结构粒子和作用力的不同可分为离子晶体、原子晶体、分子晶体、金属晶体等四大典型晶体。 02 二、什么是晶格? 晶体内部原子是按一定的几何规律排列的。为了便于理解,把原子看成是一个球体,则金属晶体就是由这些小球有规律堆积而成的物体。为了形象地表示晶体中原子排列的规律,可以将原子简化成一个点,用假想的线将这些点连接起来,构成有明显规律性的空间格架。这种表示原子在晶体中排列规律的空间格架叫做晶格,又称晶架。
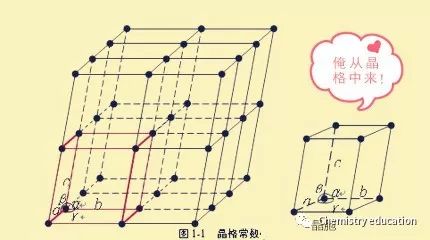
为了清楚的表明原子在空间的排列规律,人为地将原子看作一个点,再用一些假想线条,将晶体中各原子的中心连接起来,便形成了一个空间格子,这种抽象的、用于描述原子在晶体中规则排列方式的空间几何图形称为结晶格子,简称晶格。晶格中的每个的点称为结点。晶格中各种不同方位的原子面,称为晶面。 03 三、什么是晶胞? 构成晶体的最基本的几何单元称为晶胞(Unit Cell),其形状、大小与空间格子的平行六面体单位相同,保留了整个晶格的所有特征。晶胞是能完整反映晶体内部原子或离子在三维空间分布之化学-结构特征的平行六面体最小单元。其中既能够保持晶体结构的对称性而体积又最基本特称"单位晶胞",但亦常简称晶胞。
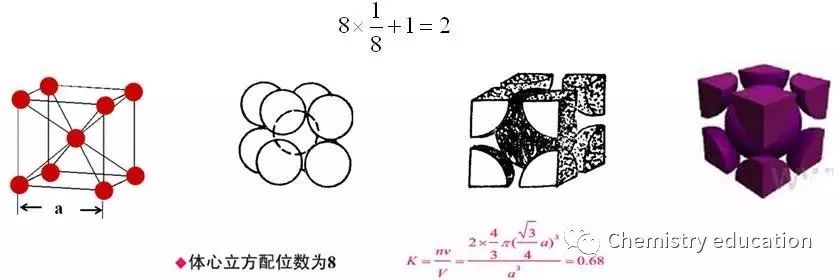
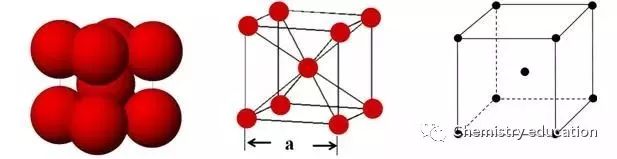
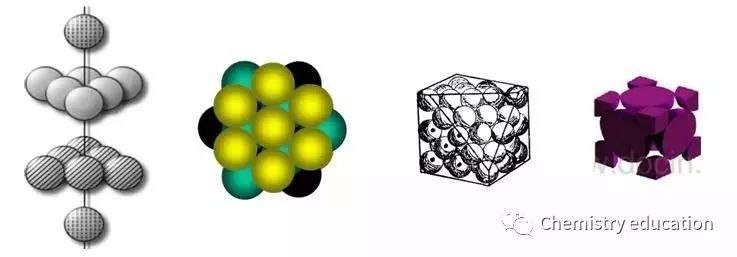
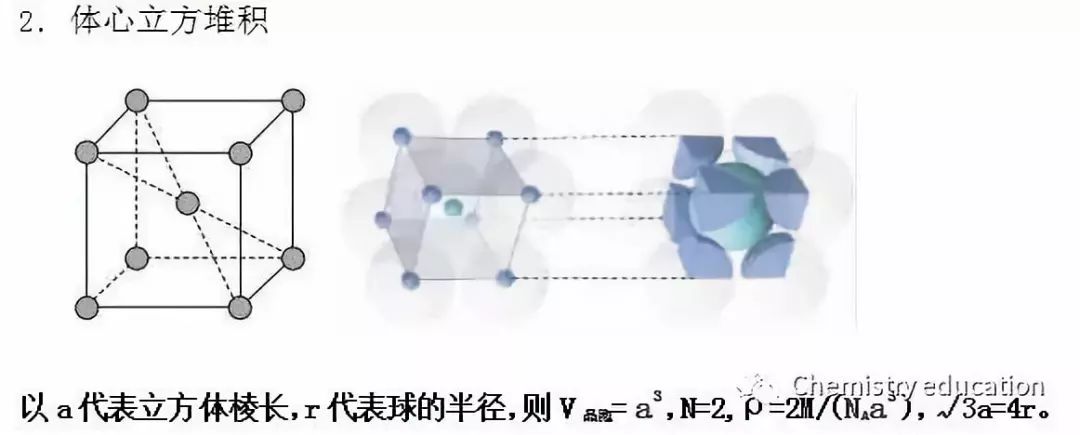
一般情况下,晶胞都是平行六面体。整块晶体可以看成是无数晶胞无隙并置而成的。 04 四、等径圆球的堆积方式有哪些? 原子和离子都具有一定的有效半径,因而可看成是具有一定大小的球体。金属晶体可被理解为数目很大的正离子圆球的堆积和一群自由电子的结合体;对于离子晶体(不考虑极化),离子间的结合可看成是球体的相互堆积(球径大的先堆积,球径小的再填充),并且为使引力和斥力达到平衡,使晶体具有最小内能,要求离子间作最紧密堆积。简而言之,类似于等径圆球的堆积。 1.等径球体的次紧密堆积 (1)体心立方堆积 等径球体还有另一种堆积方式,虽不是最紧密的,但是一种有效的和对称的——体心立方结构堆积。 第一层:排列面近似于密排面,每个原子与四个最邻近原子相接触; 第二层:放置于第一层的凹坑处; 第三层:重复第一层的排列方式。如此堆积,质点就按体心立方格子分布,在这种堆积方式中可找出体心立方晶胞。
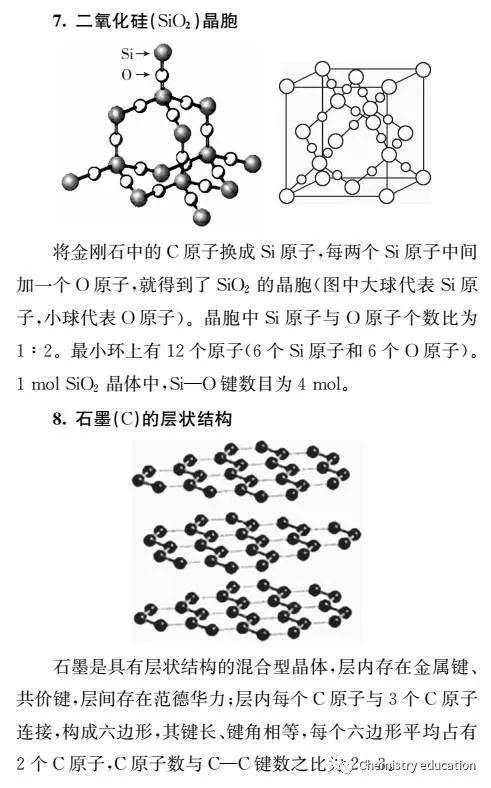
体心立方结构的堆积,即在体对角线上球互相接触。空间利用率是68%,空隙为32%。配位数是8。晶格中原子坐标为[0,0,0],[1/2,1/2,1/2]。晶胞中原子数为2。
常见体心立方结构的有α-Fe、V、Cr、Nb、Mo、Ta、W、Ba及碱金属Li、Na、K、Rb、Cs等。
(2)简单立方堆积 第一层球,每个球与周围4个求相接触;第二层球的位置与第一层球重合……
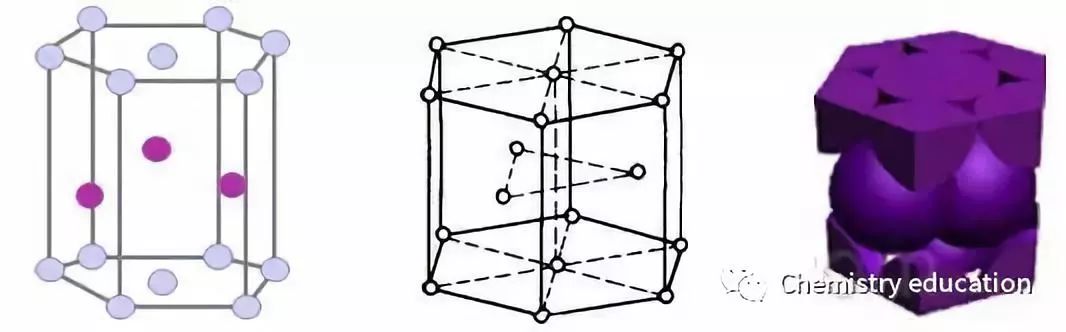
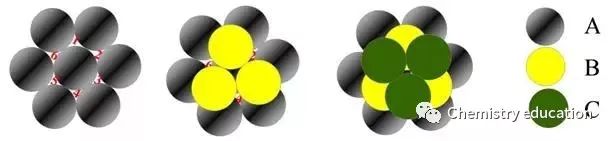
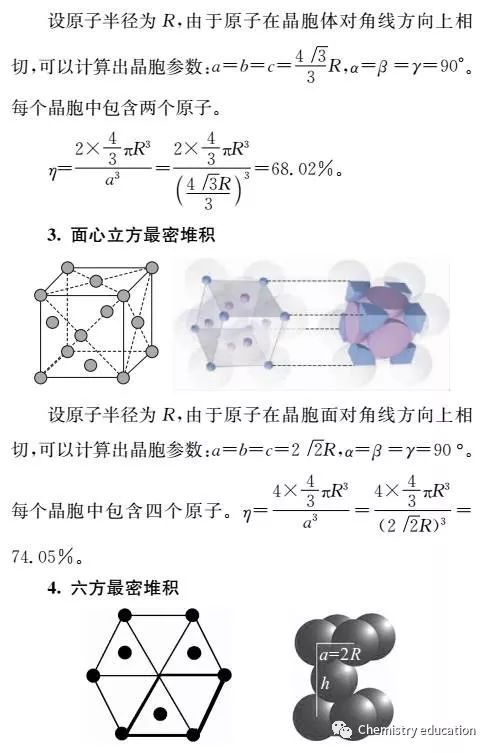
球和球在棱上互相接触。空间利用率为52%。 2.等径球体的最紧密堆积 等径球体的最紧密堆积方式有两种:六方和立方最紧密堆积。 (1)六方最紧密堆积方式 第一层(A):各球在同一平面上彼此尽量靠拢,每个球相邻有六个球,每三个球之间形成一个三角形空隙,一半尖角向下,另一半尖角向上; 第二层(B):球体放在第一层球面的空隙上,中心落在尖角向下的三角形空隙上(也可落在尖角向上的三角形空隙上)。 第三层:重复第一层的排列方式。
六方最紧密堆积的排列层序是:ABABAB……每两层重复一次。将这些球的球心联结起来,便形成六方原始格子,即在这种堆积中可找出六方晶胞,故称为六方最紧密堆积。
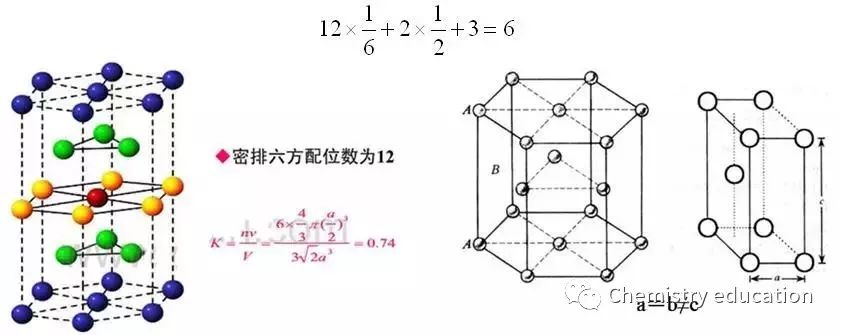
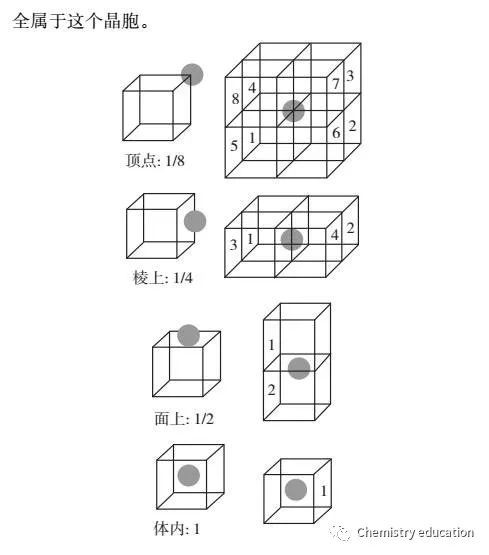
Zn、Mg、Li等是常见的六方最紧密堆积(密排六方结构)的金属,原子分布除了简单六方点阵的每个阵点[0,0,0]上有原子外,在六方棱柱体内还有3个原子。如用平行六面体坐标表示,其坐标为[1/3,2/3,1/2]或[2/3,1/3,1/2]。在六方柱晶胞中,顶点的每个原子为6个晶胞所共有,上下底面中心的原子为2个晶胞所共有,所以六方柱晶胞所包含的原子数为:
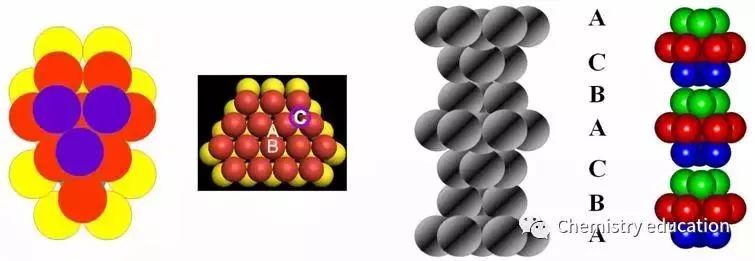
具有hcp结构的元素晶体有:Be、Mg、Sc、Y、Ti、Zr、Zn、Cd和大多数稀土金属Gd、Tb、Dy、Ho、Er、Tm、Lu。 (2)面心立方最紧密堆积方式 第一层(A)和第二层(B)球体与六方密堆方式相同; 第三层(C):球体放在第一层球间的另外三个相应的空隙上(即尖角向上的三角形空隙C处)的位置上,与第二层球相互交错,使三层球的排列方式并不重复。而是第四层与第一层重复。
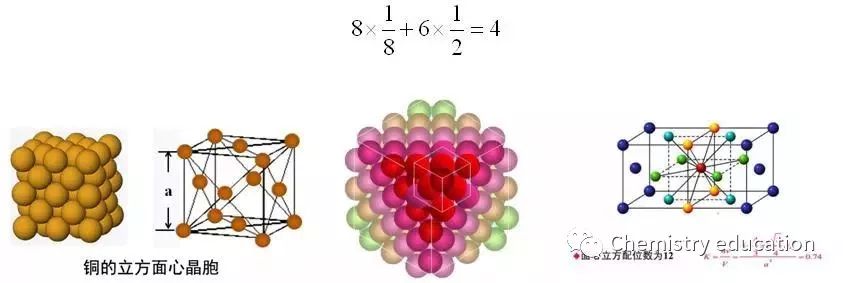
面心立方最紧密堆积的排列层序是:ABCABC……, 即每三层重复一次。在这种堆积方式中可以找出面心立方晶胞,其中的相当点按面心立方格子分布,所以称为面心立方最紧密堆积。
常见面心立方的金属有Cu、Au、Co、Pt、Al、Sc、Ca、Sr、及固态稀有气体Ne、Ar等,晶格结构中原子坐标分别为[0,0,0],[0,1/2,1/2],[1/2,0,1/2],[1/2,1/2,0]。晶胞中所含原子数为4。
05 五、关于晶胞的计算有哪些?
(四)、晶胞密度计算 原理:密度ρ=m / V,在晶胞中,若用m球表示晶胞中粒子(原子、分子或离子)的总质量,V晶胞表示晶胞的体积,则密度ρ=m球/ V晶胞; 若用m0表示每个粒子的质量,则m0=M/NA(M代表粒子的摩尔质量,NA代表阿伏伽德罗常数),用N表示晶胞中粒子的个数,则m球=Nm0=NM / NA,晶胞的体积V=S×h(S为平行六面体底面积,h为底面上的高), 则ρ=NM /(NASh)。 利用此公式,若知道晶胞参数(平行六面体棱长与夹角),则可以计算密度,若知道密度,则可以计算晶胞参数;若知道平行六面体棱长和粒子半径的关系,进而可以求粒子半径。 以金属晶体四种晶胞为例:
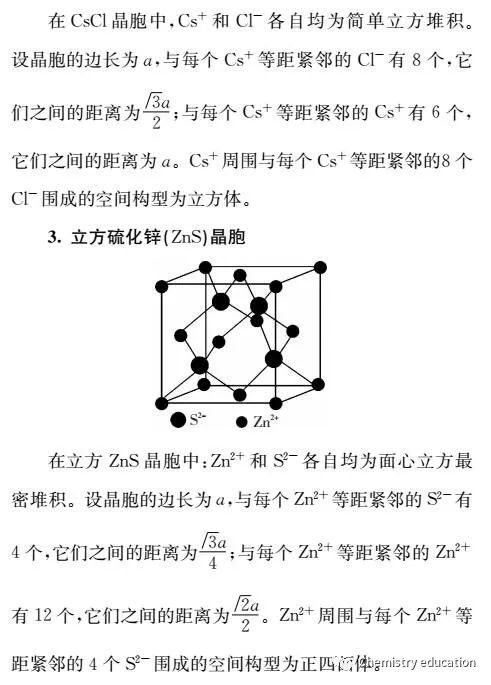
注:晶胞中棱长半径关系请参照晶胞计算之空间利用率 附:在晶体结构报告中常按照化合物中各类原子的种类与数目参照晶体的化学性质进行分类,并用英文字母命名,科学文献中常使用这种分类,介绍如下: A代表元素晶体。 A1面心立方结构(Cu) ; A2为体心立方(W) A3 密堆六方结构(Mg) ; A4 金刚石结构 B代表AB型化合物。 B1 NaCl型结构 ; B2 CsCl型结构 B3闪锌矿型结构 ; B4 纤锌矿型结构; C代表AB2型化合物 C1萤石及反萤石结构(CaF2) ; C2 黄铁矿FeS2 C3 赤铜矿(Cu2O) 其中每一小类都代表着许多结构基元排列相同、空间群相同的晶体。 参考文献:《无机化学》、《物质结构》、《教学考试》。返回搜狐,查看更多 |
【本文地址】