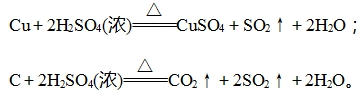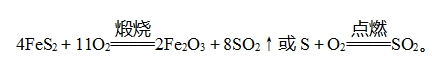| 硫酸 | 您所在的位置:网站首页 › 稀硫酸和锌反应的化学方程式 › 硫酸 |
硫酸
|
硫酸知识点包括硫酸的物理性质、稀硫酸与物质反应的离子方程式、浓H2SO4的特性、工业制备硫酸的反应原理、硫酸的用途、硫酸根离子的检验等部分,有关硫酸的详情如下: 硫酸的物理性质和化学性质1.物理性质:H2SO4是无色液体,能与水以任意比互溶,溶解时可放出大量的热,浓H2SO4稀释的方法是将浓H2SO4沿烧杯内壁缓缓注入蒸馏水中,且用玻璃棒不停地搅拌。 2.化学性质: 稀硫酸——具有酸的通性 ①电离方程式为 ②硫酸具有酸的通性,可与酸碱指示剂作用,也可与活泼金属、碱、碱性氧化物及某些盐反应。 稀硫酸与物质反应的离子方程式(1)铁:Fe+2H+ (2)MgO:MgO+2H+ (3)Ba(OH)2:Ba2++2OH-+2H++SO4(2-) (4)Na2SO3:SO3(2-)+2H+ (5)BaCl2:Ba2++SO4(2-) (1)填写下表
(2)分别写出浓硫酸与Cu、C反应的化学方程式:
(3)常温下,铁、铝遇浓H2SO4钝化,可用铝(或铁)槽车运输浓硫酸。 工业制备硫酸的反应原理(1)煅烧硫铁矿(FeS2)或硫制备SO2
(2)SO2转化为SO3 (3)SO3吸收生成H2SO4 用98%的浓硫酸吸收SO3,以免形成酸雾。 硫酸的用途(1)制取化肥、硫酸盐、挥发性酸。 (2)消除金属表面的氧化物。 (3)用于精炼石油,制造炸药、农药、染料等,是实验室里常用的试剂。 硫酸根离子的检验在实验室里,通常将溶液先加稀盐酸酸化,以排除CO3(2-)、Ag+等可能造成的干扰,然后加入BaCl2溶液来检验SO4(2-)的存在 |
【本文地址】
公司简介
联系我们