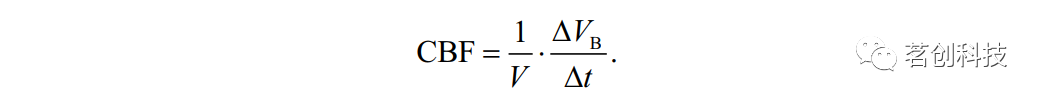| 功能性磁共振成像的基础知识(总结篇) | 您所在的位置:网站首页 › 磁共振检查原理及技术 › 功能性磁共振成像的基础知识(总结篇) |
功能性磁共振成像的基础知识(总结篇)
|
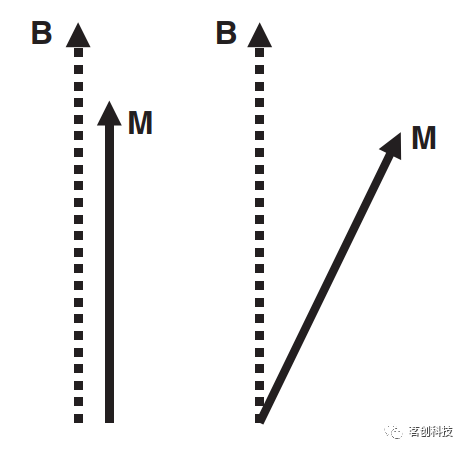
磁共振成像的基础知识 外磁场中的自旋 磁共振成像(MRI)是利用氢原子的核内质子进行成像。质子具有一种物理特性,即自旋,其行为大致类似于一根罗盘针:每个自旋都有一个小的磁偶极矩,并在外部磁场中对齐。如果将组织置于磁共振(MR)扫描仪孔内的强磁场中,则自旋将与磁场B反平行或平行排列。在此处相关场强中,极少数自旋呈后一种排列方式,它们的磁矩加起来,产生了与B平行的净宏观磁化强度M,代表一种平衡状态(图1左)。因此,磁场内部这种磁化的存在是质子存在的标志,可以通过测量具有一定空间分辨率的M来构建质子图像。
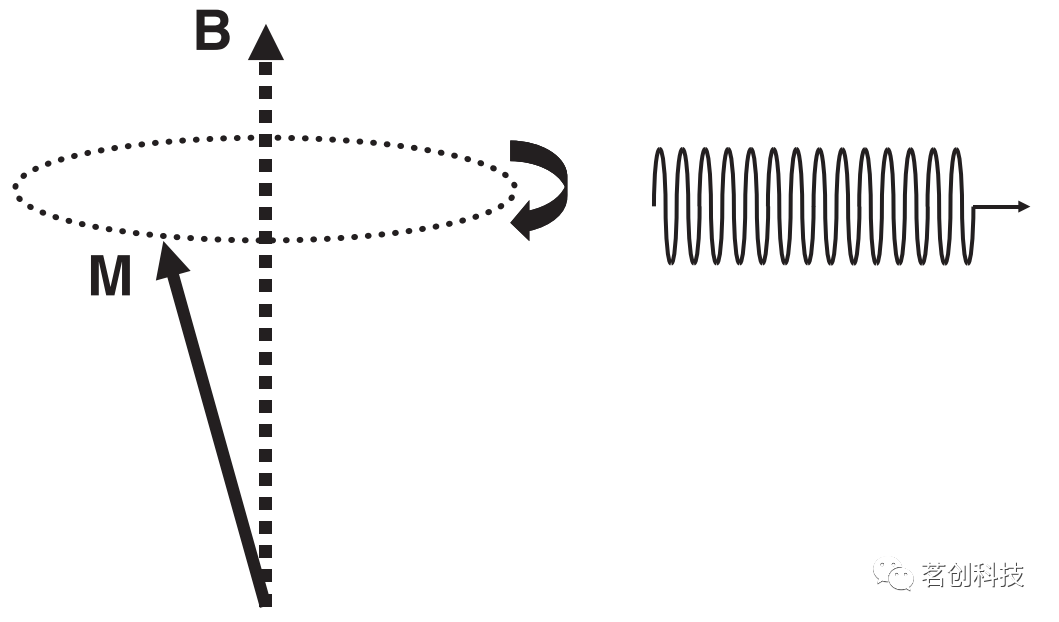
图1.自旋在外部磁场B中对齐,产生与B平行的宏观磁化强度M(左)。如果磁场B内的质子暴露在拉莫尔频率的电磁波中,则磁化强度M是倾斜的(右)。 磁共振效应 由于以下物理效应,对M的测量是可能的:如果磁场B内的质子暴露在特定频率的电磁波中,所谓的拉莫尔频率,即磁化强度M,与暴露持续时间成比例倾斜(图1右)。然后倾斜的磁化围绕磁场矢量旋转(图2)。这种运动称为进动,类似于普通的陀螺旋转行为。在进动期间,质子发出具有拉莫尔频率的电磁波(图2)。重点是,拉莫尔频率与磁场B成正比,值为42.6MHz/Tesla,其中特斯拉(T)是磁场强度的单位。因此,对于通常场强为1.5T或3T的临床MR扫描仪,拉莫尔频率分别约为64MHz或128MHz。需要注意的是,倾斜的磁化逐渐恢复到其原始状态或平衡。这种效应称为弛豫,将在下文进行讨论。
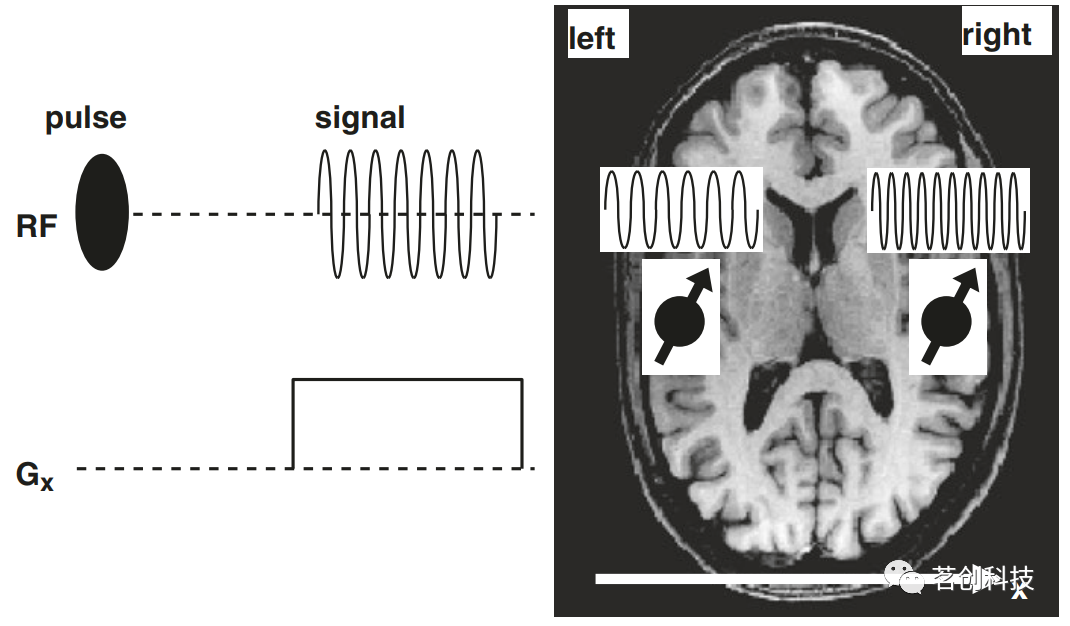
图2.倾斜的磁化围绕磁场矢量旋转,发出拉莫尔频率的电磁波。 MR空间编码 如前所述,MR效应仅允许检测质子的存在。现在存在的问题是,如何实现整个样本中质子的空间分辨率,从而产生图像。接下来,将逐步讨论相对于大脑定义的三个正交方向:x(左/右),y(前/后)和z(上/下)。 ①频率编码 图3(左)显示了所谓的脉冲图,即MR实验的示意图。在RF(射频)轴上,有一个初始电磁脉冲,它使磁化和随后获得的信号倾斜。下面是梯度轴,显示信号采集过程中梯度Gx已打开。这意味着在采集过程中,磁场以一种在x方向上线性增加的方式变化。因此,在采集过程中,质子的拉莫尔频率取决于它们在大脑中的位置,即它们的x坐标。图3(右)显示了两个小的大脑区域以及这些区域内的质子在梯度开启时发出的信号:左侧区域中的质子暴露在略微减弱的磁场中,因此它们发出的电磁波频率略低。右侧区域中的质子发出的信号频率较高。“FM调频”检测来自所有质子的总和信号。该信号经过频率分析(在数学上,此过程称为傅里叶变换),得到信号的频谱。然后可以从信号的频谱中推断出质子的确切位置(或至少是它们的x坐标)。因此,这个过程称为频率编码。在信号采集(或信号“读出”)期间打开的梯度称为读取梯度。应该注意的是,该梯度仅在采集期间打开,而不是在初始RF脉冲期间打开。否则,在发送电磁波时,自旋将具有不同位置依赖性的拉莫尔频率,因此磁化作用将只对部分自旋倾斜。利用磁场梯度来实现空间分辨率是由Lauterbur(1973)首先提出的。
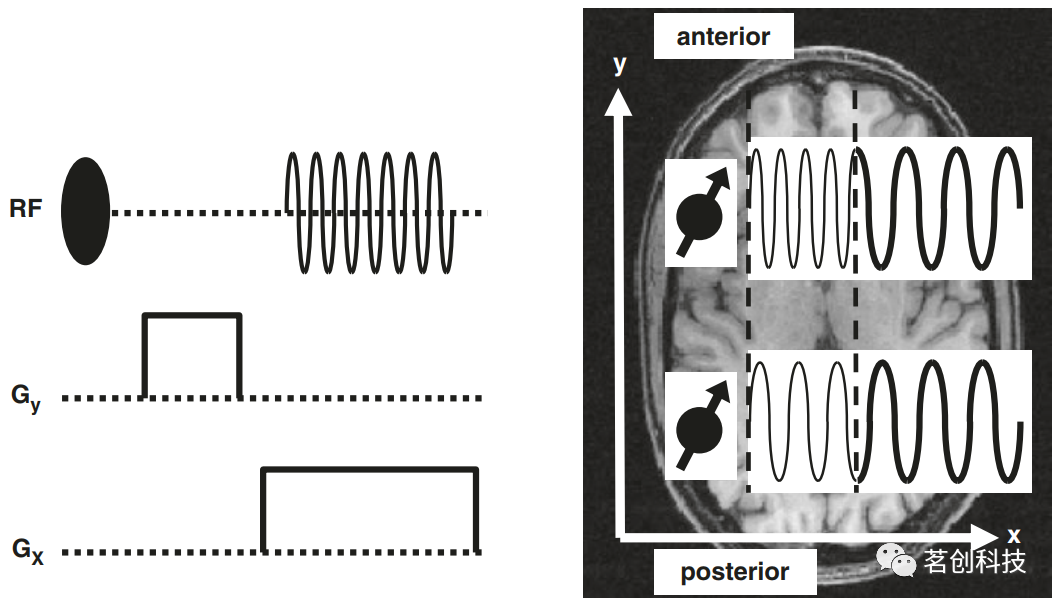
图3.频率编码的概念。 ②相位编码 上述实验仅允许在一个方向上进行空间分辨率。二维实验如图4所示,这里的脉冲图包括一个射频(RF)轴和两个梯度轴(分别用于x和y方向的梯度)。该实验的部分内容与上文所述相同:初始RF脉冲使磁化倾斜,并在读取梯度Gx打开时采集信号,因此可以从质子的信号频率推导出质子的x坐标。此外,在初始RF脉冲和采集过程之间接开启一个垂直于读取梯度方向的梯度,即Gy。图4(右)解释了这种梯度对x坐标相同但y坐标不同的两个脑区的影响:当梯度Gy打开时,前部区域的质子比后部区域的质子具有更高的拉莫尔频率。对拉莫尔频率的影响只在Gy打开时持续。一旦Gy被关闭,Gx被打开,来自两个区域的信号具有相同的拉莫尔频率,因为它们具有相同的x坐标。然而,前部和后部区域信号的起点是不同的:如图4所示,在采集开始时,前部区域信号的值最大,而后部区域信号的值最小。因此,信号在时间上出现了移位——它们具有不同的相位。总之,x坐标可以由信号频率推导出来,y坐标可以由信号相位推导出来。梯度Gy称为相位编码(PE)梯度,在自旋激励和信号采集之间切换成像梯度的过程被称为PE。需要注意的是,精确地确定y坐标需要采用不同的PE梯度重复图4所示的实验。因此,在完整的成像实验中(如图8所示),PE梯度(即y方向的梯度)被描绘成带有箭头的“阶梯”,反映了不同的PE梯度振幅。
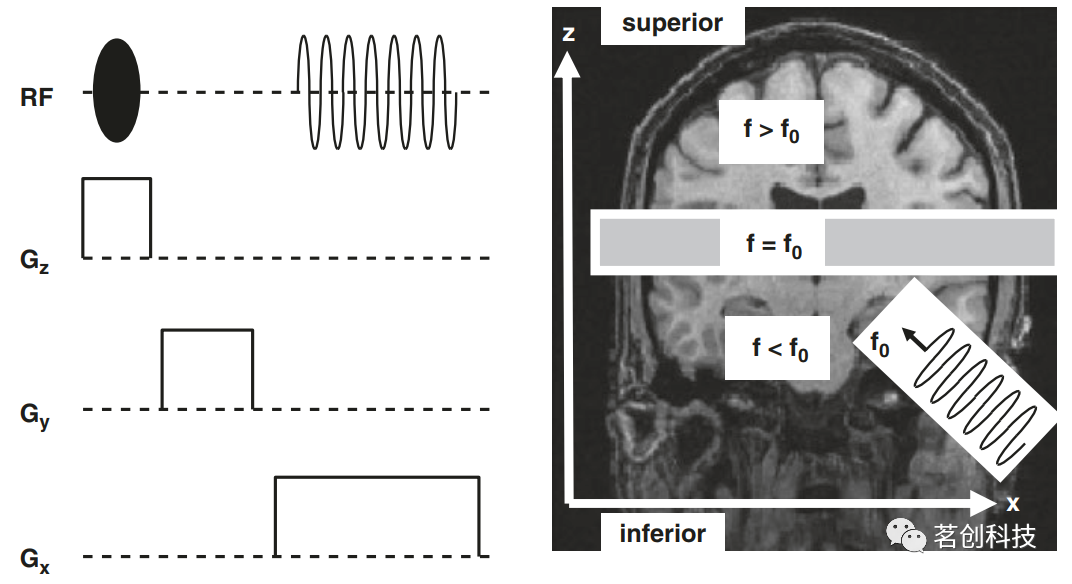
图4.相位编码(PE)的概念。 ③层面选择 图5显示了三个方向上的空间分辨率实验。相对于上述实验,该实验包括一个相位梯度和一个读取梯度。然而,这次梯度Gz在实验开始时打开,并在RF脉冲传输期间保持打开状态。由于这个梯度,磁场强度和质子的拉莫尔频率在这个方向上增加。假设在某个轴向层面内,拉莫尔频率为f0(图5右)。如果发送具有此频率的RF脉冲,它将只使该层内的磁化倾斜。它不能影响大脑上部或下部的质子,因为它们的拉莫尔频率高于或低于f0,所以没有共振。因此,只有选定层内的质子被倾斜(或“激励”),并且可以对信号产生影响。总之,RF脉冲和梯度的组合会导致层面选择性激励。梯度Gz也被称为层面梯度或层面选择梯度。然后,利用读取梯度Gx和相位梯度Gy来实现受激励层内的空间编码。针对不同的激励频率重复此过程,以获取多层图像数据集。
图5.层面选择的概念。 弛豫时间T1和T2 当RF脉冲使磁化矢量倾斜后,就会发生进动,如图2所示。然而,如前所述,进动的持续时间有限:一段时间后,磁化强度再次平行于静态磁场,即处于平衡状态。这个过程称为弛豫。弛豫包括两个同时进行的过程,如下所示。 倾斜磁化强度的纵向分量(即平行于磁场的分量)随着时间常数T1(即纵向弛豫时间)趋近最大值(所谓的平衡值)。这个过程也被称为自旋-晶格弛豫,因为自由水自旋将能量传递到周围的环境,即晶格。 倾斜磁化强度的横向分量(即垂直于磁场的分量)随着时间常数T2(即横向弛豫时间)而消失。这个过程也被称为自旋-自旋弛豫,因为它是由自由水自旋交换少量能量引起的。 在人脑中,有很多不同的T1值:在3T时,近似T1值为850ms(白质(WM));1300ms(灰质(GM));和4500ms(脑脊液(CSF))。因此,利用T1对比度的MRI采集序列通常用于可视化和量化大脑形态。T1加权技术的例子包括T1加权自旋回波序列、T1加权快速梯度回波序列(如FLASH)和磁化制备序列(如MP-RAGE和MDEFT)。需要注意的是,T1值是场依赖的。例如,白质/灰质中的T1值在1.5T时约为650/1100ms,但在7T时约为1200/2000ms。 对于T2,白质和灰质之间的对比度较小,3T时脑组织的值约为60ms,在苍白球等富铁区域的值约为45ms。然而,脑脊液具有很长的T2值(约2000ms),这提供了一种区分脑组织和水肿等液室的方法。因此,T2加权采集技术(如T2加权自旋回波序列)常被用于检测病变。 弛豫时间T2*和梯度回波 图6显示了在模体(在本例中为装满水的玻璃球)上获取的一系列MR图像。一小块金属牢固地固定在模体的外部(红色箭头)。金属在其周围环境(圈出的区域)中有使静态磁场变形的作用。随着回波时间(TE)值的增大进行图像采集,TE是初始RF脉冲与信号采集之间的时间差(见图8左)。第一个需要注意的效应是,模体信号随着TE的增加而降低。这是可以预期的,因为产生信号的横向磁化强度由于横向弛豫效应而衰减。第二个效应是,在磁场失真的区域,信号衰减要快得多。这可以解释为:由于场不均匀性,空间中不同位置的自旋所处的场强不同,因此会有不同的拉莫尔频率。因此,自旋移相——即它们的磁化矢量以不同的速度旋转,从而指向不同的方向,因此它们对净磁化的贡献相互抵消,导致信号快速衰减。一般来说,可以说任何不均匀的静态磁场都会有类似的效应,导致信号衰减加速。因此,信号随有效(表观)横向弛豫时间T2*而衰减,该时间取决于场的不均匀程度,并且可能比T2短得多。
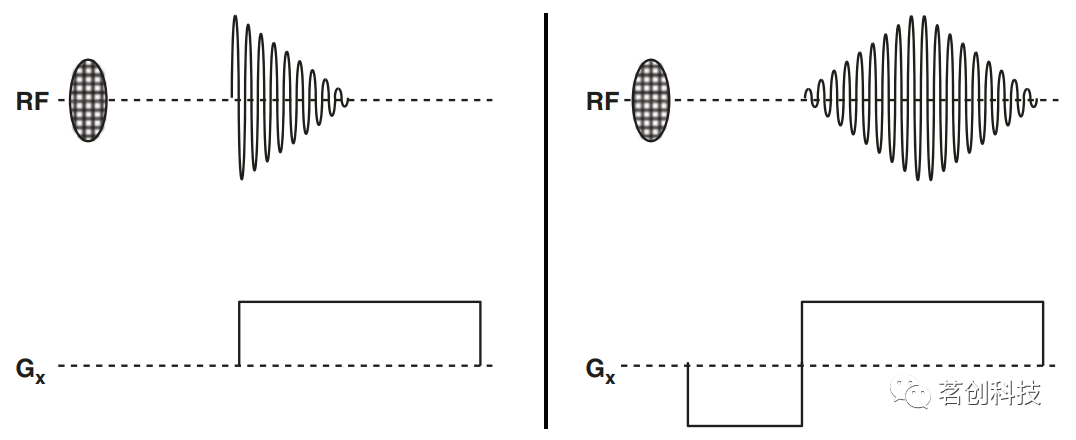
图6.在具有不同回波时间(TE)的水模体上采集的一系列图像。 这给目前讨论的MRI方法带来了一个特定的问题。如上所述(见图3),频率编码是通过在一定的空间方向上切换梯度来实现的。由于梯度是人造磁场的不均匀性,这将导致信号加速衰减(图7左)。特别是,最大信号出现在梯度的起始处时。然而,这部分信号可能会提供错误的空间信息,因为梯度需要一定的切换时间才能达到稳定值。这个问题可以通过使用图7右所示的梯度回波概念来避免:在采集之前,先打开负梯度,导致自旋移相。由于随后的正读梯度只是前一个梯度的反转,即移相效应被反转,因此自旋复相,产生一个强信号,称为梯度回波。重要的是,梯度回波的最大值位于读取梯度达到稳定值的时间点。梯度回波方法被广泛应用于功能成像方面。
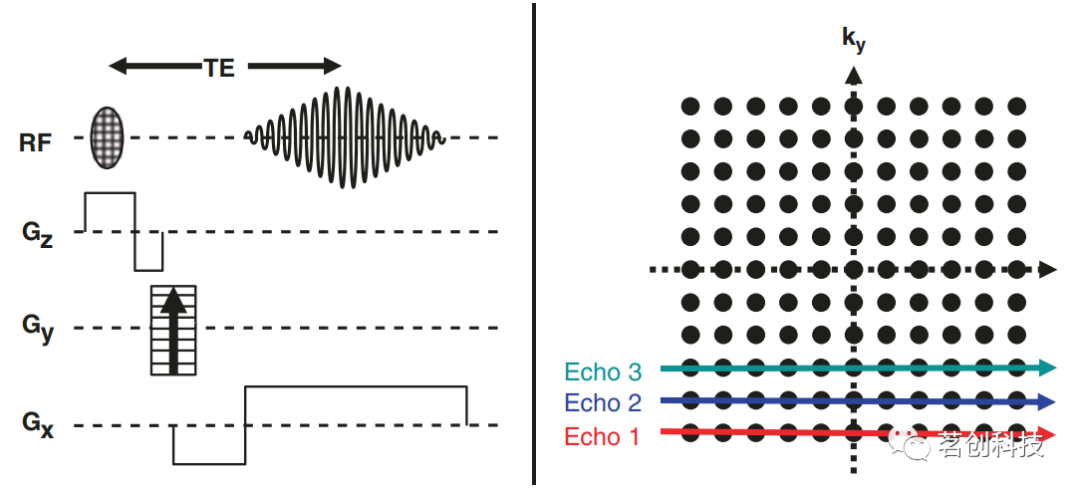
图7.(左)在梯度存在的情况下,由于梯度构成了磁场的不均匀性,信号会迅速衰减。(右)梯度回波概念:初始负梯度导致自旋移相。在梯度反转后,此过程被反转(复相),称为梯度回波。 图8(左)显示了典型的梯度回波成像序列。在采集之前,x方向上的负梯度会导致自旋移相。当正读梯度打开时,会发生自旋复相和梯度回波。此外,在层面梯度之后打开一个负梯度,以补偿由于该梯度而造成的移相效应,否则会降低信号强度。应该注意的是,在梯度回波技术中,自旋移相补偿只发生在反转的梯度上。所有其他场的不均匀性会引起额外的自旋移相,从而降低T2*值。因此,梯度回波图像经过T2*加权后,由于静态磁场的局部不均匀性,在T2*降低的区域显示出较低的图像强度。
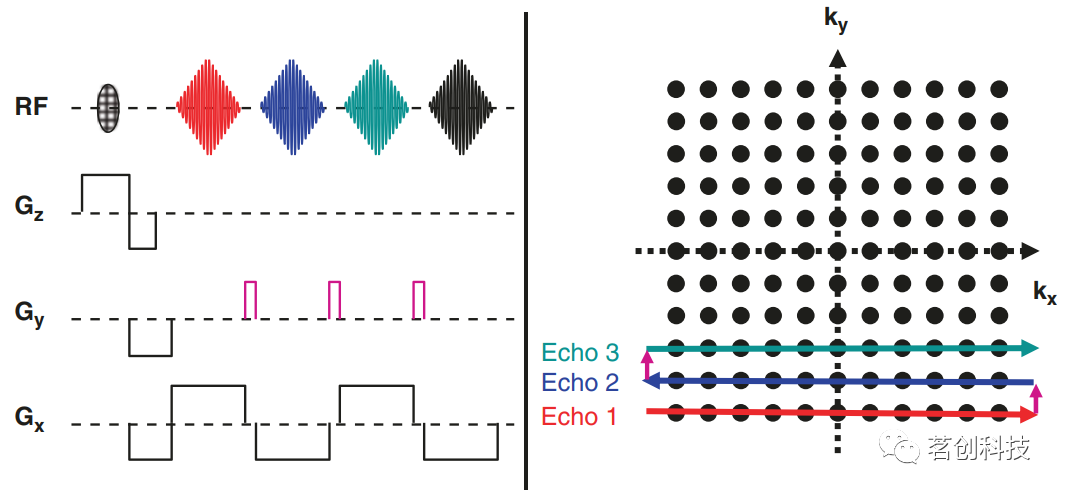
图8.(左)一个完整的梯度回波成像实验。(右)梯度回波实验的k空间覆盖示意图。 回波时间(TE)的选择决定了T2*的对比度:如果TE太短,则自旋没有足够的时间移相,因此T2*加权较差。另一方面,如果TE比T2*长得多,那么信号在采集开始时就已经衰减了,因此图像的信噪比(SNR)会很差。当TE近似于T2*时,则可实现最佳T2*加权。梯度回波技术对于功能成像研究非常重要,因为神经元激活会导致周围脑组织中T2*的微小变化,从而导致T2*加权梯度回波图像的强度变化。这种效应被称为血氧水平依赖效应(BOLD)。 k空间 k空间是一个数学概念,对于描述MR采集序列非常有用,特别是回波平面成像序列,它是功能磁共振成像(fMRI)的主选方法。假设获取了单个数据点,例如,其中一个数据点形成了梯度回波。在采集该数据点和前一个RF激励脉冲之间,梯度Gx(在读取方向上)和梯度Gy(在相位方向上)被开启一定的持续时间。然后,数据点的k值kx和ky被定义为相应梯度下的面积(即梯度强度和梯度持续时间的乘积)。对于任何一个特定的MR成像实验,都必须获取多个不同kx和ky组合的数据点,以覆盖完整的2D k空间,如图8(右)所示。对于图8(左)所示的实验,k空间用水平线覆盖,从左到右依次填充每一行。 回波平面成像(EPI) 图8(左)所示的梯度回波序列是相对耗时的,主要是因为每个新的PE梯度重复都需要自己的层面选择激励脉冲。为了克服这一限制,目前已经开发了专门的梯度回波技术,例如单次激发EPI。EPI的示意图见图9(左)。在层面选择激励后,通过读取梯度的连续反演得到一系列梯度回波。在连续的采集之间,y方向上有一个短暂的梯度脉冲,即所谓的blip。因此,特定回波的PE程度由y方向上的初始负梯度和到回波采集时间的光点之和给出。总之,这满足了上述成像条件(在打开x方向读取梯度的情况下进行一系列采集,并且在每次采集之前都有不同程度PE的y方向相位梯度),因此可以从采集的数据中构建完整的图像。由于只有一个激励脉冲,因此该技术非常快,每层的采集时间不100ms。梯度回波EPI图像重T2*加权,在受局部磁场不均匀性影响的区域显示图像强度降低。T2*加权和采集速度使该技术非常适合于功能性MRI。
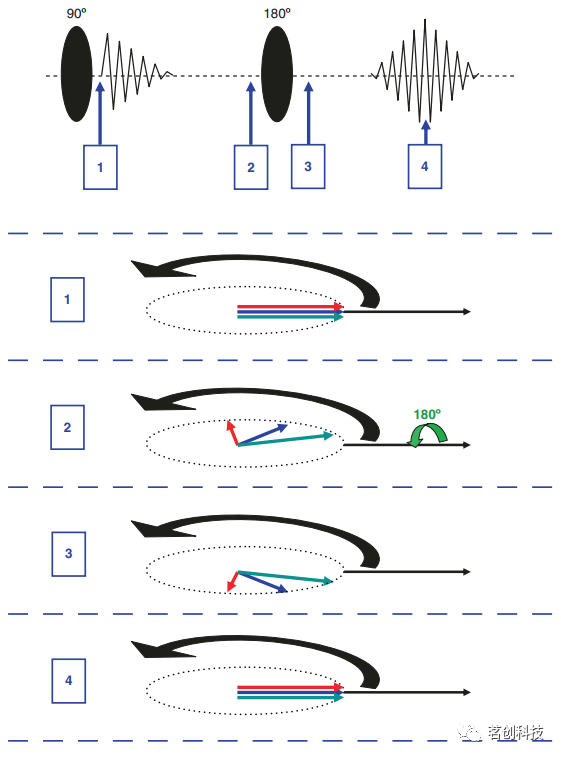
图9.(左)单次回波平面成像(EPI)的示意图。(右)EPI的k空间覆盖示意图。 k空间分析相对简单:对于第一个回波,数据点的kx值不断增加,范围从负值到正值不等,而由于前面的PE梯度Gy为负, ky值仍然为负值。因此,该回波覆盖了k空间中最底部的水平线,如图9(右)所示。对于第二个回波,ky由于中间的blip而增加。这个回波的kx值从正到负,所以这个回波覆盖了k空间中的下一条水平线,但顺序相反。综上所述,可以说EPI中的k空间被水平线覆盖,奇数行从左到右依次填充,偶数行从右到左依次填充。这种允许快速数据采集的k空间行填充顺序反转也可能产生伪影。 自旋回波 为了完整起见,这里将简要描述自旋回波的发生。基本实验如图10(顶图)所示,一个90°的脉冲使磁化矢量倾斜,在激励后(时间点1)可以直接观察到一个强信号。这个信号随着时间常数T2*衰减。一段时间后,施加一个180°的脉冲(在时间点2和3之间)。结果,信号再次增强(时间点4)。这种效应被称为自旋回波,可以解释如下(图10底图)。在激励后(时间点1),所有自旋对齐,形成一个强信号。然而,它们开始旋转(黑色箭头),通常由于场的不均匀性而具有不同的拉莫尔频率。为简单起见,假设有三个自旋组合:“快速的”(红色),“适中的”(蓝色)和“缓慢的”(绿色)。一段时间后(时间点2),“快速”自旋相对超前,而“缓慢”自旋则相对滞后。因此,自旋移相,信号衰减。180°脉冲围绕初始对准轴旋转(绿色箭头)。这导致了一系列(时间点3)根本性的变化:“快速”自旋现在落后了,而“缓慢”自旋则领先了。然而,进动的方向保持不变(黑色箭头),因此“快速”自旋迎头赶上,一段时间后(时间点4),自旋重新对齐,再次形成一个强烈的信号,即自旋回波。此过程补偿了所有场不均匀性的影响,因此自旋回波是T2加权的(与梯度回波相反,梯度回波是T2*加权)。
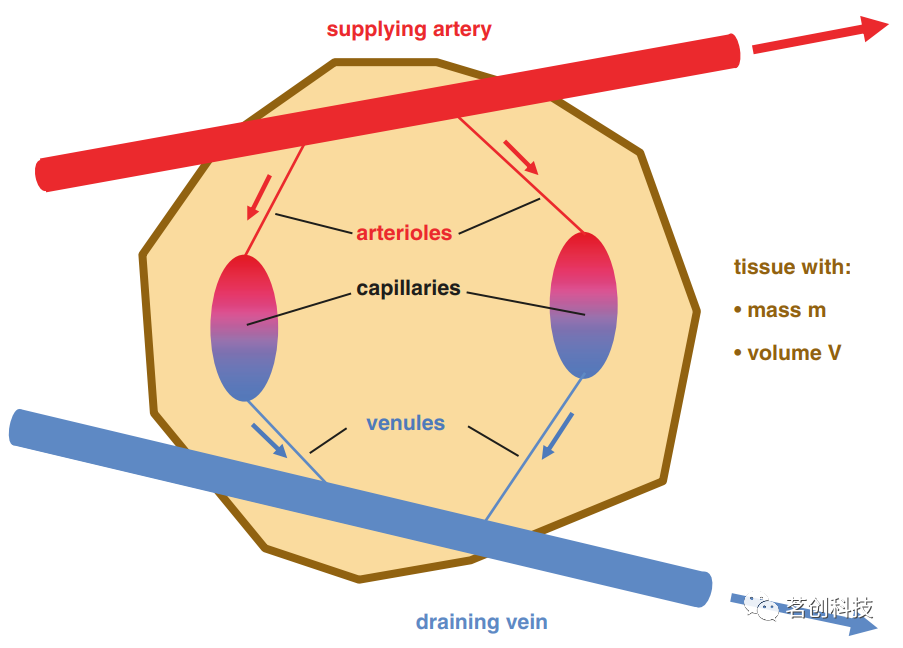
图10.自旋回波效应的示意图。 如上所述,T2加权自旋回波序列在临床实践中被广泛用于病变检测。为了缩短实验持续时间,经常使用称为RARE的快速自旋回波序列(也称为涡轮自旋回波序列或快速自旋回波序列)。这个序列基本上类似于上述EPI技术;然而,为了实现T2加权,通过在后续回波之间施加180°脉冲来获得一系列自旋回波(而不是梯度回波)。 比吸收率(SAR) 当在MRI实验中施加RF脉冲时,能量被传递到自旋系统。问题是RF脉冲也会在组织中产生电流,从而导致组织加热。因此,只有一小部分发射的RF能量用于自旋激励,其余部分会引起不必要的加热效应。SAR是组织吸收的射频功率,单位为W/kg。出于安全考虑,SAR不能超过一定的限度。例如,头部上允许的最大平均SAR为3.2 W/kg。SAR在很大程度上取决于所使用的MRI技术。例如,EPI是一种低SAR技术,因为每个成像层只需要一个RF脉冲。相比之下,像RARE(涡轮自旋回波)这样的快速自旋回波技术是高SAR技术,因为需要一系列180°脉冲来产生一系列自旋回波。需要注意的是,SAR值随着扫描仪磁场强度的增加而增加。由于拉莫尔频率较高以及组织电导率随频率增加,更大比例的能量被转化为热量。因此,在高场强扫描仪上运行高SAR序列可能很困难。 脑血流量(CBF) 脑灌注或CBF是对动脉血和氧气输送到脑组织的测量。例如,CBF的增加是由于神经元活动期间对氧气的需求增加而引起的大脑激活;这种CBF增加导致活动部位的氧合血红蛋白浓度升高,从而产生“BOLD效应”。因此,可以通过测量CBF的变化来确定大脑的激活部位。另一方面,CBF的减少会导致含氧量降低(缺氧),大脑非常容易受到这种情况的影响,严重的情况下会造成脑损伤,例如缺血性卒中。一般来说,CBF是诊断、治疗和理解各种病理状况的关键参数,特别是中风、癫痫、癌症和痴呆。 CBF可以根据动脉血输送到脑组织中特定体积V或质量m(分别以100mL或100g为单位)的毛细血管的速度ΔVB/Δt(以mL/min为单位)来量化,参见图11:
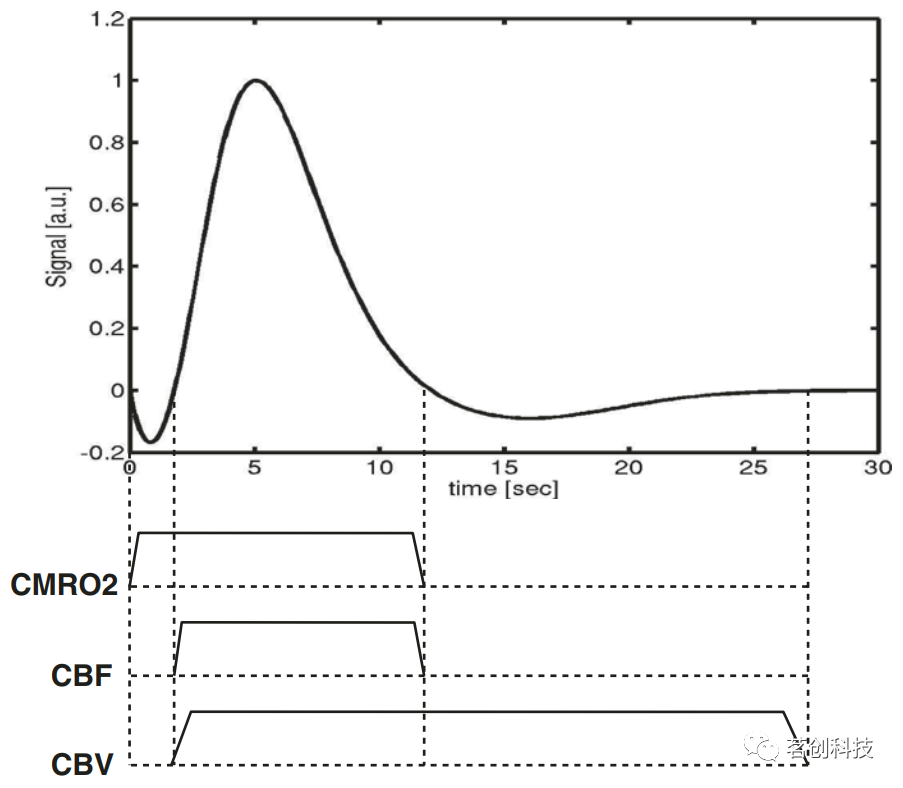
图11.脑血流量(CBF)示意图。 健康成人全脑CBF的近似值为:灰质中为60 mL/100g/min,白质中为20mL/100g/min,虽然文献中发现的数值范围较大。目前测量CBF的MR方法主要有动脉自旋标记(ASL)和动态磁敏感对比(DSC)MRI。 DSC MRI使用顺磁性钆造影剂,通过静脉注射作为示踪剂,因此该方法具有侵入性。造影剂局部缩短弛豫时间T1、T2和T2*。通常通过获取T2或T2*加权图像的时间序列(例如使用EPI序列)来监测造影剂团通过感兴趣组织的情况,因为相应的成像序列具有比T1加权序列更高的时间分辨率。通过分析造影剂团通过的信号时间进程(通常持续时间为几秒钟),可以得到有关CBF、脑血容量(CBV)和平均通过时间(MTT)的信息。 与DSC方法相比,ASL使用反向血液自旋作为示踪剂,并且是完全无创的。时间分辨率约为4min(用于定量高分辨率多层或3D CBF图),可以连续测定CBF。缺点是信噪比低,示踪剂寿命短(随T1衰减)。因此,ASL确实受益于高磁场强度下的测量,这些强度本质上提供了更高的SNR和更长的T1值。与DSC方法相比,非侵入性ASL方法在人体研究中的应用更加广泛。 脑血容量(CBV) 单位组织质量或体积(mL/100g或mL/100mL)的含血容量表示为CBV。在人脑中,灰质的典型值约为5mL/(100mL),白质中约为2.5mL/(100mL)。CBV是正常脑生理和病理生理中的重要参数,它被用作fMRI中大脑活动的测量指标。特别是,直接测量CBV有助于阐明CBF、CBV和血氧之间的复杂相互作用,这是当前大多数fMRI研究中使用的BOLD效应的基础,并且对于定量绘制脑氧代谢率(CMRO2)非常重要。CBV也被用作疾病的标志物,例如,在评估脑血管疾病时。目前,研究人员开发了各种MR方法来测量CBV,这些方法主要分为两大类:使用造影剂的方法和无造影剂的方法(血管空间占用;VASO)。 BOLD效应和fMRI 大多数功能性MR成像研究利用内在的BOLD对比机制。接下来,本文将使用经典的刺激诱导激活模型来解释BOLD效应。图12显示了与外部刺激(任务)或自发大脑活动相关的神经元激活后的典型信号时间过程,即所谓的血流动力学反应。这里将介绍最常引用的模型之一:所谓的气球模型。也有研究者提出了对该模型的扩展,并对神经激活的作用进行了更详细的建模。影响BOLD效应的重要生理参数是脑氧代谢率(CMRO2)、脑血流量(CBF)和脑血容量(CBV)。激活后这些参数的典型时间进程如图12所示。
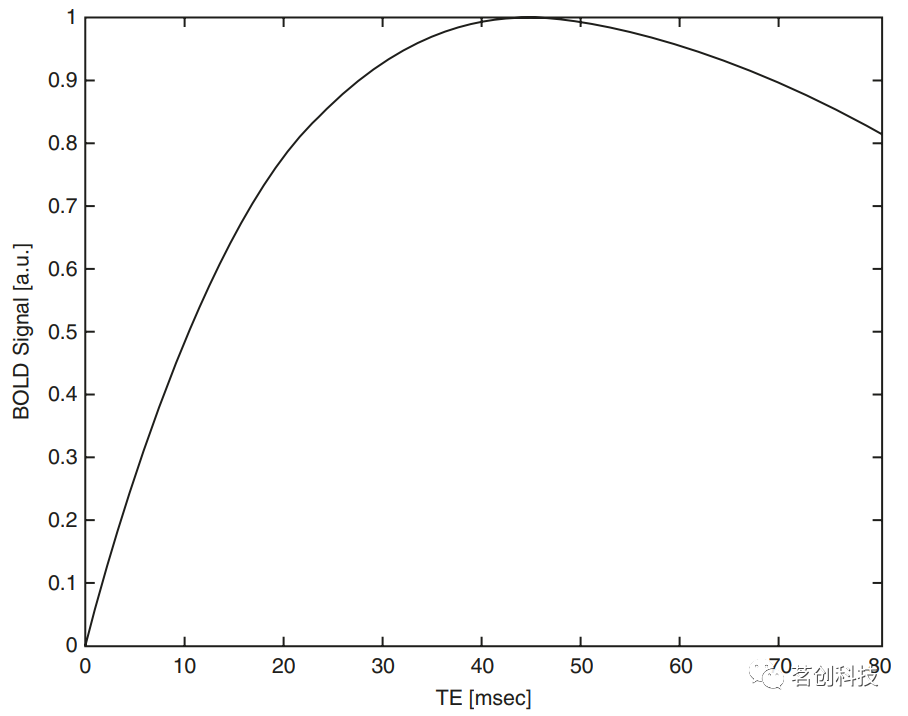
图12.典型的血流动力学反应函数。 根据该模型,在神经元激活开始后,CMRO2增加。氧气的消耗导致脱氧血红蛋白浓度升高,从而使信号强度降低,导致初始下降。然而,在很短的时间内,CBF和CBV上升:由于CBF增加,氧气被输送到激活部位,导致脱氧血红蛋白浓度降低,从而产生更高的信号强度。CBV的增加伴随着更高浓度的脱氧血红蛋白,从而降低了信号强度。然而,CBF增加的影响超过了较高的CMRO2和CBV值引起的信号降低,从而导致了正向的BOLD响应。大约10s后,CMRO2和CBF恢复到基线水平。CBV的弛豫较慢,因此在一定时间内,由于血容量较高,脱氧血红蛋白浓度增加,从而降低了信号强度,导致下冲。 从成像角度来看,T2*对比度和BOLD响应的对比度首先是由回波时间(TE)的选择决定的。但问题是,应该选择什么样的回波时间(TE)才能达到最大的BOLD对比度。图13显示了T2*值为45ms时(这是3T场强下脑组织的近似T2*值),理论BOLD信号与TE的关系。对于短TE来说,自旋没有足够的时间移相,因此影响很小。对于很长的TE,由于弛豫效应会造成信号损失。当TE=T2*时,在3T场强和45ms时可获得最佳结果。然而,梯度回波序列易受所有场不均匀性的影响,因此在一些脑区(如眶额区和颞区)会存在信号丢失,这些区域的静态磁场通常会因为靠近充满空气的空腔而失真。因此,选择的TE应尽可能短以避免信号损失,但也必须实现足够的BOLD对比度。从图13可以看出,TE为30ms时仍有较强的BOLD信号,这是在3T扫描仪上进行fMRI研究的推荐值。在1.5T时,由于较低场强下的T2*值会延长,所以应选择50ms的TE。
图13.在3T场强时,理论BOLD灵敏度与所选回波时间(TE)的依赖关系。 在更高的场强下(例如7T),甚至可以实现亚毫米分辨率,并被用于研究人类新皮层的介观结构(≤1mm)。使用fMRI来表征这种细微结构对对比度噪声比和有效空间分辨率提出了特殊的要求。特别是,经小静脉排出的脱氧血液会在高级皮质层中引起弥散效应,从而导致有效点扩散函数较差。因此,校正和减少这种效应已成为一个活跃的研究领域,并产生了新的空间建模方法。这种类型的高分辨率成像是研究介观功能神经解剖结构的一种很有前景的技术。 参考文献(上下滑动查看): Attwell D, Iadecola C (2002) The neural basis of functional brain imaging signals. Trends Neurosci 25:621-625. Buxton RB (2012) Dynamic models of BOLD contrast. Neuroimage 62:953-961. Cergignani M, Dowell NG, Tofts P (eds) (2018) Quantitative MRI of the brain: principles of physical measurement. CRC Press, Boca Raton. Dean BL, Lee C, Kirsch JE, Runge VM, Dempsey RM, Pettigrew LC (1992) Cerebral hemodynamics and cerebral blood volume: MR assessment using gadolinium contrast agents and Tl-weighted turbo-FLASH imaging. Am J Neurorad 13:39-48. Donahue MJ, Lu H, Jones CK, Edden RA, Pekar JJ, van Zijl PC (2006) Theoretical and experimental investigation of the VASO contrast mechanism. Magn Reson Med 56:1261-1273. Goense J, Bohraus Y, Logothetis NK (2016) fMRI at high spatial resolution: implications for BOLD-models. Front Comput Neurosci 10:66. https://doi.org/10.3389/fncom.2016.00066 Haase A (1990) Snapshot FLASH MRI: applications to T1, T2, and chemical-shift imaging. Magn Reson Med 13:77-89. Havlicek M, Roebroeck A, Friston KJ, Gardumi A, Ivanov D, Uludag K (2015) Physiologically informed dynamic causal modeling of fMRI data. Neuroimage 122:355-372. Kida I, Rothman DL, Hyder F (2007) Dynamics of changes in blood flow, volume, and oxygenation: implications for dynamic functional magnetic resonance imaging calibration. J Cereb Blood Flow Metab 27:690-696. Logothetis NK, Pauls J, Augath M, Trinath T, Oeltermann A (2001) Neurophysiological investigation of the basis of the fMRI signal. Nature 412:150-157. Lu H, van Zijl PC, Hendrikse J, Golay X (2004) Multiple acquisitions with global inversion cycling (MAGIC): a multislice technique for vascular-space-occupancy dependent fMRI. Magn Reson Med 51:9-15. Lu H, Law M, Johnson G, Ge Y, van Zijl PC, Helpern JA (2005) Novel approach to the measurement of absolute cerebral blood volume using vascular-space-occupancy magnetic resonance imaging. Magn Reson Med 54:1403-1411. Mandeville JB (2012) IRON fMRI measurements of CBV and implications for BOLD signal. Neuroimage 62(2):1000-1008. Sten S, Witt ST, Cedersund G, Elinder F (2017) Neural inhibition can explain negative BOLD responses: a mechanistic modelling and fMRI study. Neuroimage 158:219-231. |
【本文地址】
| 今日新闻 |
| 推荐新闻 |
| 专题文章 |