| 图说 | 您所在的位置:网站首页 › 生物中coa是什么意思 › 图说 |
图说
|
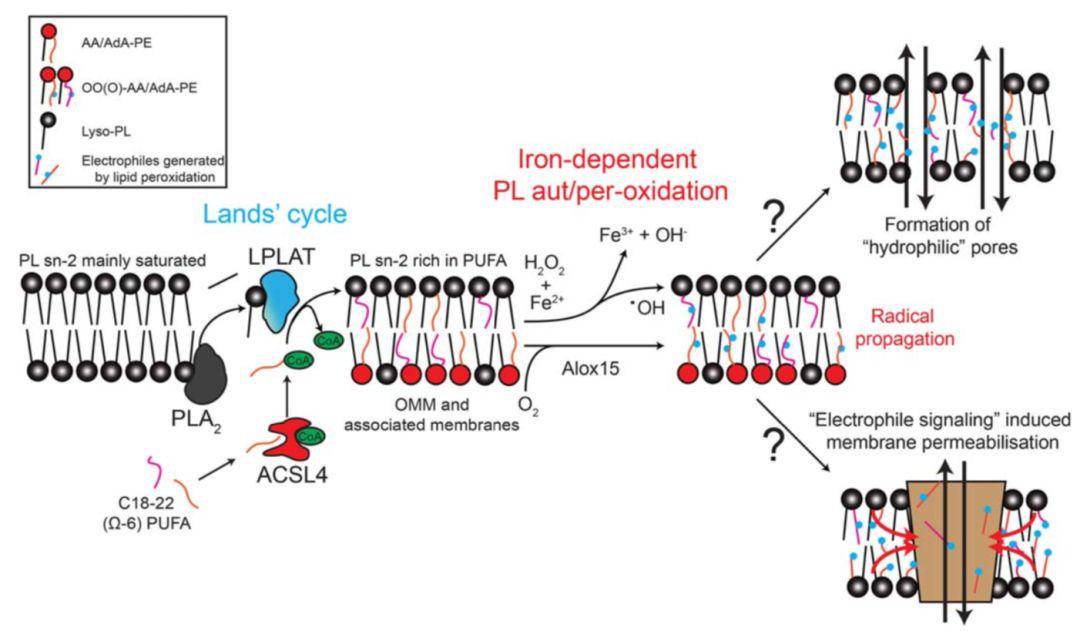
在之前的内容中我们已经学习了铁死亡的调节机制,在这个过程中, 铁催化细胞中氧自由基的形成,并促进脂质过氧化在细胞膜上的传播。本期我们将来探讨脂质过氧化引起铁死亡的机制。 磷脂酰基链重构途径(Lands’ cycle)是实现铁死亡的关键
含AA/ada的脑磷脂被氧化后在铁死亡过程中引起脂质过氧化。磷脂 PLs中酯化 多不饱和脂肪酸(Polyunsaturated fatty acids,PUFAs)的量决定了细胞膜的氧化性。 磷脂酰基链重构途径(Lands’ cycle) 是细胞膜富集PUFAs的机制。 磷脂PLs(如卵磷脂PC、脑磷脂PE)包含两个酯化酰基链, 大多在sn-2位置有饱和或单不饱和酰基链。 PLs中sn-2位置上的饱和或单不饱和酰基被 磷脂酶A2(PLA2) 释放,随后在 溶磷脂酰基转移酶家族LPLAT(lysophospholipid acyl transferases) 催化 下,被 PUFA-CoA 提供的多不饱和酰基取代。 Lands’ cycle中,碳链长度为18-22的Ω-6 PUFAs在 酰基辅酶a合成酶长链家族成员4(ACSL4) 的催化下生成关键底物PUFA-CoA。 富含Ω-6 PUFAs的膜(如,线粒体外膜OMM和相关膜)是脂质过氧化的起始位点,可能通过 Fenton Chemistry 或酶催化(如Alox15)进行铁依赖性脂质自氧化/过氧化。 AA/AdA-PEs 是铁死亡时脂质过氧化的主要靶分子,主要定位于胞质面的膜。自由基扩增,如果不被细胞抗氧化系统阻止,脂质过氧化作用将以随机的方式传播到其他含PUFA的PLs。 导致细胞膜完整性丧失并最终导致细胞死亡的确切机制尚不清楚。目前有两种机制可能解释在体外实验中观察到的铁死亡的表型特征。 一种可能是,脂质过氧化过程中PLOOH和分解产物在膜中积累, 改变膜的性质,导致亲水性孔隙的形成, 水和其他溶质通过细胞膜的渗透性改变,从而导致细胞死亡。 另一种可能是,在脂质过氧化过程中形成的亲脂亲电性物质(如上期提到的活性醛类,氧化PLs等)可以 作为特异性的信号分子, 通过修饰下游分子(如膜蛋白),介导膜的通透性。 总结铁死亡是铁依赖性的脂质过氧化破坏细胞膜完整性而导致的一种细胞死亡方式。 铁在铁死亡过程中起到催化细胞中氧自由基的形成,并促进脂质过氧化在细胞膜上的传播的作用;而磷脂酰基链重构途径(Lands’ cycle)则为脂质过氧化提供了关键底物,是实现铁死亡的关键一环。了解铁在铁死亡中的作用,不仅有助于更好地理解铁死亡的分子特征,而且有助于开发基于铁死亡的新的肿瘤治疗策略。 返回搜狐,查看更多 责任编辑: |
【本文地址】
公司简介
联系我们