| 让全宇宙都绝望的定律“熵增定律”:人以负熵为食,注定走向消亡 | 您所在的位置:网站首页 › 生命中最绝望的定律 › 让全宇宙都绝望的定律“熵增定律”:人以负熵为食,注定走向消亡 |
让全宇宙都绝望的定律“熵增定律”:人以负熵为食,注定走向消亡
|
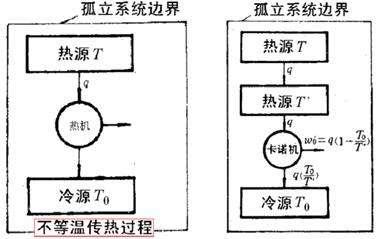
由此卡诺成为了带一个提出热功转换的人,卡诺定理也促成了热力学第一定律的诞生。 英国物理学家开尔文在研究卡诺和焦耳的工作时,发现了某种不和谐:按照能量守恒定律,热和功应该是等价的,可是按照卡诺的理论,热和功并不是完全相同的,因为功可以完全变成热而不需要任何条件,而热产生功却必须伴随有热向冷的耗散。 开尔文
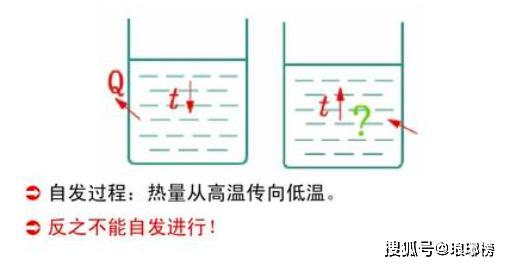
所以他在1849年的一篇论文中说:“热的理论需要进行认真改革,必须寻找新的实验事实。”同时代的克劳修斯也认真研究了这些问题,他敏锐地看到不和谐存在于卡诺理论的内部。他指出卡诺理论中关于热产生功必须伴随着热向冷的传递的结论是正确的,而热的量(即热质)不发生变化则是不对的。 克劳修斯在1850年发表的论文中提出,在热的理论中,除了能量守恒定律以外,还必须补充另外一条基本定律:“没有某种动力的消耗或其他变化,不可能使热从低温转移到高温。“这个定律被称为热力学第二定律。而热力学第二定律则与力学过程的可逆性相矛盾。
克劳修斯在 1854 年的随笔《关于热的力学理论的第二基础定理的一个修正形式》提出了新的物理量来解释这种现象,,1865 年正式命名为熵,以符号S表示。 克劳修斯从热机的效率出发,认识到正转变(功转变成热量)可以自发进行,而负转变(热量转变成功)作为正转变的逆过程却不能自发进行。负转变的发生需要同时有一个正转变伴随发生,并且正转变的能量要大于负转变,这实际是意味着自然界中的正转变是无法复原的。
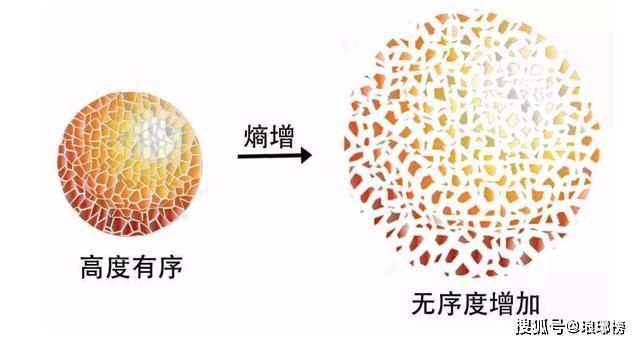
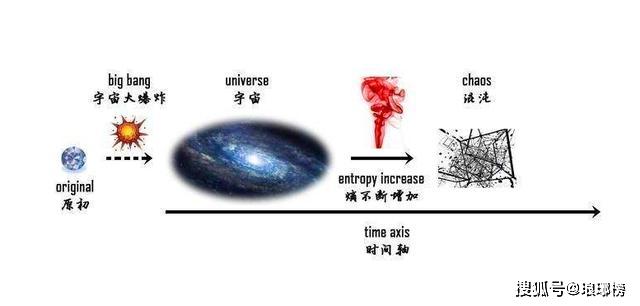
由此克劳修斯提出了热力学第二定律的又一个表述方式,也被称为熵增原理,那就是:不可逆热力过程中熵的微增量总是大于零。在自然过程中,一个孤立系统的总混乱度(即“熵”)不会减小。 简而言之就是孤立系统的熵永不自动减少,熵在可逆过程中不变,在不可逆过程中增加,可以说非常鲜明地指出了不可逆过程的进行方向。说明经典力学的可逆性并不适用于所有情况,它只在有普遍的力学原理做保证的情况下才准确,热运动就是一个不可逆的过程。
熵增定律被认为是让全宇宙都绝望的定律,不仅黑洞都逃脱不了熵增定律,就连宇宙也是。 熵增定律为什么是让全宇宙都绝望的定律著名物理学家爱丁顿爵士曾经说过:“我认为,熵增原则是自然界所有定律中至高无上的。如果有人指出你的宇宙理论与麦克斯韦方程不符,那么麦克斯韦方程可能有不对;如果你的宇宙理论与观测相矛盾,嗯,观测的人有时也会把事情搞错;但是如果你的理论违背了热力学第二定律,我就敢说你没有指望了,你的理论只有丢尽脸、垮台。”
薛定谔就则指出,熵增过程也必然体现在生命体系当中。也就是说,生命体系中的熵也应该是不断增大的,也只能是从有序向无序发展。不过生命却具有抵抗自身熵增的能力,直观来说,生命就是靠汲取环境中的负熵来生存的。最显著的汲取负熵的例子就是吃饭,即“新陈代谢的实质就是及时全部消除有机体无时无刻不产生的全部负熵”。
然而这种从环境中汲取负熵的行为本质上其实还是增熵。因为人在生存制作食物的过程中增加的熵与弥散的热量要远大于吃饭的减熵,熵增的必然性和不可逆性,注定了生命只能从有序发展为无序,并最终走向老化、死亡。
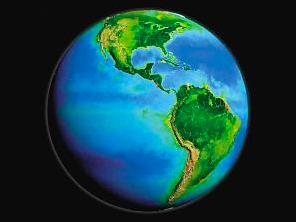
薛定谔生动地用“生命赖负熵为生”这一句名言概括。地球上的生物也是通过从环境摄取低熵物质(有序高分子)向环境释放高熵物质(无序小分子)来维持自身处于低熵有序状态。而地球整体的负熵流来自于植物吸收太阳的光流(负熵流)产生低熵物质。使得地球上会出现生物这种有序化的结构。不至于使熵一直处于增大的状态,然而依据熵增原理,地球生物都会从从有序走向无序,也就是走向死亡,就连地球本身也是如此。
而根据热力学第二定律,作为一个“孤立”的系统,宇宙的熵会随着时间的流异而增加,由有序向无序,当宇宙的熵达到最大值时,宇宙中的其他有效能量已经全数转化为热能,所有物质温度达到热平衡。这种状态称为热寂。这样的宇宙中再也没有任何可以维持运动或是生命的能量存在,那么宇宙的最终结局就是走向彻底的无序,也就是死亡。。
也就是宇宙不是永恒的,灭亡是最终归宿。但是目前宇宙究竟是不是一个孤立系统,目前还是科学界在争论的焦点,由于涉及到宇宙未来、人类命运等重大问题,因而它所波及和影响的范围已经远远超出了科学界和哲学界,成了近代史上一桩最令人懊恼的疑案。 对熵增定律的对抗—耗散结构为了对抗“熵增”。伊里亚·普里戈金提出了耗散结构。热力学第二定律告诉我们,一个孤立系统的熵一定会随时间增大,熵达到极大值,系统达到最无序的平衡态,所以孤立系统绝不会出现耗散结构。那么开放系统为什么会出现本质上不同于孤立系统的行为呢?其实,在开放的条件下,系统的熵增量dS是由系统与外界的熵交换deS和系统内的熵产生diS两部分组成的,即:dS=deS+diS 热力学第二定律只要求系统内的熵产生非负,即diS>=0,然而外界给系统注入的熵deS可为正、零或负,这要根据系统与其外界的相互作用而定,在deS |
【本文地址】