| 【中考!】“动”“静”结合 解读溶解度曲线的解题方法! | 您所在的位置:网站首页 › 溶解度曲线图解题技巧 › 【中考!】“动”“静”结合 解读溶解度曲线的解题方法! |
【中考!】“动”“静”结合 解读溶解度曲线的解题方法!
|
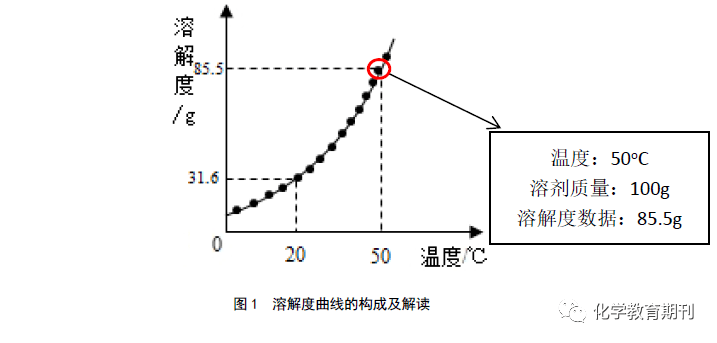
2 解读溶解度曲线上“静态点”,把握点的含义 初中人教版教材定义的固体溶解度,是指在一定温度下,某固态物质在100g溶剂里达到饱和状态时所能溶解的质量。如果不指明溶剂,通常所说的溶解度是指物质在水里的溶解度。例如,在20 ℃时,100 g水里最多能溶解36 g氯化钠(此时溶液达到饱和状态),我们就说在20 ℃时,氯化钠在水里的溶解度是36 g [3] 。而溶解度曲线是由无数个点连接而成的,每一个“静态点”对应某一温度时的溶解度(如图1)。理解“静态点”的含义是认读溶解度曲线的重要基础。
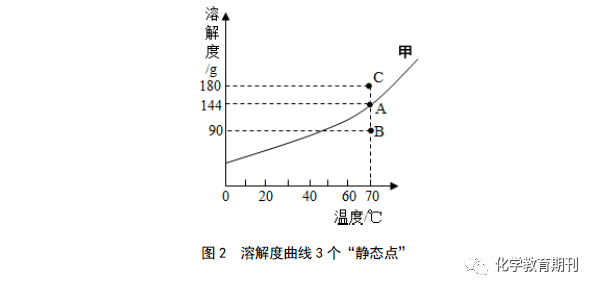
下面结合具体图例对“静态点”的含义进行整理和界定,建立“静态点”的纵坐标数值=溶质质量(带限制条件)的桥梁,解决点的含义。 如图2所示,A、B、C3个“静态点”(下面简称A点、B点、C点)分别位于溶解度曲线的线上、线下方和线上方。对于同一条溶解度曲线,3个不同位置的 “静态点”代表的点的含义:
2.1 线上的“静态点”的含义 图1中A点对应的刚好是溶解度的定义点,代表该溶液处于饱和状态,表示“70 ℃时,甲物质的溶解度为144 g”,即70 ℃时,100 g溶剂中溶解了144 g的甲物质达到了饱和。 交点是曲线上的点的一种特殊情形,表示对应温度下相交的几种物质的溶解度相等[4] 。而溶解度交点的考查是中考的一个高频考点,学生对交点含义的解读一般停留在简单的“该温度下溶解度相等”上,一旦题目变形,由于概念理解不清,就容易失分。下面结合常见的表述,判断关于交点Q其他含义认识的正误:
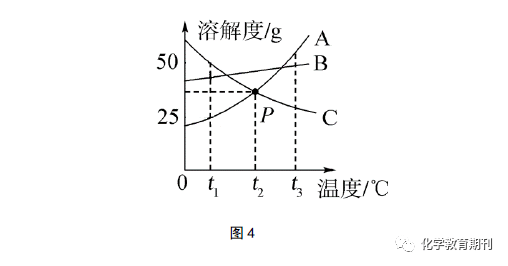
2.2 线下方的“静态点”的含义 图1中B点表示70 ℃时,100 g溶剂中溶解了90 g的甲物质,对于形成该温度下的饱和溶液来说,还差了(144-90=54)g甲物质才能达到饱和状态,即线下方的“静态点”表示对应该温度下的溶液是不饱和溶液。 2.3 线上方的“静态点”的含义 图1中C点表示70 ℃时,在100 g溶剂中加入了180 g的甲物质充分溶解,得到对应温度下的饱和溶液,且有(180-144=36)g的固体剩余。不能溶解的固体,以晶体形式存在溶液中,不属于溶液的一部分。 3 借助“动态点”的移动,分析升降温后溶液的组成及状态的改变 温度的升降对溶液的组成和状态的影响,对学生来说是一个难点。初中阶段的溶液组成和状态的变化主要是以下几个方面:溶液的状态变化(饱和溶液、不饱和溶液);溶质质量(晶体析出与否);溶液质量;溶解度;溶液的浓度等,一般不考虑温度变化引起溶剂的蒸发。要解决这类题型,首先必须理解温度升降时,溶液是一个动态变化的状态,根据溶解度曲线受温度变化的情况,借助数学的动点思维,判断升降温后“动态点”(表示升降温后溶液的状态和组成)的移动情况,迅速地锁定溶液组成和状态的改变。 如图4所示:将A、B、C三种饱和溶液从t3 ℃降温到t1 ℃,判断溶液的状态改变、溶质质量的变化及对溶质质量分数的影响。
3.1 “动态点”的线上运动或平移 以A物质的溶解度曲线为例,图5中a点表示t3 ℃是A是饱和溶液,将该温度下的饱和溶液从t3 ℃降温到t 1 ℃时,观察到A物质的溶解度曲线受温度变化的影响——温度越低,A物质的溶解度越小,故整个降温过程中,A溶液始终保持饱和状态,且其能溶解的最大溶质质量随溶解度的减小而减小,溶液中不断地析出晶体,直到形成t1 ℃的饱和溶液。此时,100 g溶剂质量保持不变,标准溶液(将100 g溶剂溶解物质达到饱和状态时的溶液称为标准溶液,下同)中溶质质量比降温前少,故降温到t1 ℃时溶液的溶质质量分数比t3 ℃时的小。我把这种方法称为“动态点的线上运动”,适用范围是温度改变时,溶液的饱和状态不改变。同理可以分析出B物质饱和溶液的状态和组成变化情况(如图6所示)。
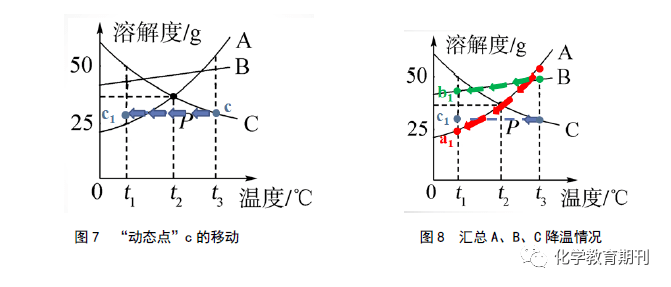
但很明显,并不是所有物质饱和溶液的升降温都适用“动态点”的线上运动来判断。观察图4中的C物质的溶解度曲线,温度越低,C物质的溶解度越大,说明降温可以加大C物质的溶解性,故整个降温过程中,C物质的溶解度逐渐变大,C溶液由饱和状态变化为不饱和状态,而降温前c点所表示溶解的溶质质量在整个降温过程中没有发生变化,在溶质质量不变,溶液质量不变的情况下,C溶液的溶质质量分数也没有发生改变。“动态点”c点的移动情况如图7所示,直到形成t1 ℃的C物质不饱和溶液。溶液状态及组成呈现为c1 点,点落在线的下方,满足实际情况,为不饱和溶液。这种方法称为“动态点的平移”。适用范围为升降后溶液由饱和状态变成不饱和状态,此时溶液中的溶质质量不变。
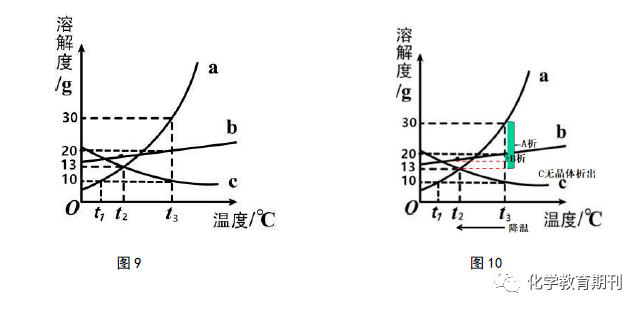
当然,根据“动态点”的移动后,我们可以判断溶液中的溶质质量情况,也可以比较升降温后所得溶液的溶质质量分数大小,如观察图8可知,A、B、C三种饱和溶液从t3 ℃降温到t1 ℃后,分别形成a1 、b1 、c1 状态下的溶液,溶解的溶质质量大小关系为b 1 >c 1 >a 1 ,则t 1 ℃时所得溶液的溶质质量分数大小关系为B>C>A。 其次,根据点移动后的情况,我们可以根据溶解度减小的幅度粗略地比较标准溶液析出的晶体多少。对于这个问题,学生普遍难理解的是为什么要指明“等质量饱和溶液”才可以比较。下面通过计算来说明这个“等质量”的问题。如图9所示,将100 gA、B、C饱和溶液分别从t3 ℃降温到t2 ℃时,比较析出晶体质量大小关系。
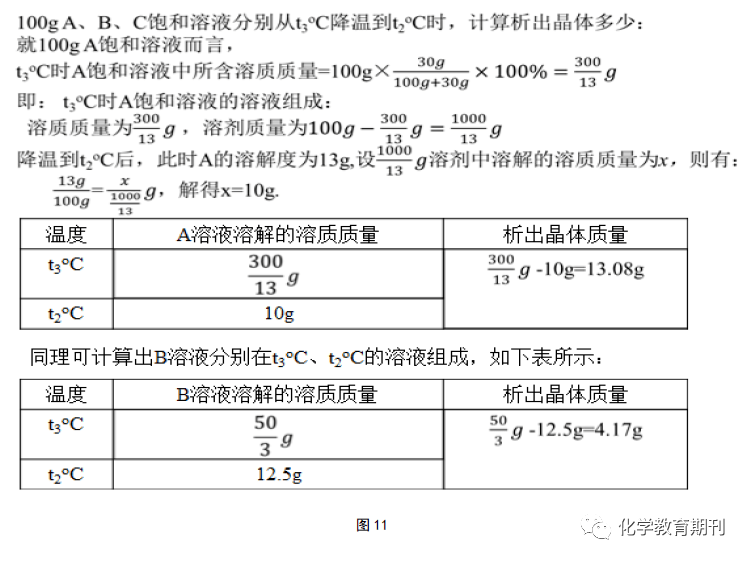
计算验证过程如下图11所示:
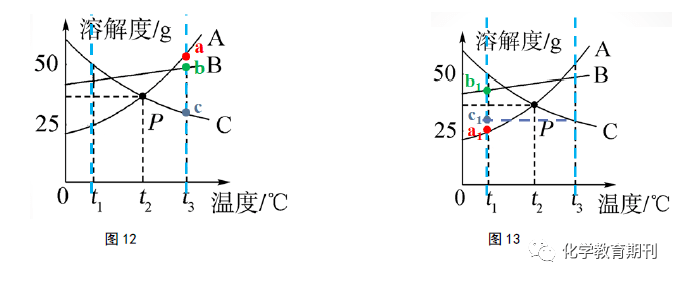
明显,13.08g>4.17g,则100gA、B、C饱和溶液从t3 ℃降温到t 2 ℃,析出晶体质量关系为A>B,C无晶体析出。满足在等质量的前提下,直接粗略地比较物质溶解度减小的幅度大小来比较饱和溶液降温析出晶体质量的多少(如图10所示)。若要使B饱和溶液析出的晶体要比A饱和溶液析出的晶体多,则一开始降温前B饱和溶液的溶液质量约>314g即可。没有饱和溶液质量的限定,无法直接比较由于温度变化导致的晶体析出质量大小,即“A、B、C饱和溶液从t3 ℃降温到t2 ℃,析出晶体多少关系为A>B,C无晶体析出”这一说法是不成立的。 3.2 “动态点”取最低点比较 “动态点”取最低点的方法是前面“动态点”线上移动或者平移衍生出来的一个简易的做题方法。观察图12,我们可以观察到t3 ℃标准溶液中溶解的溶质质量分别为a g、b g、c g。从t3 ℃降温到t1 ℃后,相应原A、B标准溶液的溶质质量会随着溶解度的减小而不断减少,直至达到t1 ℃时的标准溶液,此时溶液中溶解的溶质质量为该温度区间内的最低点数值,即图13中的a1 g 、b 1 g。而原t3 ℃时C标准溶液在降温过程中,溶解度虽然变大,但溶质质量仍保持原来的c g质量不变,为该温度区间内C溶解度曲线的最低点数值c1 g= c g。标准溶液升温亦是如是,在此不再赘述。
故,对于标准溶液升降温后研究溶液的状态和组成变化情况,我们可以取研究温度区间内溶解度曲线的最低点,根据点的位置可以判断该温度下溶液的状态,线上为对应物质的饱和溶液,线下方为对应物质的不饱和溶液,也可以根据同等温度下点的高低,即标准溶液溶解的溶质质量大小关系来判断升降温后所得溶液的溶质质量分数大小关系。 最后,溶解度曲线的应用是中考的难点内容,对概念的清晰理解是准确认读溶解度曲线的关键。在溶解度及溶解度曲线的教学过程中,首先应当加强学生对概念的理解和学习,引导学生认读清楚溶解度曲线上的“静态点”的含义,及“动态点”的运动情况,“动”“静”结合,从点到线,通盘考虑,建立做题模型,学会整合解题方法,提高解题能力。 参 考 文 献 [1][4]龙昌华.例谈溶解度曲线的化学涵义解读[J].化学教学,2017,(8):91-92. [2]付小琴.让溶解度曲线图象题“原形毕露”树学生解题自信[J].数理化,2014,(1):41-42. [3]王晶,郑长龙.义务教育教科书人教版九年级下册[M].北京:人民教育出版社,2013:36. 投稿《化学教育》,收获更多! 温馨提醒 (1)若留家庭地址,请保证居住小区有自己的信箱且正常使用,以便邮政投递; 化学教育期刊公众号,致力于为化学教师提供优质的内容!返回搜狐,查看更多 |
【本文地址】