| 氨和铵盐 | 您所在的位置:网站首页 › 氨气和浓盐酸反应现象 › 氨和铵盐 |
氨和铵盐
|
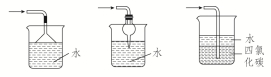
氨和铵盐知识点包括氨的分子结构与性质、氨气的制法、铵盐及NH4的检验等部分,有关氨和铵盐的详情如下: 氨的分子结构与性质(1)分子结构 分子式:NH3,电子式: (2)物理性质 无色有刺激性气味的气体,密度比空气小,易液化,可用作制冷剂,极易溶于水(约1∶700),可由喷泉实验证明。 (3)化学性质
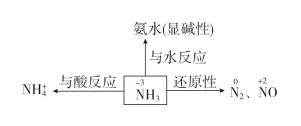
①与水反应:NH3+H2O NH3·H2O NH4(+)+OH-,氨的水溶液叫氨水,呈弱碱性。 a.组成:三种分子:NH3、H2O、NH3·H2O;三种离子:NH4(+)、OH-、H+。 b.性质:氨水质量分数越大,其密度越小。 c.NH3·H2O为可溶性一元弱碱,易挥发,不稳定,易分解:
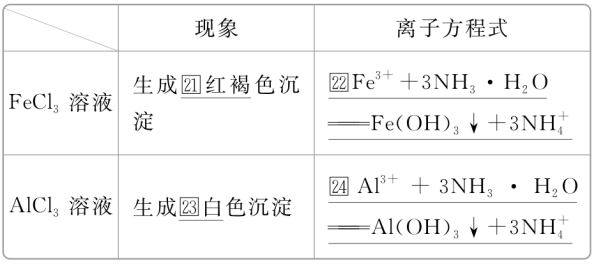
②氨气与酸反应 a.蘸有浓盐酸的玻璃棒与蘸有浓氨水的玻璃棒靠近,其现象为有白烟生成,将浓盐酸改为浓硝酸,也会出现相同的现象。化学方程式为 b.与CO2等酸性氧化物反应: ③NH3的还原性 氨的催化氧化: 与CuO的反应: 与Cl2的反应: ④与盐溶液反应 将氨水加入下列溶液,完成下表:
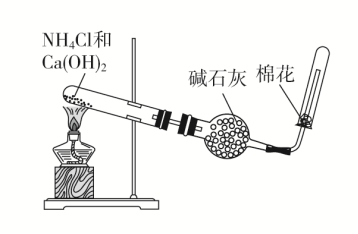
1.工业制法: 2.实验室制法 实验装置
净化装置
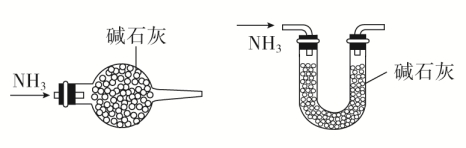
3.注意事项 (1)制取氨气时所用的铵盐不宜用硝酸铵、碳酸铵或碳酸氢铵。因为在加热过程中,NH4NO3可能发生爆炸;而(NH4)2CO3、NH4HCO3受热易分解产生CO2,使生成的NH3中混有较多的CO2杂质。 (2)消石灰不能用NaOH、KOH代替,一方面Ca(OH)2比NaOH便宜,另一方面NaOH、KOH具有吸湿性,易结块,不利于产生NH3,且在加热条件下易腐蚀试管。 (3)氨是碱性气体,不能用酸性干燥剂(浓硫酸、P2O5)干燥,也不能用CaCl2干燥,因为CaCl2可以吸收NH3生成CaCl2·8NH3。 (4)吸收氨气时要注意防止倒吸。 可用于吸收氨气并能防倒吸的常用装置为:
(5)铵盐受热都能分解,但不是都产生NH3,如NH4NO3在200 ℃时分解生成N2O和H2O。 铵盐及NH4的检验(1)铵盐的物理性质 大多数铵盐是白色固体,均易溶于水。 (2)铵盐的化学性质
(3)NH4(+)的检验
|
【本文地址】
 。
。