| 抗体纯化:不含Protein A的两步纯化法 | 您所在的位置:网站首页 › 抗体proteinA纯化 › 抗体纯化:不含Protein A的两步纯化法 |
抗体纯化:不含Protein A的两步纯化法
|
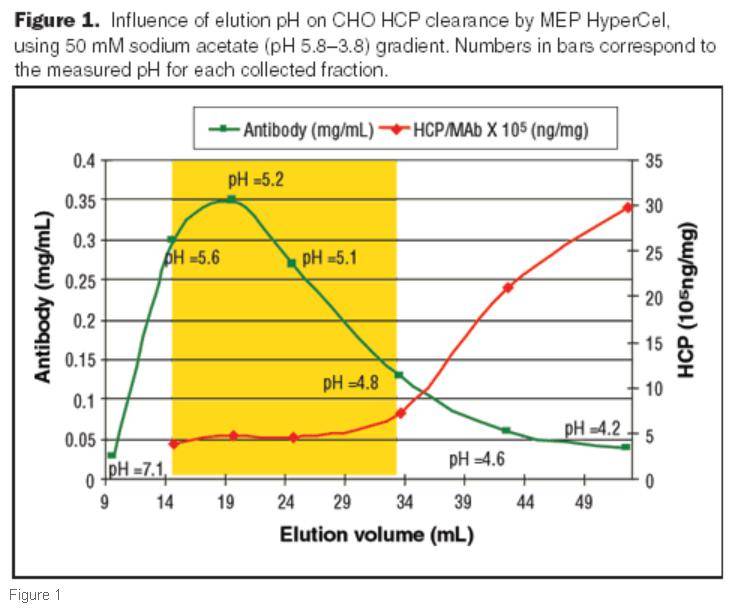
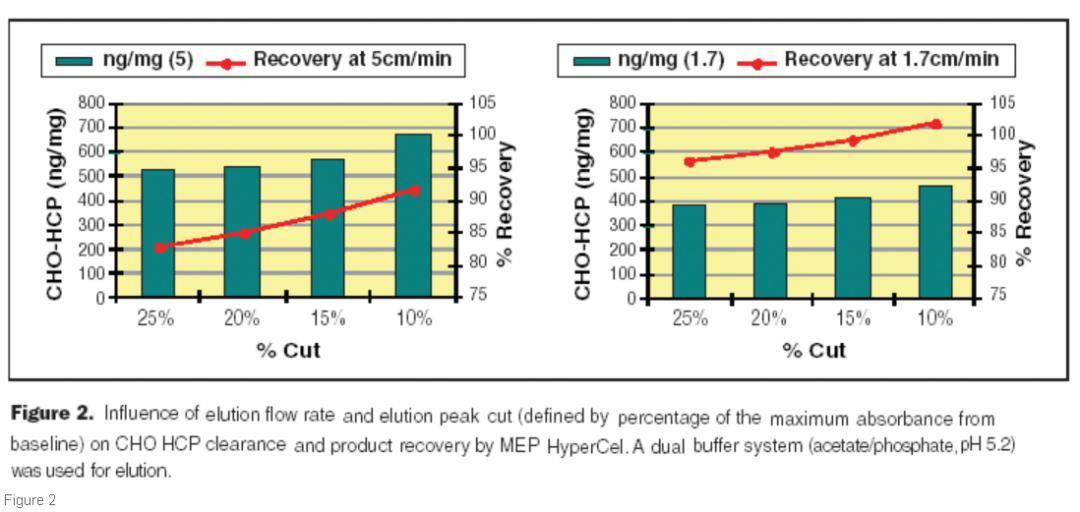
当进行抗体的洗脱时,疏水层析对上样过程中宽范的电导率耐受性特别有用。因此,由于疏水树层析介质可用于捕获或精纯,因此在建议的纯化方案中应该具有互换性。 在洗脱过程中可以看到疏水层析介质提供的另一个好处是,随着pH的降低,由于配体与抗体之间的静电排斥作用,产物得以回收,电导率在洗脱过程中没有重大影响。因此,当使用 疏水层析介质进行捕获时,洗脱液可以使用低电导率收集,这样做的好处是第一步收集的制品不用进行任何的处理,就可以有效的结合到下一步的CEX 层析柱上。因此,产品可以直接从HCI柱流到CEX柱,而无需任何过程中的 超滤(TFF )。如果将疏水层析作为精纯步骤,洗脱缓冲液的电导率则具有更大的灵活性,因为HCl是最后的 层析步骤。此外,疏水层析可被视为TFF的替代 层析步骤。 疏水层析的优化 对HCI 层析方法进行了多项研究,以最大程度地减少洗脱过程中的HCP 含量。在捕获层析方法研究中,将洗脱过程中的电导率降低以及将洗脱pH从3-4提高到4.8-5.2有利于以最小的HCP相对量优先洗脱 目标产物(下图1 )。此外,我们通过降低洗脱流速实现了更高的纯度(下图2)。其他参数,例如低电导率洗脱和用磷酸盐缓冲液进行 淋洗,也有助于从纯化的抗体中去除HCP。
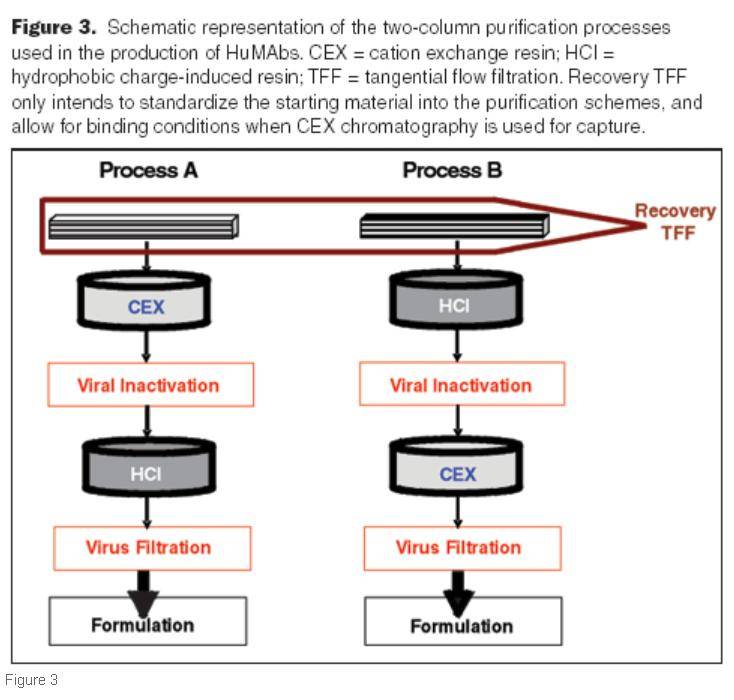
最后,我们观察到疏水层析的结合能力不仅可以通过目标产物在色谱柱中的停留时间来控制,还可以通过在平衡和上样期间操纵缓冲液种类来控制。例如,当基于磷酸盐的缓冲液的强度从35mM降低到10mM时,特异性抗体的结合能力从13mg/mL增加到22mg/mL,增加了约70%。 下面我们看一个示例,来进一步了解疏水层析: 1 细胞上清收获和处理 收集含有单克隆抗体的细胞培养上清液,使用35或70mM磷酸钠 缓冲液(pH 6.2)进行 细胞上清的收集。对于将疏水层析用作捕获层析的实验,在上样之前将样品调节至中性pH 值。 2 层析填料的选择 抗体将以15至45mg/mL的结合能力加载到CEX层析介质上。 但是,如果使用载量更高的层析填料,有些层析填料的载量值可以进一步提高到超过100mg/mL。将产物在pH6.2下加入40至75mM NaCl 缓冲液分步洗脱。疏水层析填料,平衡使用10、35或70 mM磷酸钠(pH 7.0至7.2),产品载量最大为22mg/mL。 填料用10到45mM磷酸钠(pH 6.2到7.0)进行 上样后淋洗,然后在用低电导率缓冲液洗脱。当使用pH范围为4.5-5.2的缓冲液时,使用另一种低电导率的缓冲液(例如10 mM乙酸钠或乙酸盐和磷酸盐双重缓冲液)进行洗脱。 层析方法流程可以在下图3 中看到。
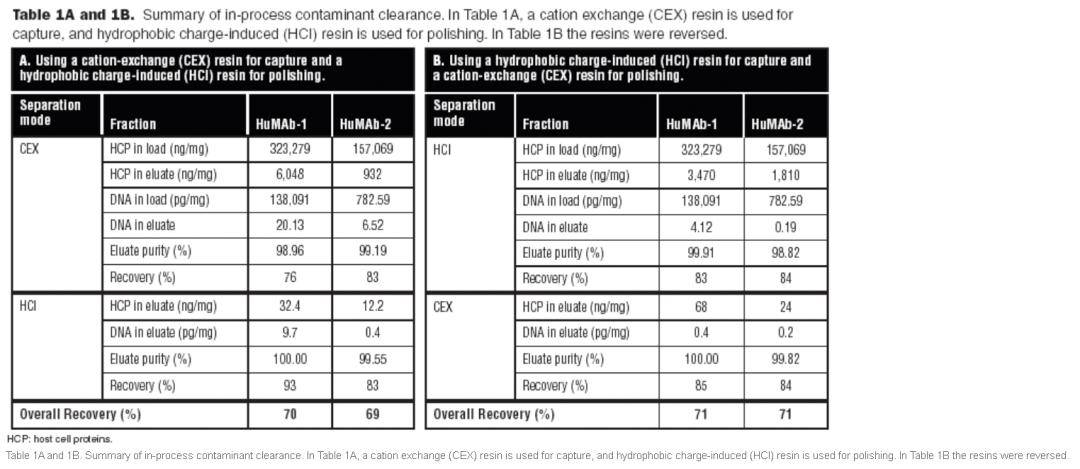
3 病毒灭活,除病毒过滤 低pH保持1小时。最终病毒过滤使用 纳滤膜进行除病毒过滤。病毒清除率验证研究可在之后的研究中进一步研究。 4 宿主细胞蛋白质和残余DNA浓度的检测 中国仓鼠卵巢宿主细胞蛋白(CHO HCP)分析使用了ELISA试剂盒。 使用qPCR定量分析 残余DNA。 结果与讨论 纯化方法的A 方法和B 方法在最终的纯化中均产生了可比的质量。使用相似的材料和两个可互换的层析程序,我们获得了最终的目标产物,目标抗体在CHO HCP中的含量小于100ppm,10pg DNA/mg,单体百分含量 >95%(通过体积排阻HPLC测定)。 下表1A总结了A方案使用CEX色谱进行捕获时获得的结果。这种“ 方法”被四种不同的抗体采用。在第一根色谱柱后,宿主细胞蛋白质含量降低了50-200倍,浓度范围从约900-6000 ng/mg降低,在HCI 层析柱后,其浓度降低至小于100ng/mg。CEX 层析非常有效地清除了DNA(达7000倍),而HCl 层析将残留的痕迹进一步减少至少于10pg DNA/mg 抗体。
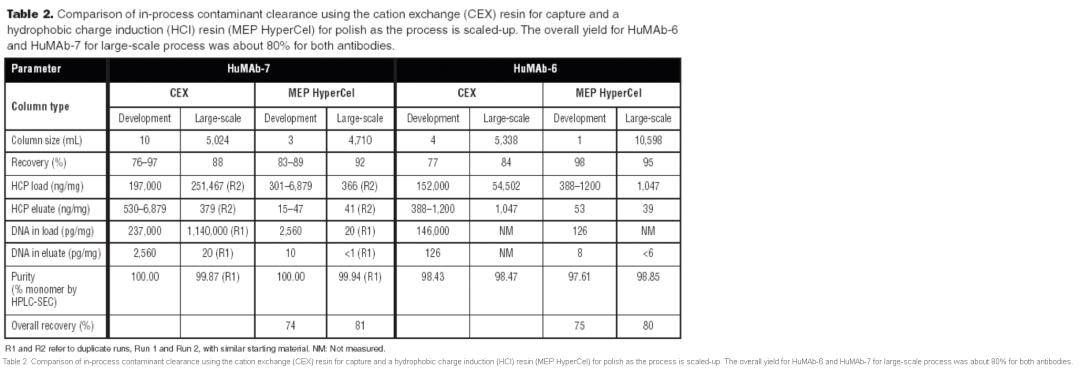
方案B产生了相当质量的 结果(下表1B)。HCP 被HCI降低了约90倍。与捕获的CEX 层析相比,DNA的清除效率更高,使测量结果低于设定的最终 检测量,这强调了疏水层析在清除核酸方面的高效率。 在两个方法上,HuMAb-1和HuMAb-2纯化方案最终纯度(单体%)和总回收率非常可比:分别超过99%和70%。 下表2总结了提出的其他两种单克隆抗体 纯化方法的可扩展性。用DNA测量观察到最大的变异性。所有其余参数都非常可比。最终纯化的 结果保持了实验室规模的质量。随着规模扩大,重复值往往会更好。
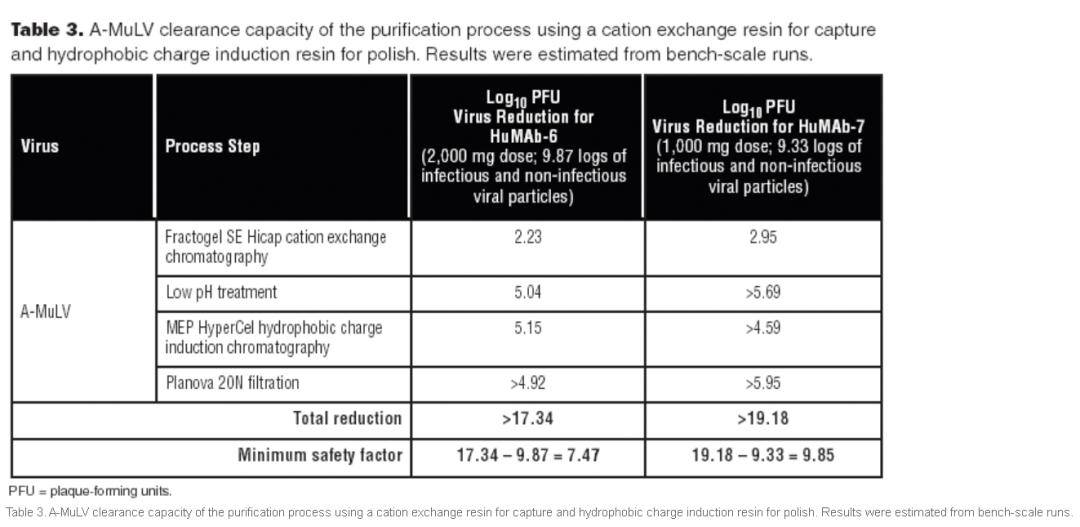
病毒清除 监管机构需要至少两个单独的步骤来在生产治疗性蛋时进行病毒灭活和清除。这些步骤必须基于不同的作用方式,通常是低pH 病毒灭活和病毒过滤2个 步骤。病毒灭活通常位于层析纯化步骤之间,但该步骤也可以位于两个纯化步骤之后。类似地,在第二个纯化步骤之后进行另外的特定步骤,例如病毒清除过滤。 下表3显示了 使用方案A的HuMAb-6和HuMAb-7的病毒清除率。细胞培养上清液中病毒颗粒量 有多达10log 的感染性和非感染性病毒颗粒。对于该过程,A-MuLV清除的最小安全系数分别为HuMAb-6和HuMAb-7在7至10 log之间。因此,最终的抗体产品(抗体和残留的过程污染物)具有足够的病毒清除率和安全性病毒因子,可将其用作治疗 制剂。
结论 随着抗体生产中表达量的提高,纯化过程必须提高过程效率和生产率。通过减少纯化过程步骤的数量,可以减少要制备的缓冲液的数量和过程成分。我们今天描述的两种纯化技术设计仅需对过程进行少量调整即可用于各种类型的蛋白质纯化。该方案是后续优化和更新步骤的起点,因为纯化参数通常可以优化,例如针对更高的结合能力范围。使用此方案的另一个优点是可以灵活选择特定产品或生产设施,使得纯化工艺是最方便的工艺步骤。 参考文献: 1. Rathin D and Morrow, KJ Jr. Progress in antibody therapeutics. Am Biotechnol Lab. 2006; 24(8):8–10. 2. Thompson R. Antibody therapeutics: product development, market trends, and strategic issues. 2006 Oct. Available 3. Zoon KC. Points to consider in the manufacturing and testing of monoclonal antibody products for human use. US FDA, CBER. Rockville, MD; 1997 Feb 28. 版 权 声 明 本公众号所有转载文章系出于传递更多信息之目的,且明确注明来源和作者,不希望被转载的媒体或个人可与我们联系([email protected]),我们将立即进行删除处理。所有文章仅代表作者观点,不代表本站立场。返回搜狐,查看更多 |
【本文地址】