| Nature综述:抗体效应功能的亲和力及药物设计 | 您所在的位置:网站首页 › 抗beta2gp1抗体igm偏高 › Nature综述:抗体效应功能的亲和力及药物设计 |
Nature综述:抗体效应功能的亲和力及药物设计
|
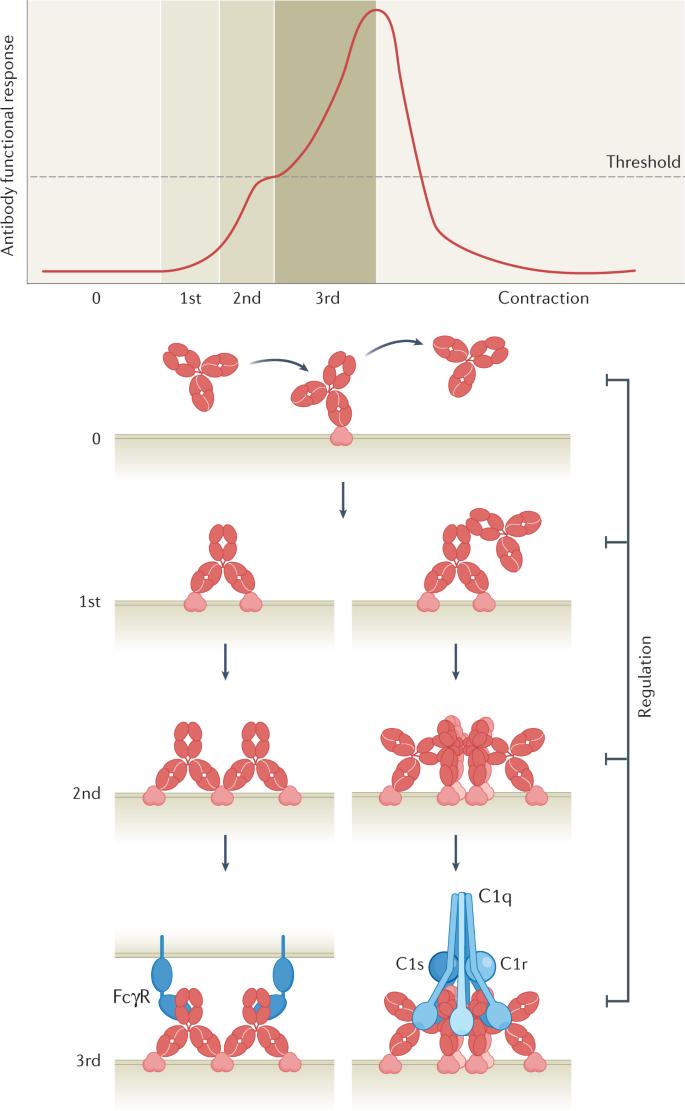
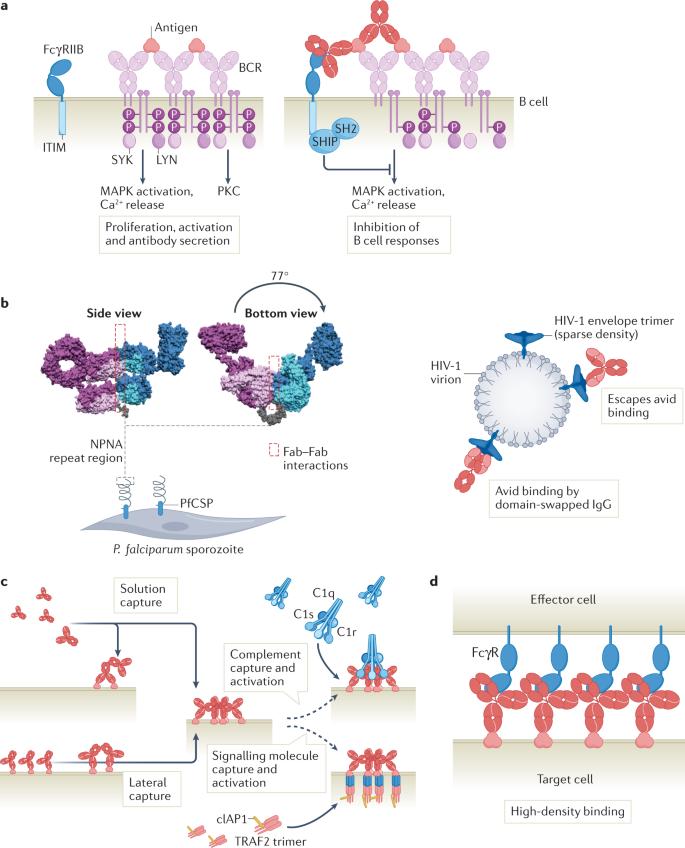
来源:生物制药小编 抗体是体液适应性免疫应答的关键组成部分,用于中和破坏致病分子、病毒和细胞。初次暴露于外源抗原后,免疫系统产生多种多克隆B细胞应答,产生识别多个重叠和非重叠抗原表位的抗体库。尽管这些初始抗体具有较低的结合亲和力,但产生活化抗体的B细胞通过体细胞超突变和克隆选择经历了一个保守的亲和力成熟过程,以产生具有连续更大影响的抗体。 2022年5月,估计有1,000种治疗性抗体正处于不同的临床开发阶段,119种抗体已在欧洲和美国首次获得上市批准。 许多因素有助于抗体治疗的成功,但药效学机制的核心是抗体与其靶标的相互作用,更具体地说,结合相互作用的亲和力和亲和力。其中的亲和力定义为交联事件中单个非共价相互作用贡献的多种亲和力的累积结合强度。 亲合力在抗体生物学中的作用 由抗体Fab和Fc结构域介导并受铰链区调控的不同亲和力相互作用引起的亲合力可根据达到的多价性水平分为不同层级: 一级亲合力,是指二价Fab与抗原的相互作用; 二级亲合力,是指Fab–抗原和Fc–Fc或Fab–Fab同时相互作用; 三级亲合力,是指免疫复合物和免疫效应分子之间的相互作用。 结合和解离速率常数以及局部浓度决定了抗体结合动力学的结合速率和解离速率,当结合速率快于解离速率时,有利于复合物的形成。达到激活阈值所需的条件可能因效应系统而异;例如,不同类型的效应机制需要不同的抗体浓度,因为它们是在不同的靶标占位水平下被触发。其他因素包括抗原表达和分布、不同的免疫球蛋白亚类和效应元件(如补体因子、效应细胞亚型、Fc受体亚型、多态性和表达水平)也会影响抗体相互作用的总体亲合力和随后功能应答的放大。 图1:控制抗体功能应答的应答动力学 图2:影响抗体功能反应激活的因素 体液适应性免疫应答 亲合力在体液免疫中的作用在免疫应答启动的早期就很明显。外来抗原进入淋巴组织后,存在于淋巴结滤泡中的幼稚B细胞通过与其IgM B细胞受体(BCR)的抗原结合而被激活。激活后,一些B细胞成为浆细胞,从主要表达膜相关IgM转换为分泌IgM。IgM抗体在抵御具有高表达、紧密间隔的表面表位的微生物方面尤其有效,这在一定程度上是表面抗原结合IgM和补体系统之间基于亲和力的有效相互作用的结果。此外,从IgM转换为IgG、IgA、IgE及其亚型导致抗体Fc结构域和相关功能特性的交换。 图3:抗体生物学的亲合力 Fc介导的效应功能 经典的抗体Fc介导的效应机制如补体依赖的细胞毒作用(CDC)、抗体依赖性细胞介导的细胞毒作用(ADCC)和抗体依赖性细胞吞噬作用(ADCP)是消除病原体或病变细胞(如感染或癌细胞)的关键机制。尽管长期以来认为Fab结构域结合抗原和Fc结构域激活效应子功能的过程是独立发挥作用的,但多项研究对这一观点提出了挑战,可能存在针对不同类型效应功能的免疫复合物的最佳构型。Fab和Fc的功能甚至可以被认为是相互依赖的,因为有效的补体激活需要通过一致的抗原-Fab和Fc–Fc相互作用聚集细胞结合的IgG,从而形成招募C1q46的最佳锚定位点。一级和二级亲合力相互作用是三阶亲合力相互作用和产生功能反应的先决条件。 中和 Fab结构域介导的中和是抗原和病原体失活的最直接机制。事实上,结合亲和力是一些中和细胞因子、生长因子或补体因子的高度成功治疗性抗体效力的主要驱动因素。Fab结构域与特定致病结构结合可阻止与宿主细胞的相互作用,从而阻断毒素活性或病毒进入细胞。 例如,HIV-1本身通过阻碍二价高亲合力抗体结合而逃避中和抗体。因此,抗HIV-1包膜糖蛋白的抗体被认为主要单价结合病毒表面。几项研究表明,由于病毒粒子表面的刺突蛋白密度较低和病毒刺突蛋白三聚体上的表位分布不利,从而分别限制了刺突间和刺突内交联,从而逃避了二价抗体结合。相比之下,靶向病毒(如流感和呼吸道合胞病毒)的抗体可以双价结合,从而利用二级亲合力效应。 效应功能的潜在有害作用,如病毒感染的抗体依赖性增强,是一个重要的设计考虑因素。病毒结合抗体与FcγR或补体受体之间的相互作用可能增强病毒在吞噬细胞中的进入和复制。这表明在多克隆抗体混合物中增强一级和二级亲合力相互作用,同时最小化三级亲合力对于在某些情况下获得最佳保护可能是至关重要的。 自身免疫 抗自身抗原的自身抗体的亲合力可增加其致病性,表现为单独输注时抗乙酰胆碱受体的二价IgG1抗体可诱导猴重症肌无力症状,而与IgG4抗体联合输注时则不能。这可以通过血浆中的IgG4抗体不能参与一级Fab介导的亲合力相互作用这一发现来解释,因为它们在体内通过无关特异性的IgG4抗体之间Fab臂交换的动态过程。IgG4分子缺乏一级亲合力可能是其他IgG4介导的自身免疫性疾病的致病机制。 补体激活 补体系统是一种强效的先天性免疫防御机制,由可扩增的酶级联反应组成,可杀死病原体并吸引免疫效应细胞。补体通过三种截然不同的途径被激活:经典途径、凝集素途径和替代途径,分别依赖于C1q、甘露聚糖结合凝集素或自发激活的补体与致病表面的结合。所有通路最终汇聚在C3和C5转化酶的生成中,这些转化酶协同产生调理素、过敏毒素、化学引诱物和形成膜攻击复合物,从而破坏靶细胞膜杀死细胞。 IgM抗体自然以多聚体形式存在,使其与C1q相互作用,按照构象变化激活补体。相比之下,IgG需要组装成有序的抗原结合六聚体,以形成结合和激活C1的最佳结构。 FcR介导的细胞效应功能 FcγR与不同亲和力的不同IgG同种型结合,只有FcγRI可以高(纳摩尔范围)亲和力结合单体IgG,因此可能会妨碍体内免疫复合物内的亲合力相互作用。炎症期间的细胞因子刺激可能诱导FcγRI聚集在膜微区,从而促进免疫复合物与单体IgG的亲合力结合。所有其他FcγR对单体IgG的亲和力均较低(微摩尔级),因此需要在生理条件下与IgG发生三阶亲和相互作用,从而在无致病触发因子的情况下防止不适当的效应细胞活化。细胞结合IgG的多聚化在一个阈值内加强了FcγR的结合相互作用,该阈值通过免疫受体酪氨酸激活基序(ITAM)结构域的磷酸化触发受体信号转导,进而导致靶细胞通过ADCC或ADCP消除。 非IgG抗体亚类与相应的FcR结合,包括FcαRI(IgA)、FcεRI和FcεRII/CD23(IgE)、FcμR(IgM)、IgδR(IgD)和Fcα/μR(IgA/IgM)。IgA通过调节对抗原、食物、共生微生物和肠道病原体暴露的耐受性和保护作用,在黏膜组织中具有关键作用,而IgE在宿主防御寄生虫(如蠕虫)中发挥作用,已知其通过与肥大细胞FcεRI的高亲和力结合在过敏反应中发挥作用。许多因素影响抗体-FcR交联的亲合力强度和程度,包括抗体和FcR结合亲和力、抗原表位的位置和细胞表面刚性。 抗体疗法的亲合力工程 抗体已被广泛确立为许多疾病的治疗方法,包括癌症、传染病、炎症性疾病和自身免疫。与当代药物方案相比,针对难以打击的靶标的治疗药物的设计为患者提供了有意义的改善,使抗体药物开发从典型的IgG抗体转向具有新功能的形式。
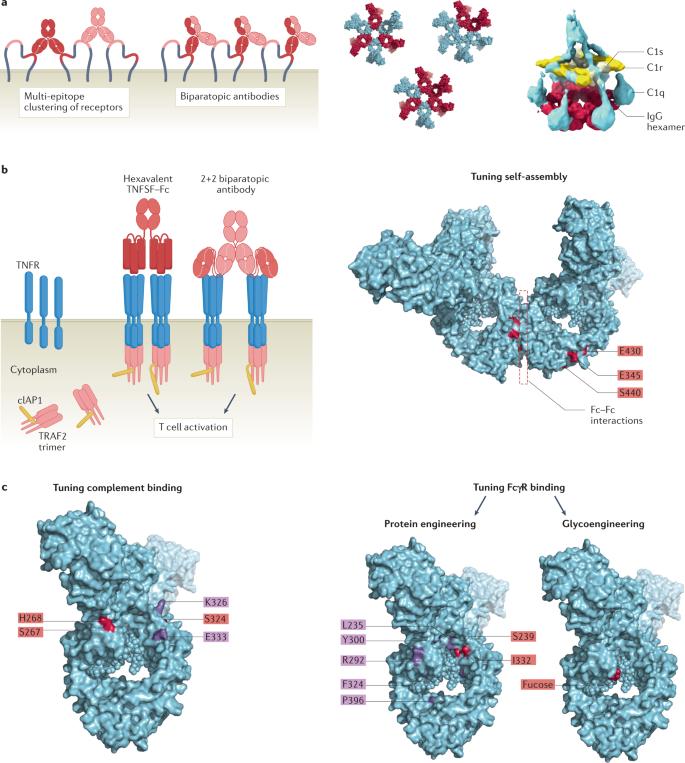
多特异性靶向 近年来越来越多的技术被引入,通过靶向一个以上的表位或靶标,能够增加抗体结合。针对相同靶标上非重叠表位的多靶点抗体技术最接近于利用在天然多克隆抗体应答中发生的一级和二级亲合力相互作用的增强(图4a)。这些技术可以增加靶标占有率和局部Fc结构域密度,以增强抗体聚类和整体功能活性,有些甚至可能导致新的功能。靶向两种或两种以上细胞表面受体的抗体鸡尾酒疗法代表了通过学习天然多克隆抗体反应进行亲合力工程的典型示例。靶向多种细胞表面受体可通过交联和Fc–Fc相互作用增加抗体占有率(图3d)和抗原聚集,从而增强三阶亲合力相互作用。 图4:抗体亲合力工程策略
通过抗体效价调节亲合力:在过去几年中,增强抗体聚类以改善抗体功能的工程策略主要旨在通过复制片段和IgG样或IgM样结构中的抗体结合或Fc结构域来提高抗体效价。事实上,已经有几项研究报告了含多个Fc结构域的抗体形式的设计,以增强FcγR交联和ADCC。 通过寡聚化调节亲和力 调节与补体和FcγR的结合 对Fc结构域进行基因改造,以增强其与免疫效应分子的结合亲和力,旨在通过在较低抗体密度或抗体免疫复合物浓度下增加靶标占有率或延长相互作用时间(由于解离速率降低)来降低活化阈值。 结论与展望 抗体的功能依赖于抗体及其靶标之间的复杂相互作用及其与效应分子和免疫系统细胞的关联。有相当多的证据表明,亲合力在天然抗体生物学中的关键作用,从免疫应答早期的抗体亲和力成熟到靶标结合后的效应功能激活。靶向多个表位的抗体反应的多克隆性可增强所有水平的亲合力结合。尽管不同效应机制之间抗体亲合力相互作用转化为有效功能应答的阈值不同,但亲合力结合可被视为应答扩增前的检查点,在很大程度上决定了功能应答的疗效。因此,了解塑造抗体功能反应动力学的关键决定因素,包括多个水平的抗体亲合力相互作用和反应调节因子的平衡,对于掌握抗体作用机制和设计更有效的基于抗体的治疗药物至关重要。 参考文献: Oostindie, S.C., Lazar, G.A., Schuurman, J. et al. Avidity in antibody effector functions and biotherapeutic drug design. Nat Rev Drug Discov (2022). https://doi.org/10.1038/s41573-022-00501-8 如有侵权,请联系删除。 特别声明:以上文章内容仅代表作者本人观点,不代表新浪网观点或立场。如有关于作品内容、版权或其它问题请于作品发表后的30日内与新浪网联系。 |
【本文地址】