| 《中国药典》2020年版四部增修订之分析方法验证指导原则 | 您所在的位置:网站首页 › 广州防控办最新通知公告 › 《中国药典》2020年版四部增修订之分析方法验证指导原则 |
《中国药典》2020年版四部增修订之分析方法验证指导原则
|
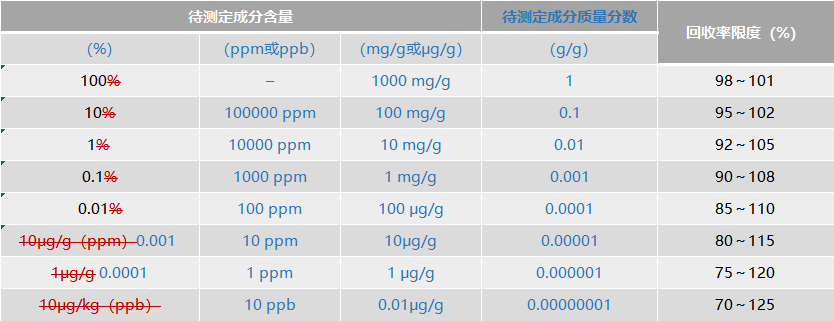
相对校正因子可采用替代物(对照品)和被替代物(待测物)标准曲线斜率比值进行比较获得;采用紫外吸收检测器时,可将替代物(对照品)和被替代物(待测物)在规定波长和溶剂条件下的吸收系数比值进行比较,计算获得。 4.数据要求 在规定范围内,取同一浓度(相当于100%浓度水平)的供试品,用至少测定6份样品的结果进行评价;或设计3种不同浓度,每种浓度分别制备3份供试品溶液进行测定,用9份样品的测定结果进行评价。 对于化学药,一般中间浓度加入量与所取供试品中待测定成分量之比控制在1:1左右,建议高、中、低浓度对照品加入量与所取供试品中待测定成分量之比控制在1.2:1,1:1,0.8:1左右,应报告已知加入量的回收率(%),或测定结果平均值与真实值之差及其相对标准偏差或置信区间(置信度一般为95%);对于中药,一般中间浓度加入量与所取供试品中待测定成分量之比控制在1:1左右,建议高、中、低浓度对照品加入量与所取供试品中待测定成分量之比控制在1.5:1,1:1,0.5:1左右,应报告供试品取样量、供试品中含有量、对照品加入量、测定结果和回收率(%)计算值,以及回收率(%)的相对标准偏差(RSD%)或置信区间。对于校正因子,应报告测定方法、测定结果和RSD%。样品中待测定成分含量和回收率限度关系可参考表2。 四、检测限 药品的鉴别试验和杂质检査方法,均应通过测试确定方法的检测限。 七、范围 在中药分析中,范围应根据分析方法的具体应用和线性、准确度、精密度结果及要求确定。对于有毒的、具特殊功效或药理作用的成分,其验证范围应大于被限定含量的区间。 校正因子测定时,范围一般应根据其应用对象的测定范围确定。 八、耐用性 高效液相色谱法中典型的变动因素 增 方法验证内容如下。 二、准确度 4.数据要求 美国药典论坛PF39(6) Requirements For Compendial Validation 中,准确度可接受标准:回收率=100%±2C-0.1505%,其中C为待测定成分含量。 三、精密度 4.数据要求 均应报告偏差、标准偏差、相对标准偏差或置信区间。样品中待测定成分含量和精密度RSD可接受范围参考表3(计算公式,重复性:RSD r= C-0.15;重现性:RSDR = 2C-0.15,其中C为待测定成分含量),可接受范围可在给出数值0.5~2倍区间。 改 3.调整内容 药品质量标准分析方法验证(analytical method validation)的目的是证明采用建立的方法适合于相应检测要求。在建立药品质量标准时,分析方法需经验证;在药品生产工艺变更、制剂的组分变更、原分析方法进行修订时,则质量标准分析方法也需进行验证。在建立药品质量标准、变更药品生产工艺或制剂组分、修订原分析方法时,需对分析方法进行验证。 验证的分析项目有:鉴别试验、限量或定量检查、原料药或制剂中有效成分含量测定,以及制剂中其他成分(如防腐剂等,中药中其他残留物、添加剂等)的测定。药品溶出度、释放度等检查中,其溶出量等的测定方法也应进行必要验证。鉴别试验、杂质测定(限度或定量分析)、含量测定和特性参数(如:药物溶出度、释放度等)。 验证的指标有:专属性、准确度、精密度(包括重复性、中间精密度和重现性)、专属性、检测限、定量限、线性、范围和耐用性。 三一、专属性 专属性系指在其他成分(如杂质、降解产物、辅料等)可能存在下,采用的分析方法能正确测定出被测物的能力。 一二、准确度 准确度系指采用该所建立方法测定的结果与真实值或参比值接近的程度,一般用回收率(%)表示。准确度应在规定的线性范围内测定试验。准确度也可由所测定的精密度、线性和专属性推算出来。 1.化学药含量测定方法的准确度 原料药采用对照品可用已知纯度的对照品或供试品进行测定,或用本法所得所测定结果与已知准确度的另一个方法测定的结果进行比较。 准确度也可由所测定的精密度、线性和专属性推算出来。 2.化学药杂质定量测定的准确度 可向原料药或制剂处方量空白辅料中加入已知量杂质对照品进行测定。如不能得到杂质或降解产物对照品,可用所建立的方法测定的结果与另一成熟的方法(如药典标准方法或经过验证的方法)进行比较,如药典标准方法或经过验证的方法。在不能测得杂质或降解产物的校正因子或不能测得对主成分的相对校正因子的情况下,可用不加校正因子的主成分自身对照法主成分的校正因子计算杂质含量。,并应明确表明单个杂质和杂质总量相当于主成分的重量比(%)或面积比(%)。 4.数据要求 表2 样品中待测定成分含量和回收率限度*
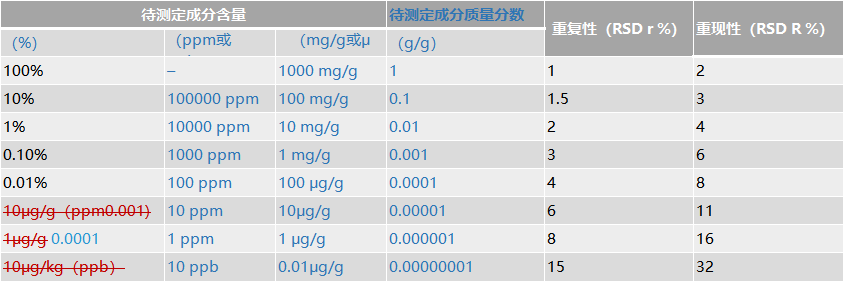
*此表源自AOAC《Guidelines for Single Laboratory Validation of Chemical Methods for Dietary Supplements and Botanicals》 二三、精密度 1.重复性 在规定范围内,取同一浓度(分析方法拟定的样品测定浓度,相当于100%浓度水平)的供试品,用至少测定6份的结果进行评价;或设计3种不同浓度,每种浓度分别制备3份供试品溶液进行测定,用9份样品的测定结果进行评价。采用9份测定结果进行评价时,浓度的设定应考虑样品的浓度范围。对于化学药,一般中间浓度加入量与所取供试品中待测定成分量之比控制在1:1左右,建议高、中、低浓度对照品加入量与所取供试品中待测定成分量之比控制在1.2:1,1:1,0.8:1左右,对于中药,一般中间浓度加入量与所取供试品中待测定成分量之比控制在1:1左右,建议高、中、低浓度对照品加入量与所取供试品中待测定成分量之比控制在1.5:1,1:1,0.5:1左右。 三、精密度 4.数据要求 表3 样品中待测定成分的含量和与精密度RSD可接受范围*
*此表源自AOAC《Guidelines for Single Laboratory Validation of Chemical Methods for Dietary Supplements and Botanicals》 同写意返回搜狐,查看更多 |
【本文地址】