| 【指南与共识】 | 您所在的位置:网站首页 › 子宫内膜类型abc是什么意思 › 【指南与共识】 |
【指南与共识】
|
曲芃芃天津市中心妇产科医院 邵建永中山大学肿瘤防治中心 师晓华中国医学科学院北京协和医院 苏 丹 中国科学院大学附属肿瘤医院 田小飞陕西省肿瘤医院 王丹波中国医科大学肿瘤医院/辽宁省肿瘤医院 王 静 湖南省肿瘤医院 王 珂 天津市肿瘤医院/天津医科大学肿瘤医院 王 莉 河南省肿瘤医院 吴令英中国医学科学院肿瘤医院 郗彦凤山西省肿瘤医院 向 阳 中国医学科学院北京协和医院 杨宏英云南省肿瘤医院/昆明医科大学第三附属医院 尹如铁四川大学华西第二医院 张师前山东大学齐鲁医院 张智弘江苏省人民医院/南京医科大学第一附属医院 周 琦 重庆大学附属肿瘤医院 周晓燕复旦大学附属肿瘤医院 朱笕青中国科学院大学附属肿瘤医院 邹冬玲重庆大学附属肿瘤医院
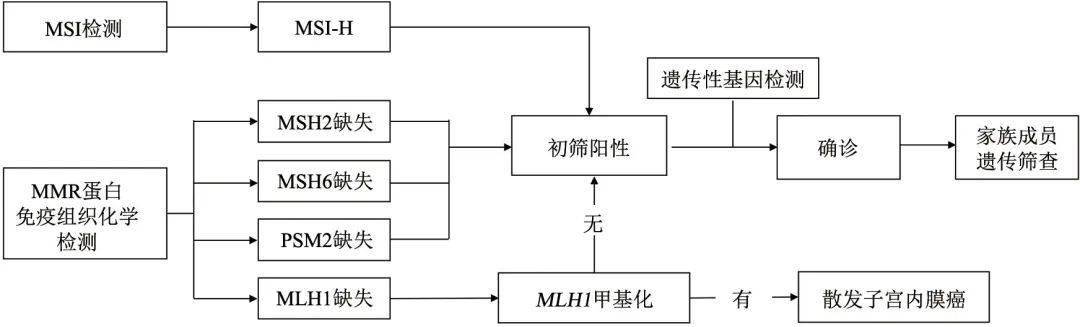
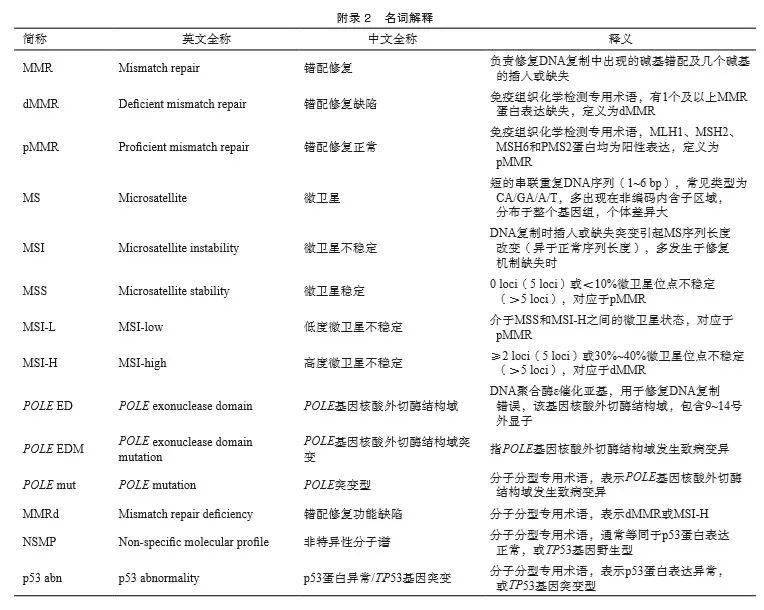
子宫内膜癌分子检测中国专家共识(2021年版) 中国抗癌协会妇科肿瘤专业委员会,中华医学会病理学分会,国家病理质控中心 [摘要] 近年来,高通量测序技术的发展加深了我们对子宫内膜癌发病机制和分子遗传特征的理解,基于分子遗传特征的个体化精准治疗,革新了子宫内膜癌的治疗模式。但国内对子宫内膜癌的遗传风险筛查流程、分子分型检测策略及其对患者预后评估和治疗选择的临床价值、晚期子宫内膜癌患者分子检测的选择及临床价值探讨和认识尚有不足。根据子宫内膜癌分子病理学检测与精准治疗领域的最新研究进展,中国抗癌协会妇科肿瘤专业委员会、中华医学会病理学分会及国家病理质控中心针对子宫内膜癌组织标本的分子病理学检测制订了《子宫内膜癌分子检测中国专家共识》(以下简称本共识),希望通过本共识,提高中国临床工作者对于子宫内膜癌分子检测的认识,以指导与规范子宫内膜癌分子检测在国内的临床应用。 [关键词] 子宫内膜癌;林奇综合征;分子分型;生物标志物; [Abstract]Recently, our understanding of the pathogenesis and molecular genetic characteristics of endometrial cancer has been improved along with the development of high-throughput sequencing technology. Precision medicine based on genetic characteristics has already transformed the care of endometrial cancer. However, there is no specific consensus in China on the methods and strategies of genetic screening for hereditary syndrome, molecular classification and other biomarkers testing in endometrial cancer. Based on the most recent advances in molecular classification and precision medicine in endometrial cancer, The Society of Gynecological Cancer of China Anti-Cancer Association, Chinese Society of Pathology of the Chinese Medical Association and National Pathology Quality Control Center have formulated “The Chinese Expert Consensus Recommendations on Molecular Testing in Endometrial Cancer”, in order to improve the understanding of molecular testing among gynecologic oncologists, pathologists, and other specialists, and further standardize the application of molecular testing in endometrial cancer in China. [Key words]Endometrial cancer; Lynch syndrome; Molecular classification; Biomarkers 子宫内膜癌是常见的妇科恶性肿瘤之一,发病率逐年上升。2020年中国子宫内膜癌新发病例81 964例,死亡病例16 607例 [1-2] 。风险因素包括高体重指数(body mass index,BMI)、糖尿病、代谢综合征、雌激素治疗、不孕、初潮早、绝经晚、林奇综合征、Cowden综合征、聚合酶校正相关息肉综合征(polymerase proofreading- associated polyposis,PPAP)等 [3-4] 。90%以上的子宫内膜癌患者发病年龄超过50岁,中位诊断年龄为63岁 [3] ;4%的患者诊断时小于40岁 [5] ,部分患者有保留生育功能的意愿。80%的子宫内膜癌患者诊断时为早期,肿瘤局限在子宫体内,其5年生存率大于95% [3] ,如有局部扩散或远处转移,则5年生存率分别降至68%或17% [6] 。 1983年Bokhman [7] 依据临床病理学特征和预后将子宫内膜癌分为两种类型:Ⅰ型为雌激素依赖型,与肥胖、高血脂、雌激素水平升高相关,包含1~2级的子宫内膜样癌,发现时多为早期,通常预后较好 [4] ;Ⅱ型为非雌激素依赖型,包含3级的子宫内膜样癌和非子宫内膜样肿瘤(如浆液性癌和透明细胞癌) [8] ,发现时偏晚期,预后较差 [9] 。Bokhman分型过于简单,Ⅰ和Ⅱ型定义标准相对模糊,重现性不好,重要区分因素(如肥胖或糖尿病、组织病理学特征)有时难以清晰定义Ⅰ和Ⅱ型;同时组织学诊断存在较大的观察者误差,例如部分高级别子宫内膜样癌与浆液性癌形态学特征相似,难以区分;且对患者复发风险分层不够精确,在指导后续治疗选择上的作用非常有限,无法有效地指导临床实践 [6,10] 。 2013年,癌症基因组图谱(The Cancer Genome Atlas,TCGA)多组学研究 [10] 全面揭示了子宫内膜癌的分子遗传图谱,提出新的分子分型策略,依据多组学特征和预后的关联性分为4个亚型: POLE (ultramutated)、MSI(hypermutated)、copy- number high(serous-like)和copy-number low(endometrioid),用于患者预后和复发风险评估。TCGA研究通过高通量测序进行分型,临床实现难度大,后被简化成ProMisE分型 [11] ,通过错配修复(mismatch repair,MMR)蛋白、p53蛋白和 POLE 基因检测进行分型(4种分子分型分别为 POLE EDM、MMR-D、p53 wt和p53 abn),与TCGA分型一致性非常高,更贴合临床实践,简单易操作,该分子分型遂逐步进入临床实践中。2016年,Stelloo等 [12] 结合ProMisE分型、 CTNNB 1 exon3突变和临床病理学风险因子,提出Trans-PORTEC分型(favorable、intermediate和unfavorable),对中高危患者进行精准的风险分层,分子分型开始用于指导临床辅助治疗的选择。2020年,分子分型被纳入美国国立综合癌症网络(National Comprehensive Cancer Network,NCCN)指南和世界卫生组织(World Health Organization,WHO)女性生殖器官肿瘤分类标准(第5版)中。2021年,基于分子分型的风险评估规则被纳入欧洲妇科肿瘤协会(European Society of Gynaecological Oncology,ESGO)指南中 [13] 。目前,国内关于分子分型的检测和临床应用还处于起步阶段,检测方法有待规范,对预后预测或辅助治疗选择的临床价值也需进一步讨论。 此外,3%~5%的子宫内膜癌与林奇综合征有关,中位发病年龄48岁,较普通患者早10~20岁。目前,国内对林奇综合征患者的筛查和临床管理流程的标准化认识尚有不足。同时,高通量测序技术的发展,加深了我们对子宫内膜癌发病机制和分子遗传特征的理解,基于分子遗传特征的个体化精准治疗,同样革新了子宫内膜癌的治疗手段,为复发或转移的患者提供了靶向治疗、免疫检查点抑制剂治疗等选择。鉴于上述情况和子宫内膜癌在分子分型、个体化治疗等领域的最新研究进展,我们针对子宫内膜癌肿瘤组织标本的分子病理学检测制订了《子宫内膜癌分子检测中国专家共识》(以下简称本共识),希望通过本共识,提高中国临床工作者对于子宫内膜癌分子检测的认识,提高中国子宫内膜癌的临床诊治水平。 所有新确诊的子宫内膜癌患者,推荐进行MMR/MSI状态检测,样本可为活检、刮宫或手术切除的肿瘤标本,检测具有以下临床价值: ①诊断:dMMR或MSI-H可以作为子宫内膜样癌的诊断标志物;②筛查:林奇综合征筛查;③预后:分子分型判断预后;④免疫治疗效果预测:预估免疫检查点抑制剂使用价值。国际妇科病理学家协会(International Society of Gynecological Pathologists,ISGyP)推荐对所有子宫内膜癌患者进行MMR/MSI状态检测,不论年龄 [14] 。曼彻斯特国际共识组同样推荐子宫内膜癌患者任何阶段可获取的肿瘤组织标本均可进行MMR/MSI状态检测 [15] (附录Ⅰ、Ⅱ)。 1 推荐对所有确诊的子宫内膜癌患者进行林奇综合征筛查 1.1 临床问题:子宫内膜癌的遗传风险筛查方法和临床管理流程 ⑴ 推荐对所有确诊的子宫内膜癌患者进行MMR/MSI状态检测,筛查林奇综合征,可选择活检、刮宫或手术切除的肿瘤标本(1类)。针对MLH1蛋白表达缺失的患者,有条件的医疗单位可考虑补充 MLH 1基因启动子甲基化检测, MLH 1基因启动子高甲基化状态提示散发可能性大(2B类)。 ⑵ 符合以下任一检测标准时,推荐对子宫内膜癌患者进行遗传咨询及林奇综合征相关MMR 基因胚系突变检测以确诊林奇综合征,检测的基因应包括MMR基因( MLH 1、 PMS 2、 MSH 2和 MSH 6)和 EPCAM 基因,建议选择外周血标本进行检测(1类)。检测标准:①任何肿瘤组织检测结果为dMMR或MSI-H的子宫内膜癌患者;②肿瘤组织筛查结果为pMMR或MSS[欧洲肿瘤内科学会(European Society of Medical Oncology,ESMO)指南推荐MSI-L和MSS均归类为MSS [16] ],但是临床高度可疑林奇综合征的患者;③有血缘关系的家族成员确诊为林奇综合征者;④在肿瘤组织中检测到MMR基因致病性突变但不能明确是否为胚系突变的患者(肿瘤组织MMR基因突变检测并非林奇综合征的常规筛查手段)。 ⑶ 推荐对确诊为林奇综合征的子宫内膜癌患者进行遗传咨询和遗传管理,同时推荐对其直系亲属针对该致病位点进行逐级检测(cascade testing)(1类)。 1.2 文献综述和分析 1.2.1 背景 子宫内膜癌相关的遗传综合征有林奇综合征、Cowden综合征(由 PTEN 基因胚系突变引起)和PPAP(由POLE和POLD1基因胚系突变引起),人群发生率分别为3.0%~5.0%、0.1%和0.1%~0.4% [17-21] 。普通人群患子宫内膜癌的风险为3.1%,林奇综合征患者患子宫内膜癌和结直肠癌的风险增加到40%~60% [22-23] ,因此NCCN指南将林奇综合征纳入子宫内膜癌常规遗传风险筛查范围,Cowden综合征和PPAP则未被纳入。林奇综合征主要是由MMR基因( MLH 1、 PMS 2、 MSH 2和 MSH 6)或 EPCAM 基因胚系突变引起的, EPCAM 基因的3'末端外显子缺失导致 MSH 2基因启动子高甲基化使 MSH 2功能失活,从而形成林奇综合征表型 [24-26] 。 1.2.2 林奇综合征确诊方法和高危人群特征 NCCN指南推荐通过MMR/MSI状态检测对子宫内膜癌患者进行林奇综合征筛查,对dMMR或MSI-H患者进行林奇综合征相关MMR基因( MLH 1、 PMS 2、 MSH 2和 MSH 6) 和 EPCAM 基因胚系突变检测确诊 [27] 。检测标本可为活检、刮宫或手术切除的肿瘤标本,术前标本(活检或刮宫)和手术切除肿瘤标本的MMR/MSI状态检测结果高度一致 [28] ,且二者间的p53蛋白水平检测结果也高度一致 [29] 。有研究 [30-31] 显示,MMR蛋白水平(免疫组织化学法)和MSI检测[聚合酶链反应(polymerase chain reaction,PCR)法]的一致性为90.4%~93.4%。林奇综合征相关的子宫内膜癌高危人群具有如下特征 [13,27] :①PMS2(MLH1正常)、MSH2或MSH6蛋白中任一蛋白表达缺失者;②MLH1蛋白表达缺失,且 MLH 1基因启动子未见高甲基化者;③MSI-H;④临床高度怀疑林奇综合征时,无论MMR状态如何,可疑特征包括本人有同时或异时发生林奇综合征相关肿瘤史,或有子宫内膜癌、结直肠癌或其他林奇综合征相关肿瘤家族史的患者;⑤有血缘关系的家族成员确诊为林奇综合征者。林奇综合征相关肿瘤史包括结直肠癌、子宫内膜癌、胃癌、卵巢癌、胰腺癌、尿路上皮癌、脑肿瘤(通常是恶性胶质瘤)、胆管癌、小肠肿瘤、皮脂腺瘤、皮脂腺癌和角化棘皮瘤 [27] 。 1.2.3 MMR状态检测 了解MMR状态可通过采用免疫组织化学法检测MLH1、MSH2、MSH6和PMS2蛋白表达,结果分为dMMR和pMMR。ISGyP指南推荐优先进行MMR状态检测 [14] ,评估上述4种蛋白的表达;更为经济的简化方法为先检测PMS2和MSH6 [32-34] ,如果PMS2和(或)MSH6蛋白表达异常,仍建议补充MLH1和MSH2蛋白检测。当MLH1蛋白缺失时,进一步补充 MLH 1基因启动子甲基化检测(图1)。发生MLH1蛋白缺失时, MLH 1基因启动子甲基化或 BRAF V600E检测(仅适用于结直肠癌)常用于判断散发性肿瘤。散发性事件多由MMR双等位基因体细胞突变(两个致病性变异或一个致病性变异和杂合性缺失)或 MLH 1基因启动子高甲基化引起 [35-36] ,中国子宫内膜癌患者散发性事件具有dMMR者占比可达80% [2] 。 BRAF V600E突变常见于 MLH 1基因启动子甲基化引起的散发性结直肠癌患者 [37] ;子宫内膜癌患者 BRAF 基因突变频率极低,且与 MLH 1基因启动子甲基化不相关,因此筛查林奇综合征时无需检测 BRAF V600E突变 [32,38-39] 。免疫组织化学方法检测的局限性:组织处理、抗体质量、染色技术与流程、染色结果分析等均可能导致结果出现误读或难以判读。
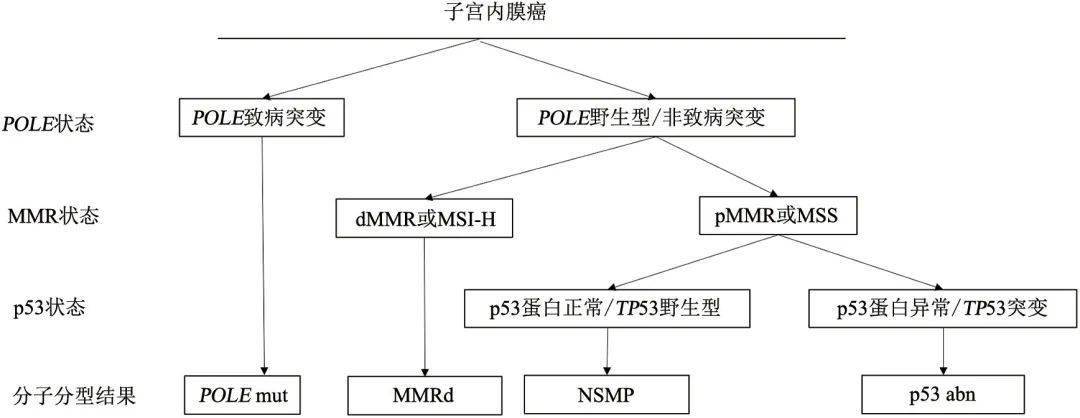
图 1 MMR/MSI状态检测指导子宫内膜癌林奇综合征筛查 1.2.4 MSI状态检测 MSI状态可通过PCR法(MSI-PCR)或高通量测序方法(MSI-NGS)进行判断,结果分为MSI-H、MSI-L和MSS。MSI-PCR检测需同时采集肿瘤标本和配对正常外周血标本。在子宫内膜癌和结直肠癌中,MSI-PCR、MSI-NGS和MMR蛋白检测结果一致性高 [28-31,40] 。但MSI-NGS检测在国内尚缺乏统一标准,对检测平台的仪器、技术和生信分析能力有着更高的要求 [40] 。MSI检测细节可参考MSI检测ESMO指南[16]。MSI检测的问题包括:①14%的患者因为DNA抽提产量低或DNA质量不佳导致检测失败;②当检测标本中肿瘤细胞纯度低于30%时,易导致假阴性 [41] 。另外,约30%的MSH6基因胚系突变的子宫内膜癌患者可能表现为MSS,单独进行MSI检测时会被漏检。因此,建议对初诊的子宫内膜癌患者进行MMR/MSI状态检测筛查林奇综合征,必要时建议结合临床病理学特征和家族史综合判断。 1.2.5 单肿瘤组织基因测序 有研究团队采用肿瘤单组织测序对465例Ⅳ期结直肠癌患者进行林奇综合征筛查,灵敏度可达100.0%,特异度为95.3% [42] ,而常规MMR/MSI检测联合 BRAF V600E筛查会漏检10%的林奇综合征患者,该团队提出肿瘤单组织测序可作为晚期患者筛查的首选方案,在进行遗传风险评估的同时,还可获取结直肠癌重要靶点突变信息,提供更多的治疗选择。在初诊的子宫内膜癌患者中筛查林奇综合征时,可考虑采用高通量测序方法替代常规MMR/MSI检测,直接对肿瘤组织(不含配对正常样本)进行高深度靶向多基因检测,检测基因范围:可包含 MLH 1、 MSH 2、 MSH 6基因的所有外显子区、内含子区和基因上下游区域, PMS 2基因所有的外显子区, EPCAM 基因的所有外显子区 [42] 。另外,建议补充 POLE 基因和TP53基因检测( POLE 基因建议覆盖 POLE 基因核酸外切酶结构域9~14号外显子, TP 53基因建议覆盖该基因全部外显子及邻近剪切位点),筛查时还可同时进行分子分型评估。肿瘤组织标本中检测到任一MMR基因致病突变(致病性判定规则参考相关研究 [42] ),在不能排除胚系突变可能性时,需要进一步针对该位点进行胚系突变检测验证。 1.3 临床解读 推荐对所有确诊的子宫内膜癌患者进行MMR/MSI状态检测筛查林奇综合征。若初诊子宫内膜癌患者同时进行分子分型检测和林奇综合征筛查,MMR/MSI的检测建议参考MMRd亚型的检测方法进行。肿瘤组织检测结果为dMMR或MSI-H的患者,推荐进行林奇综合征相关MMR基因胚系突变检测。鉴于存在MMR蛋白和MSI检测结果不一致及误判的现象,尤其是MSH6基因胚系突变的子宫内膜癌患者MSI的检测灵敏度仅约70.0% [25,43-44] ,针对判读结果有争议的部分子宫内膜癌患者建议对MMR状态、MSI状态、临床病理学特征和家族史进行综合分析,以决定是否需要进行林奇综合征相关MMR基因胚系突变检测。建议对明确为林奇综合征的患者进行遗传咨询和遗传管理,需强调进行其他相关恶性肿瘤的筛查及随访,同时推荐对与其有血缘关系的亲属尽早进行遗传咨询及基因检测,以便制定相应的遗传管理措施。 2 推荐对所有确诊的子宫内膜癌患者进行分子分型 2.1 临床问题:子宫内膜癌分子分型检测策略及其对患者预后评估和治疗选择的临床价值 ⑴ 推荐对所有确诊的子宫内膜癌患者进行分子分型,检测样本可选择活检、刮宫或手术切除的肿瘤标本(2A类)。 ⑵ 在资源有限地区,不能对所有子宫内膜癌患者进行普遍检测时,对于术后传统临床病理学评估提示不需要进行辅助治疗的患者,可考虑省略 POLE 基因突变检测,但仍建议进行MMR/MSI状态和p53状态检测(3类)。 ⑶ 推荐结合 POLE 基因核酸外切酶结构域突变状态、MMR/MSI状态和p53状态进行分子分型。根据WHO女性生殖器官肿瘤分类(第5版)分为4种类型: POLE mut、MMRd、p53 abn和NSMP。 分子分型检测方案:①基本推荐,联合 POLE 基因热点突变检测(Sanger测序),MMR蛋白检测(免疫组织化学法)/MSI检测(PCR法)和p53蛋白检测(免疫组织化学法)进行分子分型(2A类)。②可选推荐,采用高通量测序方法检测 POLE 基因突变、MSI状态和 TP 53基因突变,进行分子分型(2B类)。③其他组合选择,除上述方案之外,能明确 POLE 基因突变状态、MMR/MSI状态、p53状态的方法组合 (3类)。 POLE 基因突变检测,包括热点突变检测(2A类)或 POLE 基因核酸外切酶结构域致病性突变检测(2B类)。 建议遵循以下判读顺序进行分子分型: ①首先依据POLE 基因检测结果进行判断,发生POLE 基因致病变异时,则判定为POLE mut;②在POLE 基因为野生型或发生非致病变异时,再依据MMR/MSI状态进行判断,若为dMMR或MSI-H,则判定为MMRd;③若MMR/MSI状态为pMMR或MSS(MSI-L和MSS均归类为MSS)时,进一步依据p53状态进行判断,若p53蛋白表达异常或TP 53基因为突变状态,则判定为p53 abn;若p53蛋白表达正常或TP 53基因为野生型状态,则判定为NSMP(2A类)。 2.2 文献综述和分析 2.2.1 分子分型发展背景 子宫内膜癌患者一般预后较好,但仍有15%~20%的人群具有复发风险 [45] 。常规组织病理学检查仍然是区分子宫内膜癌亚型及评估复发风险的重要工具,但存在一定的观察者误差 [46] 。2013年,TCGA研究 [10] 提出子宫内膜癌分子分型,依据分子表型判断预后,分为4个亚型: POLE (ultramutated)、MSI(hypermutated)、copy-number high(serous-like)和copy-number low(endometrioid)。其中 POLE 亚型预后最好,copy-number high亚型预后最差。2015年,Talhouk等 [11] 提出ProMisE分型方法,更贴合临床实践,简单易操作,采用3个免疫组织化学标志物(p53、MSH6和PMS2)和1个分子检测( POLE 基因核酸外切酶结构域突变),分为4个亚型(表1) [47] ,这种分型的有效性已被证实,在独立和前瞻性的临床研究中,对高级别和高危人群的预后判断非常一致 [11,48] 。2016年,Stelloo等 [12] 在ProMisE分型基础上,结合L 1CAM高表达(>10%) [49-50] 、CTNNB1外显子3突变 [51] 和淋巴血管间隙浸润(lymphovascular space invasion,LVSI) [52] 进一步提出Trans-PORTEC分型,对于NSMP的低级别子宫内膜癌可进行更精准的风险分层。分子分型可能适用于所有子宫内膜癌亚型 [13,41,53] ,但是目前与预后相关的研究中纳入的病例主要为子宫内膜样癌和浆液性癌,在少见组织学亚型(如去/未分化子宫内膜癌等)中的临床应用价值有待于进一步阐明。 POLE mut子宫内膜样癌和浆液性癌有相似的组织形态学特征,且不少子宫内膜样和浆液性混合性癌表现为 POLE mut或MMRd特征,也有一些为p53 abn,因此即使对于较为明确的浆液性癌,仍然建议进行分子分型检测,避免过度治疗 [53] 。目前仍在探索进一步精准分层的标志物,例如对于MMRd子宫内膜样癌,MLH1基因启动子甲基化状态有可能作为进一步分层的标志物,发生MLH1基因启动子甲基化的肿瘤预后要差于发生MMR基因突变的肿瘤 [54] 。另有小型研究 [55] 表明,1q32.1拷贝数扩增可能是NSMP组的不良预后因素。 2.2.2 分子分型命名 分子分型检测样本,可选择活检、刮宫或手术切除肿瘤标本。推荐结合 POLE 基因核酸外切酶结构域突变状态、MMR/MSI状态和p53状态进行综合判定,分为4种亚型[与WHO女性生殖器官肿瘤分类(第5版)命名保持一致]: POLE mut( POLE mutation)、MMRd(MMR deficiency)、p53 abn(p53 abnormality)和NSMP(non-specific molecular profile)。 2.2.3 分子分型检测内容及方法 ⑴ POLE mut检测,包括热点突变检测(2A类)或 POLE 基因核酸外切酶结构域致病突变检测(2B类) [45] 。 POLE 基因编码DNA聚合酶ε催化亚基,用于修复DNA复制错误,该基因核酸外切酶结构域包含外显子9~14,该区域发生致病突变将导致子宫内膜癌表现“超突变”表型(≥100个突变/Mb) [56] 。80%以上的 POLE 基因致病变异发生在9号和13号外显子,常见的5个热点突变包括P286R、V411L、S297F、A456P和S459F,覆盖95.3%的已知 POLE 基因致病变异位点。在条件允许的情况下,可考虑 POLE 基因核酸外切酶结构域致病突变检测,推荐检测范围覆盖 POLE 基因9~14号外显子区域,可采用高通量测序方法进行,该区域变异的致病性依据COSMIC 10 signature、突变类型、肿瘤突变负荷(tumor mutation burden,TMB)、复现突变等因素进行综合判定,具体判读规则可参考相关研究 [47] 。 POLE 基因核酸外切酶结构域发生致病变异和非致病变异的患者,5年无复发生存率分别为92.3%和76.2%, POLE 基因核酸外切酶结构域非致病变异与 POLE 基因野生型患者5年无复发生存率相似 [47] 。 ⑵ MMR/MSI状态检测:推荐MMR蛋白(免疫组织化学法)或MSI(PCR法或高通量测序方法)检测。免疫组织化学法检测4个MMR蛋白( MLH 1、 PMS 2、 MSH 2和 MSH 6)的表达情况。肿瘤细胞核4个MMR蛋白表达完整/正常为pMMR,肿瘤细胞核一个或多个MMR蛋白表达缺失/异常为dMMR。MMR蛋白免疫组织化学检测结果的判读需要紧密结合内对照细胞(与肿瘤细胞紧密相邻的间质细胞和炎症细胞)的染色状态。dMMR或MSI-H可判断为MMRd。理论上MMR蛋白免疫组织化学检测与DNA MSI检测 (PCR或高通量测序)检测结果应具有高度一致性。但每种方法都有其优点与局限性,实际工作中有时候需要互相补充。值得注意的是,在少数子宫内膜癌病例中肿瘤组织的MMR/MSI状态具有异质性,可能会导致MMR蛋白免疫组织化学检测与DNA MSI检测结果不一致,MMR蛋白免疫组织化学检测可以更直观地观察到这种异质性。 ⑶ p53状态:推荐p53蛋白表达(免疫组织化学法)或 TP 53基因突变(高通量测序方法)检测进行判断。TCGA研究 [10] 中, TP 53基因突变在copy-number high和copy-number low两个分子表型中互斥。Copy-number high(serous- like)组常见 TP 53基因突变(突变类型包括无义突变、错义突变、插入缺失、移码突变和剪切变异,即影响p53蛋白氨基酸序列的突变),发生比例约92.0%。因此, TP 53基因突变可用于替代copy-number high分型,而p53蛋白免疫组织化学检测和 TP 53基因突变一致性可达92.1% [57] ,临床实践中采用p53蛋白免疫组织化学检测更易实现,但需注意由此可能导致约15%的copy-number high人群被分类到NSMP组 [10,58] 。p53蛋白免疫组织化学表达呈现完全阴性、细胞核弥漫强阳性表达或细胞质表达时,为p53蛋白表达异常,提示 TP 53基因为突变状态。p53蛋白表达呈现细胞核散在阳性时,为p53蛋白表达正常,提示 TP 53基因为野生型状态。高通量方法检测 TP 53基因突变建议覆盖 TP 53基因所有外显子区及邻近剪切位点,发生任何无义突变、错义突变、插入缺失、移码突变和剪切变异等变异,提示 TP 53基因为突变状态 [10] 。 TP 53基因发生同义突变或无任何突变,可判断 TP 53基因为野生型状态。需要留意的是, TP 53基因大片段缺失也可能造成p53蛋白功能异常,若基因检测结果与p53蛋白免疫组织化学(判读与染色没有问题的前提下)及形态学结果不符合,必要时可以进行 TP 53基因大片段缺失的检测。 2.2.4 分子分型检测方案 ⑴ 基本推荐(经济性):联合 POLE 基因热点突变检测(Sanger测序)、MMR蛋白检测(免疫组织化学法)/MSI检测(PCR法)和p53蛋白检测(免疫组织化学法)进行分子分型(2A类)。 ⑵ 可选推荐(国内检测现状):采用高通量测序方法检测 POLE 基因突变、MSI状态和 TP 53基因突变进行分子分型(2B类)。 POLE 基因突变检测包括热点突变检测(2A类)或 POLE 基因核酸外切酶结构域致病突变检测(2B类)。 ⑶ 其他组合选择(各医疗单位可及性):除上述方案之外,推荐能明确 POLE 基因突变状态、MMR/MSI状态、p53状态的方法组合(3类)。 2.2.5 分子分型的判读顺序 3%~5%的患者存在多重分子亚型(multiple classifier) [48,59-60] ,针对多重分子亚型病例的预后研究提示,同时发生 POLE mut和p53 abn的病例,建议归类为 POLE mut [45,59] ;同时发生 POLE mut和MMRd的病例,建议归类为 POLE mut [47] ;同时发生MMRd和p53 abn的病例,建议归类为MMRd [45-46,60] 。因此分子分型建议遵循以下判读顺序(图2):①首先依据 POLE 基因检测结果进行判断,发生 POLE 基因致病变异时,则判定为 POLE mut;②在 POLE 基因为野生型或发生非致病变异时,再依据MMR/MSI状态进行判断,若为dMMR或MSI-H,则判定为MMRd;③若MMR/MSI状态为pMMR或MSS(MSI-L和MSS均归类为MSS)时,进一步依据p53状态进行判断,若p53蛋白表达异常或 TP 53基因为突变状态,则判定为p53 abn,若p53蛋白表达正常或 TP 53基因为野生型状态,则判定为NSMP(2A类)。
图 2 分子分型推荐检测路径 [60] 本图MSS包含MSI-L和MSS。2019年ESMO指南建议取消MSI-H和MSI-L描述,推荐MSI检测结果分为MSI和MSS,将MSI-H归类为MSI, 将MSI-L和MSS归类为MSS 2.3 临床解读 2.3.1 分子分型预后风险评估价值 ProMisE分型方法在低、中、高危的子宫内膜癌患者中被证实具有预后指导价值。 POLE mut预后最好,MMRd/NSMP预后居中,p53 abn预后最差,这与传统临床病理学评估结果可能存在不一致的现象 [48] 。Trans-PORTEC回顾性研究PORTEC-1和2中-高危子宫内膜癌,探究雌激素受体(estrogen receptor,ER)/孕激素受体(progesterone receptor,PR)表达、 CTNNB 1基因突变、L1CAM表达、LVSI及分子分型与复发风险的关系,依据分子分型结果对临床病理学评估的中-高危患者进一步细分,其中15%的患者被调整为高危、50%的患者被调整为低危,通过分子分型提升了早期子宫内膜癌复发风险评估的准确性 [12] 。 2.3.1.1 2021 ESGO/欧洲放射肿瘤学会 (European Society for Therapeutic Radiation Oncology,ESTRO)/欧洲病理学家协会(European Society of Pathologists,ESP)指南提出分子分型预后分层要点 ①Ⅰ~Ⅱ期的 POLE mut子宫内膜癌(无残留病灶)归类为低危组 [10] ;②ⅠA期的p53 abn和(或)非子宫内膜样肿瘤(无子宫肌层浸润)归类为中危组;③Ⅰ~ⅣA期的p53 abn子宫内膜癌和NSMP/MMRd非子宫内膜样肿瘤(发生子宫肌层浸润、无残留病灶)归类为高危组。传统临床病理学评估的低危子宫内膜癌患者,不建议辅助治疗 [13] 。已知分子分型的Ⅰ~Ⅱ期[本共识采用2009年国际妇产科联盟(International Federation of Gynecology and Obstetrics,FIGO)分期] POLE mut子宫内膜癌患者,可考虑省略辅助治疗 [13] 。因此,低危患者在进行分子分型时,可考虑省略 POLE 基因突变分析(证据不足,存在争议),但仍推荐进行MMR/MSI状态和p53状态检测 [13] ,考虑到极少患者表现 POLE mut和p53 abn双重分子表型特征 [59,61] ,对被判读为p53 abn的低危子宫内膜癌患者,仍建议补充 POLE 基因突变检测。 2.3.1.2 基于分子分型的预后风险定义 ISGyP指南推荐,传统的病理学特征(如组织学类型、组织学级别、子宫肌层浸润程度和LVSI)是评估子宫内膜癌患者预后风险的重要因素 [14] 。组织病理学分类依照WHO女性生殖器官肿瘤分类标准(第5版)进行 [62] 。推荐对子宫内膜癌进行FIGO分级,G1和G2是低级别,G3是高级别。评估子宫肌层浸润程度时,需考虑子宫内膜和子宫肌层衔接处情况 [63] 。分子分型给常规形态学特征增加了另一维度的信息,建议整合到病理报告中(表2)。 一项真实世界研究 [61] 显示,部分高级别或Ⅱ~Ⅲ期子宫内膜癌的分子分型结果是预后相对较好的 POLE mut或MMRd亚型,基于分子分型评估的复发风险低于基于ESMO指南病理学评估的复发风险。PORTEC-3研究 [64] 提示,对于高级别或高危子宫内膜癌,分子分型会影响辅助治疗方案。当分子分型工具不可及时,建议采用传统的临床病理学特征进行分型(表2)。
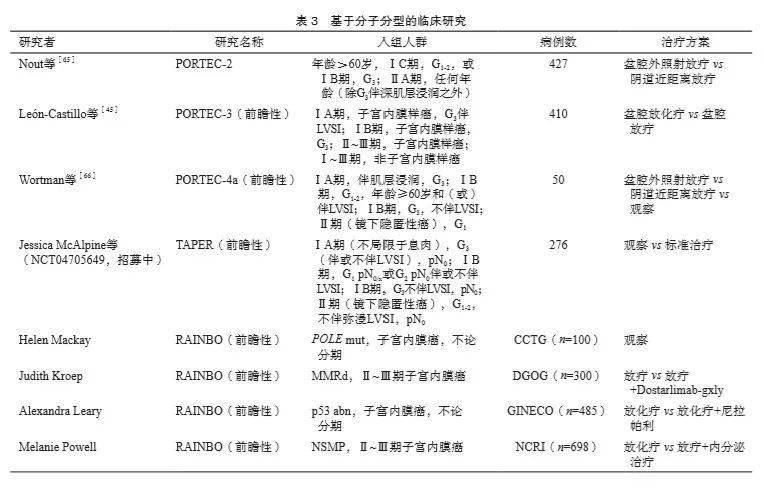
2.3.2 分子分型和临床辅助治疗决策 分子分型对于辅助治疗具有指导作用,在高级别和(或)高危子宫内膜癌患者中对5年无复发生存率和5年总生存率的影响更为显著 [45] 。PORTEC-3研究 [45] 评估辅助放化疗对高危子宫内膜癌(ⅠA期G 3 子宫内膜样癌伴深肌层浸润或LVSI、ⅠB期G 3 子宫内膜样癌、Ⅱ~Ⅲ期子宫内膜样癌或Ⅰ~Ⅲ期浆液性癌或透明细胞癌)5年总生存率的影响,结果显示,与辅助放疗相比,辅助放化疗并未提高总人群的5年总生存率(81.8% vs 76.7%, P =0.11);p53 abn亚组患者,辅助放化疗可显著提高5年无复发生存率(58.6% vs 36.2%, P =0.021)和5年总生存率(64.9% vs 41.8%, P =0.049)(表3), POLE mut/MMRd/NSMP亚型患者,辅助放化疗和辅助放疗的5年无复发生存率和总生存率差异无统计学意义( P >0.05),提示分子分型是对高危患者复发风险评估的重要补充。 正在进行的基于分子分型的前瞻性临床研究包括PORTEC-4a和TAPER(表3),还有即将开展的RAINBO伞形研究(https://www.nvog.nl/koepels-en-pijlers/pijler-oncologie/dgog/lopende-studies/rainbo/)。回顾性Trans- PORTEC研究 [12] 和正在进行的前瞻性PORTEC-4a、TAPER、RAINBO研究逐步明确了分子分型在子宫内膜癌患者临床诊疗中的发展方向和应用价值,期待后续研究在预后风险评估、指导辅助治疗和药物治疗{多腺苷二磷酸核糖聚合酶[poly (ADP-ribose) polymerase,PARP]抑制剂治疗、内分泌治疗、免疫治疗}等方面积累高质量的数据,从而完善子宫内膜癌的疾病管理。
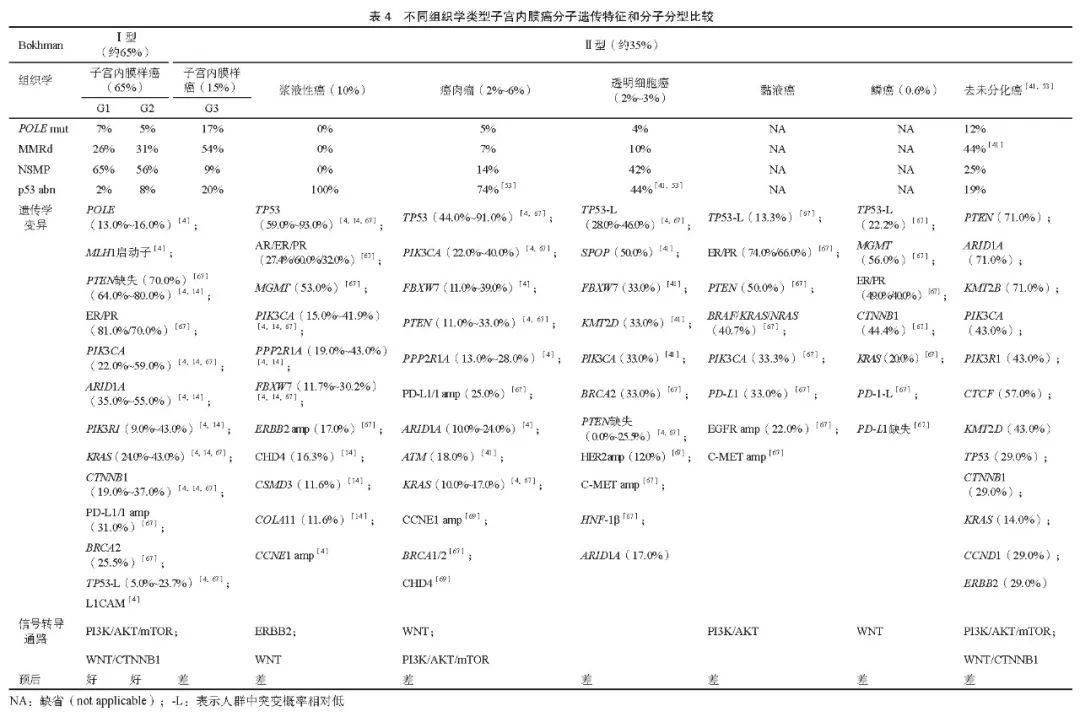
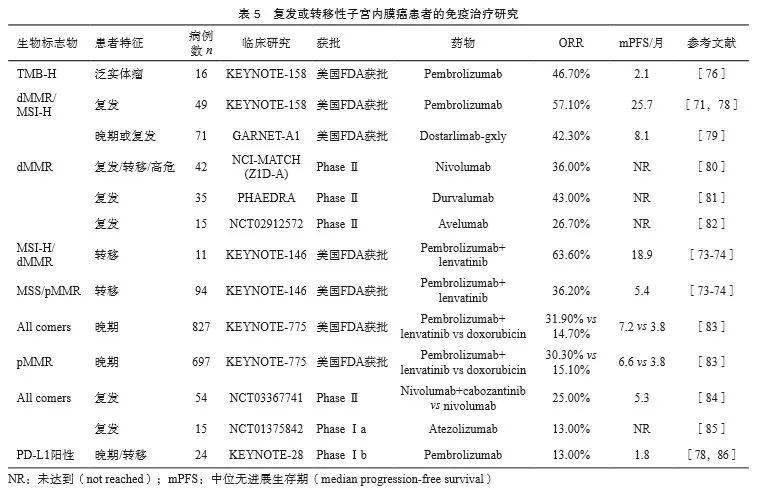
3 复发或转移子宫内膜癌的生物标志物检测 3.1 临床问题:复发或转移的子宫内膜癌患者分子检测的选择及其临床价值 ⑴ Ⅲ~Ⅳ期或复发的浆液性子宫内膜癌患者,推荐采用免疫组织化学法或荧光原位杂交(fluorescence in situ hybridization,FISH)实验检测HER2蛋白水平或基因扩增状态,评估抗HER2靶向治疗的机会(2A类)。 ⑵ 推荐采用高通量测序方法检测 TMB 、 NTRK 基因融合,以评估免疫治疗或 NTRK 靶向治疗的机会(2A类)。同时可考虑检测更多的靶点,如 PIK 3 CA 、 KRAS 、 AKT 1、 FBXW 7和 PTEN 等,寻求跨癌种用药适应证及泛癌种临床试验入组机会(3类)。 3.2 文献综述和分析 3.2.1 分子遗传特征 不同组织病理学亚型的子宫内膜癌患者有特定的形态学和分子遗传特征。子宫内膜样癌倾向于发生MSI、 POLE 、 PTEN 、 KRAS 、 CTNNB 1、 PIK 3 CA 、 MLH 1基因启动子甲基化等改变 [4] ;非子宫内膜样肿瘤则容易出现 TP 53基因突变 [8] (表4)。分子遗传特征决定了子宫内膜癌患者靶向治疗的用药逻辑和依据。
3.2.2 免疫治疗生物标志物
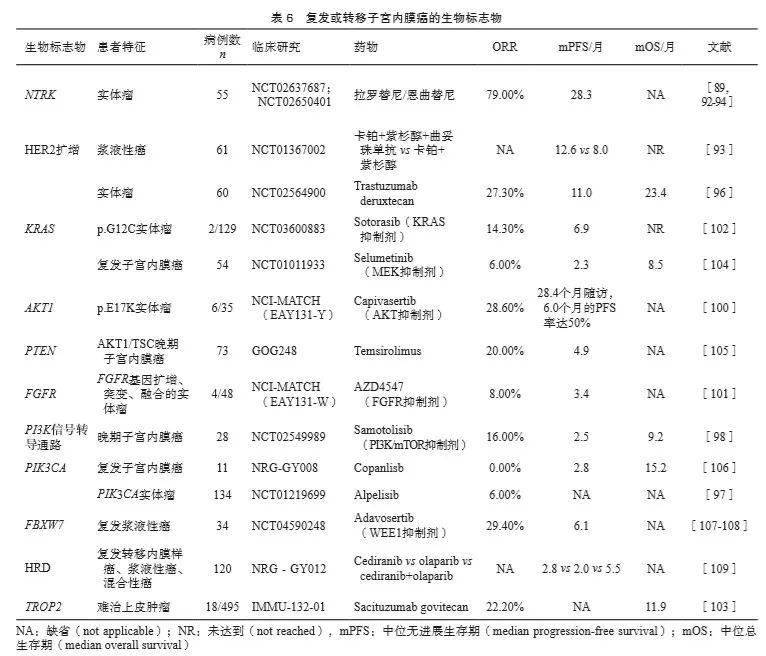
3.2.3 靶向治疗生物标志物 67%~91%的子宫内膜癌患者中存在至少一个可能提示美国FDA批准药物或临床试验阶段药物靶点的基因变异 [87-88] 。美国FDA已批准的子宫内膜癌用药靶点有 NTRK 和HER2(表6)。 NTRK 融合基因在实体瘤中的整体检出率仅为0.5%~ 1.0% [89] ,目前美国FDA批准拉罗替尼和恩曲替尼用于复发或转移的子宫内膜癌患者 [90] ,该药物在实体瘤中的ORR可达57%~79% [91-92] 。约30%的子宫浆液性癌存在HER2过表达。一项Ⅱ期随机临床研究 [93] 发现,在HER2过表达的子宫浆液性癌患者中,一线治疗时在卡铂联合紫杉醇的基础上联用曲妥珠单抗可显著延长4.6个月的中位无进展生存期。此外,在复发子宫内膜癌患者中同样有临床获益 [94-95] 。有研究 [96] 报道,HER2过表达或 ERBB 2基因突变的晚期实体瘤患者可考虑使用曲妥珠单抗偶联药物trastugumab deruxtecan治疗,入组2例子宫内膜癌患者均达到部分缓解。 3.2.4 其他生物标志物 目前还有一些泛癌种临床研究探究PI3K/AKT/mTOR、 KRAS 、 AKT 1、 FGFR 2、 FBXW 7和 PTEN 基因等靶向治疗效果(表6); PIK 3 CA 在子宫内膜癌中发生比例为22%~59%,目前针对该靶点泛癌种研究的药物有alpelisib(ORR为6.0%,唯一1例完全缓解的为子宫内膜癌,另有1例部分缓解) [97] 、samotosilib(晚期子宫内膜癌患者ORR为16.0%) [98] 、sapanisertib(针对后线泛实体瘤,ORR为13.6%,该研究入组2例子宫内膜癌患者,其中1例达到部分缓解) [99] 。 AKT 1 E17K(NCI-MATCH EAY131-Y):入组6例 AKT 1 E17K突变的子宫内膜癌患者,采用AKT抑制剂capivasertib治疗,1例达到完全缓解,治疗持续时间35.6个月 [100] 。 FGFR (NCI-MATCH EAY131-W):针对 FGFR 突变和融合的AZD4547(一种 FGFR 抑制剂),总人群的ORR约8.0%;入组4例 FGFR 2/3点突变的子宫内govitecan治疗难治性子宫内膜癌的ORR达22.0%,总生存期为11.9个月 [103] 。
3.2.5 ER/PR阳性 内分泌治疗常用于有生育需求的复发子宫内膜癌患者,其ORR达55% [110] 。低级别子宫内膜样、ER/PR阳性的子宫内膜癌患者获益最大 [6] 。但ER表达状态并不是内分泌治疗的决定性标志物,一些研究 [111-112] 表明,ER阴性患者同样可受益。内分泌治疗药物包括醋酸甲羟孕酮、合成孕激素、促黄体素释放激素(luteinizing hormone releasing hormone,LHRH)拮抗剂,他莫昔芬和新一代选择性ER调节剂,每种药物都有不同的分子机理,药物活性不同 [112] ,优先考虑孕激素 [113] ,替代性选择是芳香化酶抑制剂、他莫昔芬和氟维司群。PARAGON研究 [114] 纳入82例复发、ER/PR阳性的子宫内膜癌患者,使用anastrazole治疗的ORR为7%,6个月临床获益率达44%。一项单臂Ⅱ期研究 [115] 纳入35例复发的子宫内膜癌患者,来曲唑联合依维莫司临床获益率可达40%。另一项研究 [116] 纳入62例复发、PR阳性子宫内膜癌患者,来曲唑、依维莫司联合二甲双胍具有更高的临床获益率(PR阳性 vs PR阴性:89.5% vs 27.3%)。内分泌治疗过程中应考虑血栓风险。转移性肿瘤进展过程中ER和PR的表达会发生变化 [6] ,原发灶ER和PR状态不能反映复发病灶或转移灶的实时状态,因此对于复发或转移的子宫内膜癌患者推荐进行活检,进一步确认ER和PR表达情况 [117] 。 3.3 临床解读 Ⅲ~Ⅳ期或复发浆液性癌可考虑进行HER2过表达检测,免疫组织化学法结果有争议时,推荐采用FISH检测进行确认;在采用高通量测序技术进行其他靶点检测的同时,也可以考虑进行ERBB2基因扩增检测。阳性患者可考虑曲妥珠单抗靶向治疗。 TMB、MSI和 NTRK 已被美国FDA批准作为复发或转移性子宫内膜癌患者免疫和靶向用药的伴随诊断生物标志物。复发或转移性子宫内膜癌患者可考虑TMB、MSI、 NTRK 融合基因检测,检测样本为肿瘤组织和配对正常标本(外周血),推荐采用高通量方法进行检测,可同时检测 PIK 3 CA 、 KRAS 、 FGFR 2重排或融合、 AKT 1、 FBXW 7、 PTEN 等基因突变和 ERBB 2基因扩增等靶点,寻求跨癌种用药适应证及泛癌种临床试验入组机会的同时,还可进行分子分型。 4 结语 本共识依据新近的研究证据,在子宫内膜癌林奇综合征筛查、分子分型检测、靶向治疗和免疫治疗标志物检测等方面进行了推荐,并形成共识发布,以指导与规范中国子宫内膜癌分子检测的临床应用。需要强调的是,由于分子分型在诊断、预后风险评估和治疗等方面还缺乏大样本高质量的循证医学证据,部分内容可能仍然存在争议。此外,近年来子宫内膜癌精准诊疗领域进展迅速,随着高质量研究证据的不断积累,检测共识也需要不断更新和完善。
[参考文献] 点击加入基因俱乐部 成就行业精英 目前已有500+行业精英加入基因俱乐部返回搜狐,查看更多 |
【本文地址】