| 药物稳定性分析和有效期确定要点 | 您所在的位置:网站首页 › 合推法 › 药物稳定性分析和有效期确定要点 |
药物稳定性分析和有效期确定要点
|
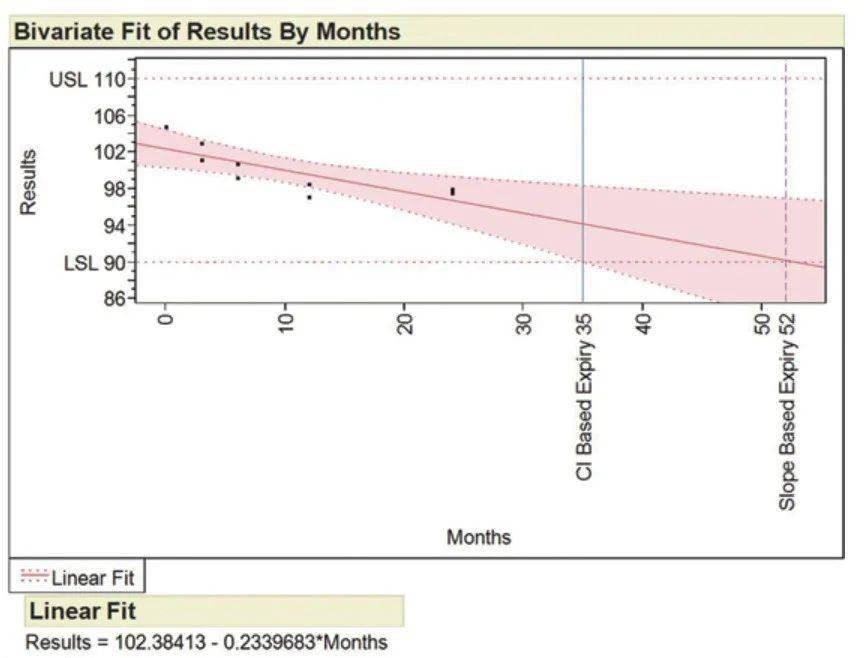
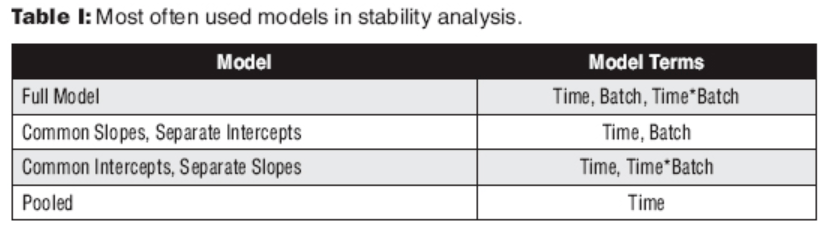
图2:基于CI和斜率的有效期时间。 ICH Q1E,2.3关于外推有效期之外的状态,“稳定性数据外推假设相同的变化模式将在长期数据覆盖的时间段之外继续适用。考虑外推时,假定的变化模式的正确性至关重要。在估算回归线或曲线以拟合长期稳定性数据时,数据本身可以检查假设变化模式的正确性,并且可以使用统计方法来测试数据与假设的曲线的拟合度。在长期数据所覆盖的有效期限之外,无法进行此类内部检查。因此,一旦获得这些数据,应通过额外的长期稳定性数据来验证基于外推法授予的复验期或保质期。 95%置信区间(可以用于确定药物有效期的所有数据)用于确定有效期,并考虑了研究样本的大小,批次数据的变化以及时间点的数量。在早期开发中,当样本量较小时,最好关注降解率。在III期临床试验中的稳定性研究中,当批次数较多且样本量较大时,最好将重点放在置信区间和95%CI预计到期时间上。 稳定性分析的统计模型 稳定性和到期时间的通用多元分析是协方差分析(ANCOVA)或混合模型。除所有与批次相关的条件(主要效果和相互作用)外,所有模型条件的Alpha值均设置为0.05,并且根据指导将其它设置为alpha=0.25。将与批次相关的条件设置为0.25会导致有效期缩短,并有利于有效期缩短的消费者或患者。通常针对每种存储条件分析稳定性,并确定降解和失效的速率。选择最简单的模型来计算到期时间,在该模型中,每个条件均按照上述alpha标准分析,类型为ANCOVA。统计检验是方差分析(请参见下图3),并且应将其包含在提交报告中,以确保所使用的模型适合进行分析,并且已正确进行批次合并测试。ANOVA汇总了重要的模型项,并表明了要分析的数据选择了正确的模型。ICH QE讨论了稳定性数据的分析,汇总批次和提交的一般指导。稳定性分析中最常使用四种模型(请参阅下表I)。
图3:ANCOVA模型。
表1:稳定性分析中最常用的模型。 稳定性研究和DOE 实验设计(DOE)通常用于在稳定性分析和评估中包括的其他因素。对于配方研究,赋形剂的影响和pH值尤其如此。ICH Q1D提供了使用DOE设计和分析稳定性研究的指南。通常,在设计稳定性实验时,时间不包括在DOE矩阵生成中,它通常作为响应的一部分包括在内,因为每个时间点针对矩阵中的每个条件进行多次测量。矩阵被堆叠,时间与每个模型项相交,然后将时间作为因素以及所有其他模型项进行适当的分析。 稳定性中公差设计的影响 设置产品规格接可受极限时,稳定性是关键考虑因素。规格限制应首先考虑药品变化对功效和安全性的影响,其次,应考虑变化的三个来源:产品工艺变化,测定或方法变化以及稳定性变化 (参下见图4)。在设置限制时,如果不理解或不考虑稳定性,应该确保制定没有问题的稳定性实验程序,如果实验不得当在许多情况下可能会阻止产品在商业上可行或导致过多的不必要的产品和供应链成本。
图4:公差和稳定性。 特别是ICH Q6B 1.2的说明,“该规范是为了确保产品质量和一致性的总体控制策略的一部分。该策略的其他部分包括在开发过程中进行全面的产品表征,许多规范基于该规范,遵守良好生产规范,经过验证的生产流程,原材料测试,过程中测试,稳定性测试等。” 在早期开发和整个产品的研发周期或是药物有效期中,应将稳定性和降解速率与规格上限(USL)和规格下限(LSL)相比较。稳定性影响的大小 (请参见下图5)应计算如下: Two-sided specification limits (Slope/(USL-LSL))*100= percent of change in tolerance per time period One-sided specification limits USL only: (Slope/(USL-batch average))*100=percent of design margin LSL only: (Slope/(batch average-LSL))*100=percent of design margin No specification limits No limits: (Slope/batch average)*100=percent of average per time period
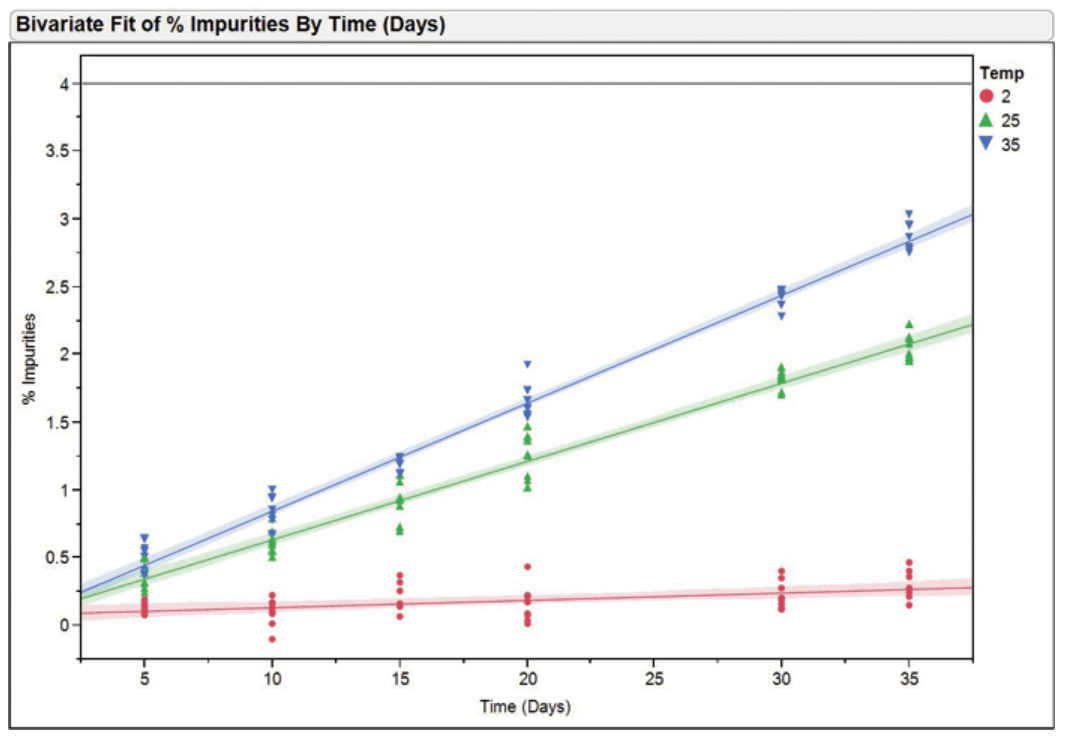
图5:典型的稳定性报告。 加速稳定性分析 有关加速稳定性研究的讨论可能不在本文讨论范围之内。但是,我们也给您说一下基础知识。加速稳定性研究的价值时增加的,因为可以对长期稳定性研究做出预测,这样才能对开发过程产生实际益处。加速稳定性研究的基本步骤如下: 1.确定加速稳定性研究的目的 2.选择要包括在加速稳定性研究中的加速因子条件和范围 3.确定以小时,天或周为单位的时间段 4.建立加速期模型和每种温度或存储条件下的退化速率 (请参见下图6)
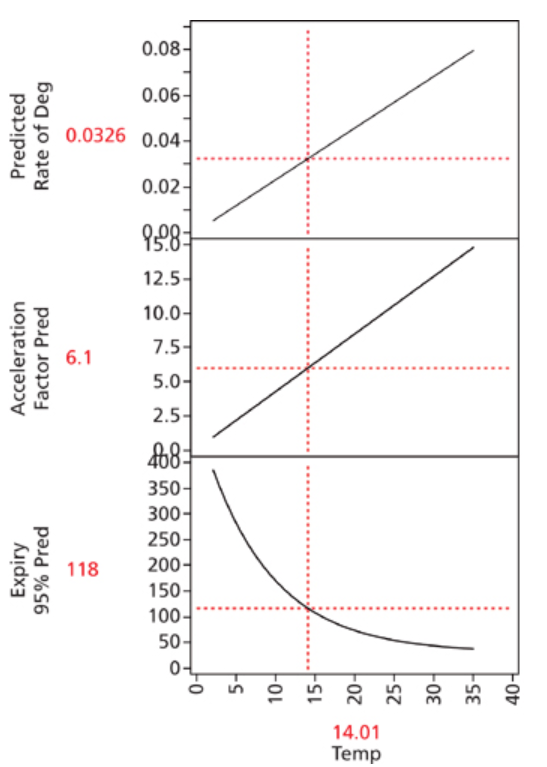
图6:加速稳定性研究 5.在任何温度或存储条件下模型的通用条件 (请参见下图7)
图7:加速稳定性模型。 6.正常存储条件下的稳定性预测(有效期,降解率和加速因子) 7.通过长期稳定性研究对加速稳定性研究进行校准或校正,以确保其具有效的预测性 8.验证加速稳定性研究与长期稳定性研究相匹配,为药物开发过程增加价值。 结论 稳定性测试是所有药物开发和生产的基础。所有组织都需要对适当阶段的稳定性研究设计,组织数据收集,适当的数据分析,明确的稳定性报告以及可用的分析方法有清晰的愿景,以实现稳定产品进入消费者和市场的产品开发目标,以及符合提交的所有监管要求。具有明确的组织所有权的集成方法可确保进行稳定性测试,从而为从早期制定到为批次发布设定适当的接受限制的所有开发活动增加价值。 参考文献: 1. ICH, Q1A(R2) Stability Testing of New Drug Substances and Products, 2003. 2. ICH, Q9 Quality Risk Management, 2006. 3. ICH Q8(R2) Pharmaceutical Development, 2009 4. ICH, Q1E Evaluation of Stability Data, 2003. 5. ICH, Q1D Bracketing and Matrixing Designs for Stability Testing of New Drug Substances and Products, 2002. 6. ICH, Q6B Specifications: Test Procedures and acceptance Criteria for Biotechnological/Biological Products, 1999. 版 权 声 明 本公众号所有转载文章系出于传递更多信息之目的,且明确注明来源和作者,不希望被转载的媒体或个人可与我们联系([email protected]),我们将立即进行删除处理。所有文章仅代表作者观点,不代表本站立场。 返回搜狐,查看更多 |
【本文地址】