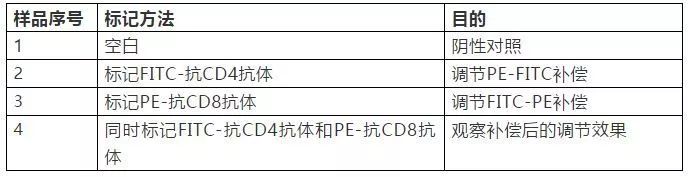
| 流式细胞仪使用 | 您所在的位置:网站首页 › 双色配色表基本参数 › 流式细胞仪使用 |
流式细胞仪使用
|
2、如何调整补偿:有以下原则 ①多色实验(超过单色)时,所有荧光染料都要做一个单染孔 ②先设置电压,再调整补偿,保证读取样本时的电压与调整补偿的电压一致,也就是说补偿调好之后,不要再改变电压。 ③有些抗原表达弱,阳性群不明显,例如IFN-γ-PE,我们可以替换为CD3-PE或补偿微球替换。 具体操作方法:假如以调节FITC和PE之间的补偿为例,因为有2种荧光素偶联抗体,故要设置2个单染管,设置方法如下:
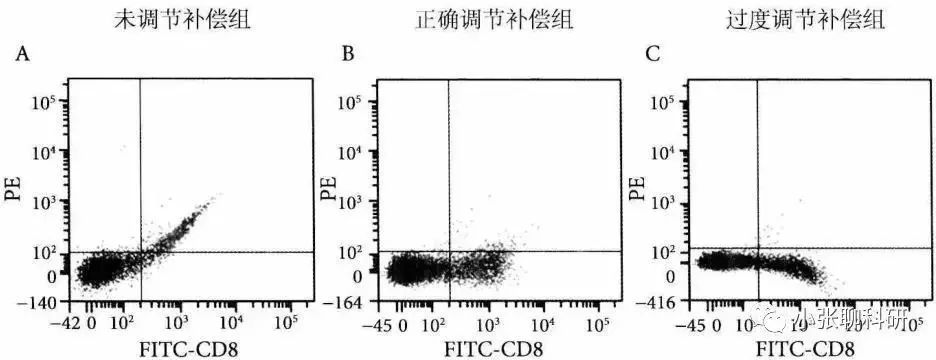
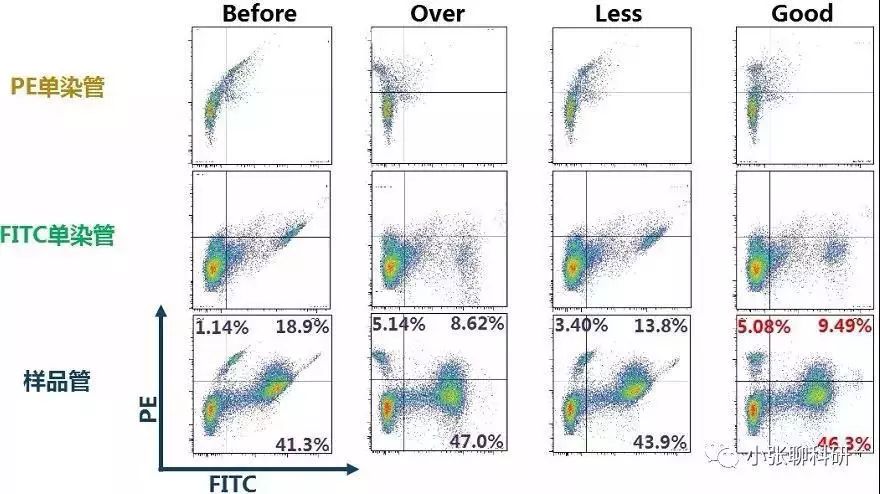
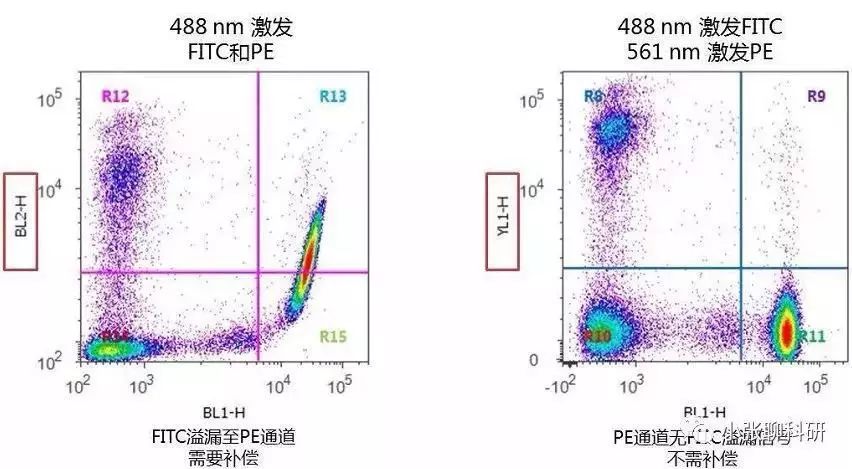
FITC单染管:未标记PE偶联抗体,但纵坐标PE通道却有FITC的荧光信号(图A),因此需要将PE中接收到的来源于FITC荧光素的信号扣除,就是设置PE-FITC补偿值。 图B所示的是正确调节PE-FITC补偿值后的散点图,此时PE通道基本接收不到来源于FITC荧光素的信号,而且FITC阳性的细胞群和阴性的细胞群处于同一垂直线上(要求就是横平竖直)。 图C所示的是过度调节PE-FITC补偿值的散点图,FITC阳性的细胞群通道信号明显低于阴性的细胞群。
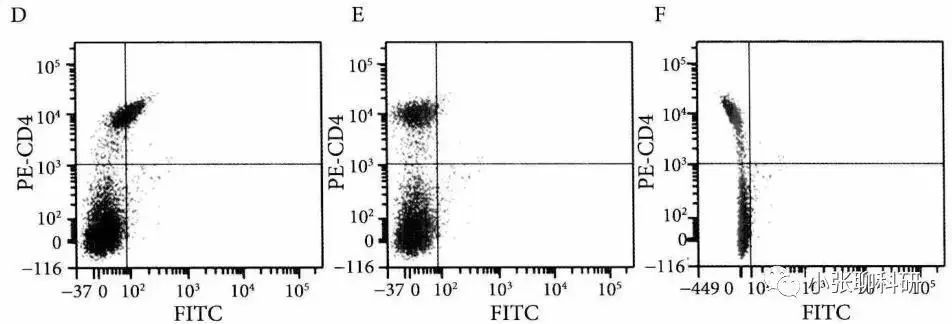
PE单染管:未标记FITC偶联抗体,但横坐标FITC通道却有PE的荧光信号(图D),因此需要将FITC中接收到的来源于PE荧光素的信号扣除,就是设置FITC-PE补偿值。 图E所示的是正确调节FITC-PE补偿值后的散点图,此时FITC通道基本接收不到来源于PE荧光素的信号,而且PE阳性的细胞群和阴性的细胞群处于同一垂直线上(要求就是横平竖直)。 图C所示的是过度调节FITC-PE补偿值的散点图,FITC阳性的细胞群通道信号明显低于阴性的细胞群。
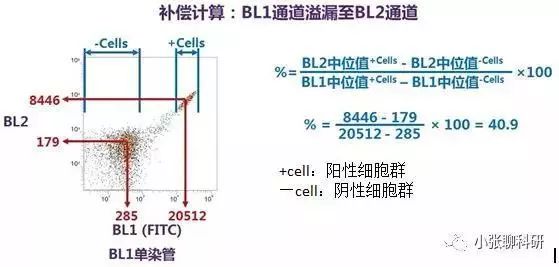
有时双色分析不能满足实验需求,需要进行多色分析,设置方法同双色分析一样,依次调整分析。一般相邻的荧光通道之间需要调节补偿,相隔的荧光通道之间因为各自接收的波长范围相差较大,一般不需要调节补偿,如FITC通道和PE-Cy5通道之间一般不需要调节补偿,因为FITC荧光素发射的荧光波长一般达不到PE-Cy5通道接收的荧光波长的范围;同理, PE-Cy5荧光素发射的荧光一般也不会被FITC通道接收。 3、关于补偿的计算,调节补偿时分析系统自动会得出结果的,公式如下:
4、补偿对结果的影响:不调补偿、补偿不足或补偿过度均会对分析结果产生一定的影响。
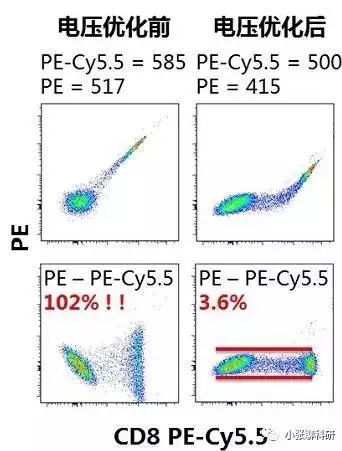
5、影响补偿的因素: (1)电压:电压对补偿的影响不小,电压变补偿变,所以我们前面提到先调节FSC、SSC和荧光通道的电压,电压调好之后再调补偿。
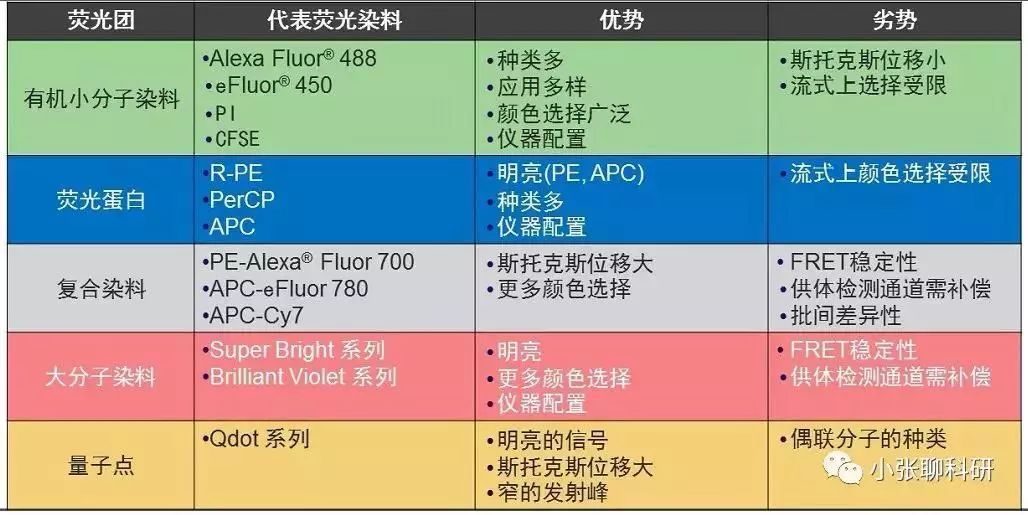
(2)荧光素偶联抗体:目前荧光素种类很多,大致可以分为有机小分子染料、荧光蛋白、复合染料、大分子染料、量子点,优缺点见下图:
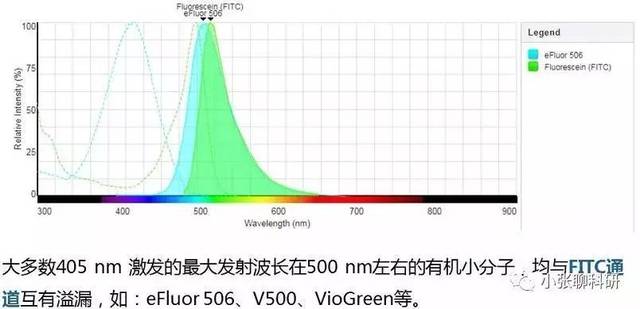
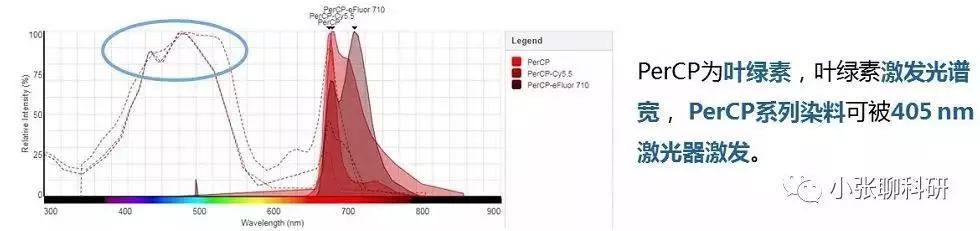
尽管荧光素种类多,但由于有些荧光素发射的荧光波长不是绝对的集中,会溢漏到其他通道,需要调节补偿,所以选择时需了解清楚常见的荧光溢漏: 405nm激光激发的染料:
488nm激光激发的染料:
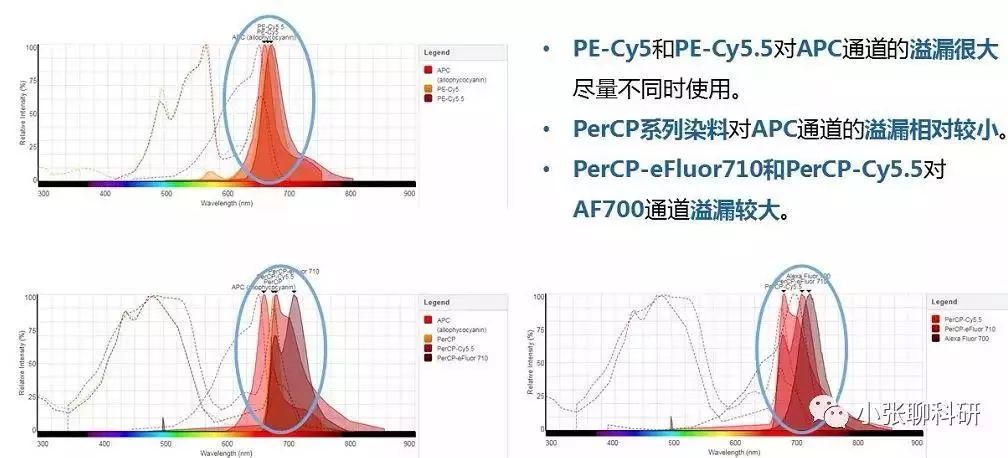
637nm激光激发的染料:
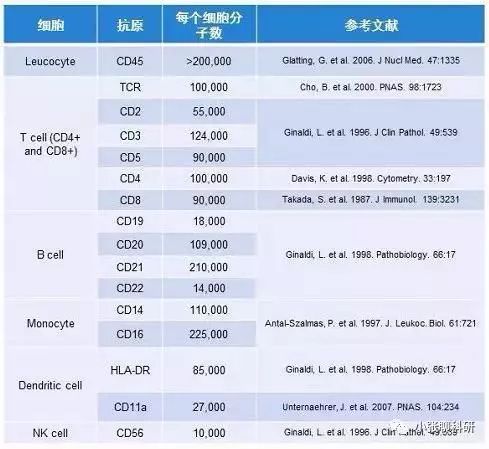
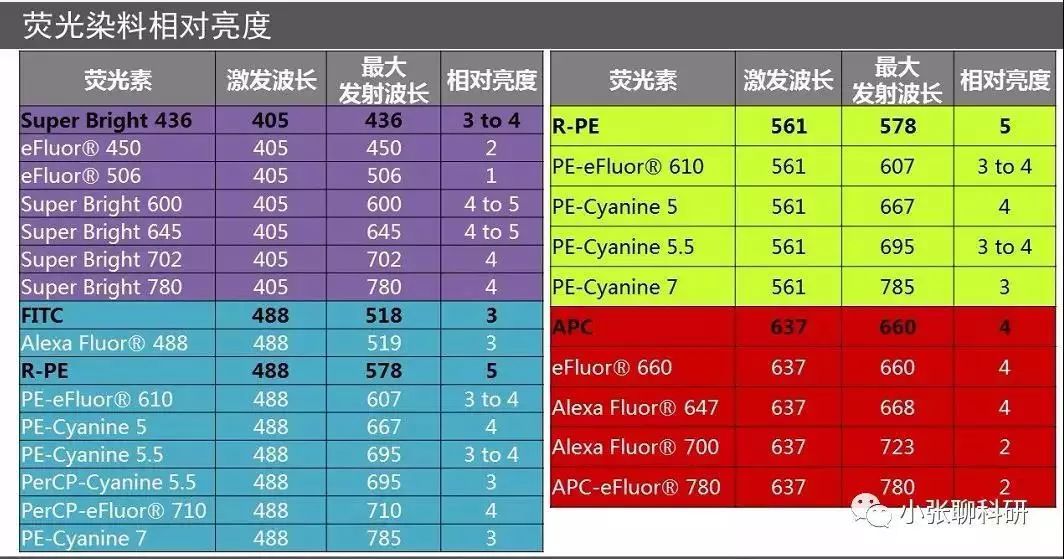
(3)细胞:也是影响补偿大小的一个因素,尤其是当细胞的理化性质相差较大时,如淋巴细胞和肿瘤细胞之间、活细胞与固定后细胞之间,标记相同的荧光素偶联抗体,使用相同的通道时,各通道之间的补偿可能不同,所以当细胞理化性质差异较大时,最好重新调节新的样品细胞的补偿,确保获得准确的流式结果。 (二)多色流式如何配色 原则1:查看所用流式细胞仪的配制,包括激光器、光路设计以及滤光片等,确定有哪些染料可用。 原则2:抗原的表达与荧光遵循强弱搭配,即高表达的抗原选用弱荧光、低表达的抗原选用亮荧光。关于某种抗原的表达强弱可以从文献上进行查找,下表列举了一些抗原的表达情况及荧光染料的相对亮度:
原则3:荧光染料重叠最小化 (1)如果仪器条件允许,尽量采用多激光激发减少重叠
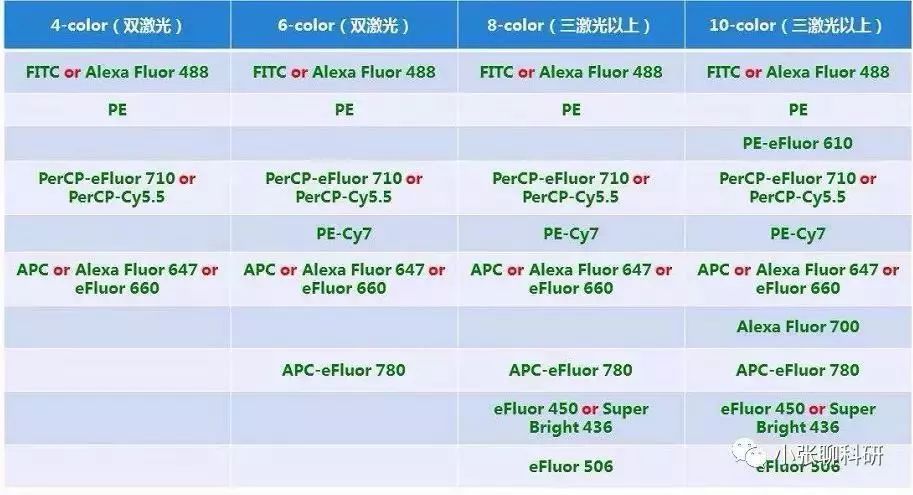
(2)同一细胞上的抗原尽量减小光谱重叠 原则4:尽量使用红色激光激发自发荧光高的样本,因为自发荧光强度在波长较长时迅速降低,例如APC荧光素 常见染料搭配,仅供参考:
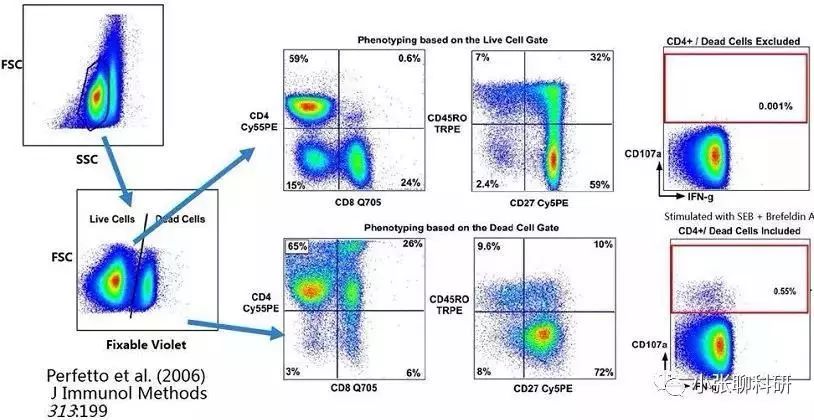
(三)流式分析中的死细胞问题 样品细胞中一般都含有一定量的死细胞,死细胞也可以产生非特异性荧光,而且死细胞产生的非特异性荧光要明显强于活细胞,有的甚至强于荧光素产生的荧光信号。流式分析的目标是活细胞,如果在流式分析时将死细胞当作活细胞来分析,也会严重影响流式分析结果,例如下图:
常见的区分细胞死活染料有: (1)细胞膜非同透性细胞染料,通过受损的细胞膜,标记死细胞核酸,不能透过活细胞细胞膜,常见的有PI、7-AAD; (2)可固定的死细胞染料,适用于胞内免疫分析标记,种类很多。返回搜狐,查看更多 |
【本文地址】