| 【干货分享】《医疗器械定期风险评价报告》的撰写要点 | 您所在的位置:网站首页 › 医疗器械临床评价报告撰写的专业要求是什么 › 【干货分享】《医疗器械定期风险评价报告》的撰写要点 |
【干货分享】《医疗器械定期风险评价报告》的撰写要点
|
注意:(1)即使没有发生不良事件,仍需要定期按时提交定期风险评价报告;(2)不良事件报告是定期风险评价报告中的一部分,但不是全部内容;(3)监测资料是国内外风险信息的汇总和分析。
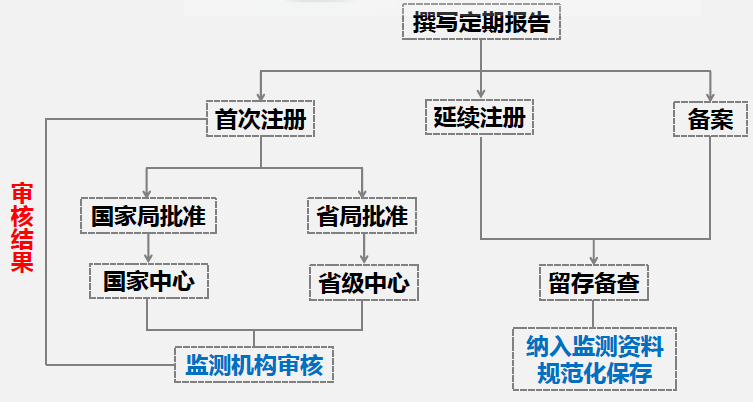
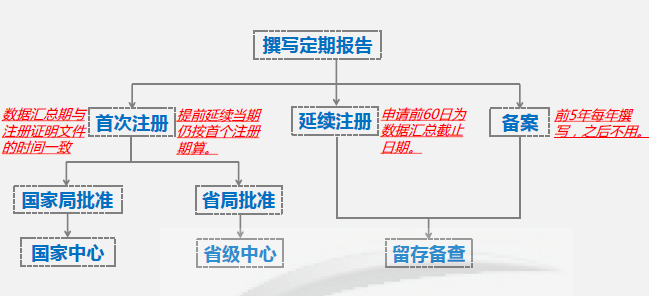
注意:(1)对于首次注册的第二、三类产品,网上提交资料后,依据审批机构的不同,会由国家药监局或省级药监局进行审核,审核结果可在网上查询;(2)对于延续注册和备案产品,不要求在线提交定期风险评价报告,撰写完成后留存备查即可,但同时需把其纳入监测资料规范化进行保存。 2. 正文内容的撰写要点
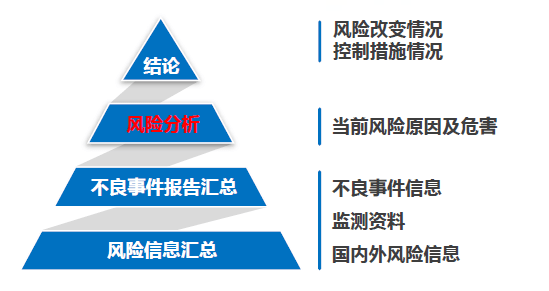
通过对医疗器械产品的不良事件进行监测,定期分析产品的风险是保障产品安全的重要途径之一。因此,在撰写定期风险评价报告时,注册人应从识别风险和原因分析两方面撰写风险分析,评估其对安全性的影响。识别风险包括以下内容。 (1)对不良事件的特点、频率、伤害严重程度等的分析; (2)原因分析应从:设计、生产管理、流通与储存、使用因素等方面考虑。 在正文的结论部分,注册人应指出: (1)指出本期报告与既往报告的风险分析结果差异; (2)指出以上风险差异的可接受程度; (3)总结采取的风险控制措施。 3. 时间节点
(1)数据汇总期与注册证明文件的时间一致:如某个产品的获证日期是2018年8月10日,那么在2019年度需要提交的定期风险评价报告的数据汇总期就是2018年8月10日至2019年8月9日。 (2)提前延续注册的产品的当期报告的数据汇总期仍按首个注册期计算:如某个产品的注册证于2020年8月30日到期,但它在2020年5月就获得了延续注册证,对于该产品,当期报告仍以2020年8月30日作为汇总期的结束日期。 4. 案例分析
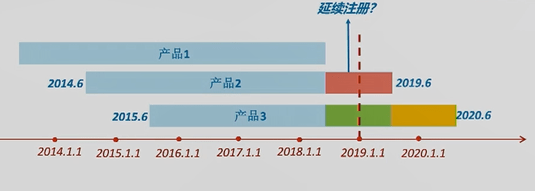
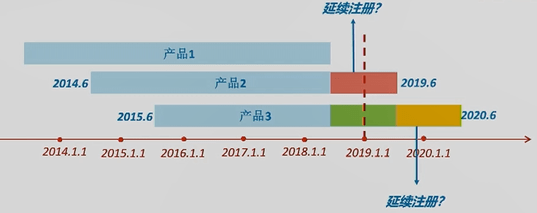
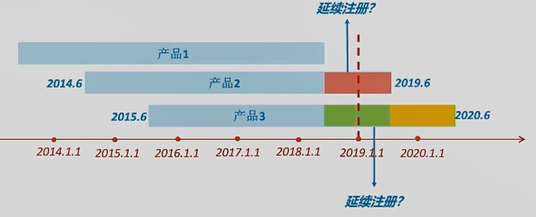
(1)上图中3个II类产品提交定期风险评价报告时,数据汇总期应该分别是哪一段时间呢? 产品1的首个注册期是2013年某月某日到2018年某月某日。对这个产品来说,2019年1月1日《办法》生效时,其处于延续注册状态,所以只需准备下一整个延续周期的定期风险评价报告即可。 产品2的首个注册期是2014年6月至2019年6月。注册人应提交2019年的年度报告,数据汇总期是2018年6月至2019年6月,即上图中红色时间段。 产品3的首个注册期是2015年6月至2020年6月。该产品需要提交两期定期风险评价报告。分别是上图中绿色时间段和黄色时间段。
(2)若上图中产品2在蓝色箭头时间点进行了延续注册,定期风险评价报告应如何提交? 答:在《办法》生效时,该产品已经处于延续注册状态。所以该产品不用提交2019年的年度定期风险评价报告。
(3)若上图中产品3在蓝色箭头时间点进行了延续注册,其当期定期风险评价报告应如何提交? 答:《办法》规定,提前延续注册,仍应按照首个注册期要求,提交当期定期风险评价报告。产品3的当期即为黄色时间段,所以即便其在黄色时间段内延续注册,提交的定期风险评价报告也必须是整个黄色时间段内的报告。
(4)若上图中产品3在绿色时间段内就进行了延续注册,其当期定期风险评价报告应如何提交? 答:产品3的本期定期风险评价报告的数据汇总期就是整个绿色时间段。黄色时间段的数据可作为下一次延续注册时定期风险评价报告中的一部分内容。 No.3 共性问题解析 1. 产品处于首个注册期内,有销售活动后停止生产销售的,是否仍需要继续提交定期风险评价报告? 需要。即使已停止生产销售,市场上仍可能会有该产品在流通使用;为了保证该产品的风险可控,仍需要定期按时提交定期风险评价报告。 2. 产品取得注册证后从未上市销售是否需要提交定期风险评价报告? 需要。在系统内提交定期风险评价报告时,可在报告正文部分做简要说明,或由公司提交“该产品从未在国内外上市”的说明,来替代报告的正文。 3. 应急注册产品是否需要提交定期风险评价报告? 尚不需要。但应急注册产品转为正式注册产品后,需按照首个注册期的要求,提交定期风险评价报告。同时,第一份评价报告的数据汇总期应涵盖其应急注册期。 end返回搜狐,查看更多 |
【本文地址】