| 先锋研究院 | 您所在的位置:网站首页 › 化疗药物的发现与开发过程怎么写 › 先锋研究院 |
先锋研究院
|
先锋研究院 | 靶点HER2史:从赫赛汀到CAR-M,“她”如何改变实体瘤治疗? 华夏源行业研究组出品:靶点HER2史:从赫赛汀到CAR-M,“她”如何改变实体瘤治疗? 新闻来源: 华夏源行业研究组 发布时间: 2021/12/28 观看人数: 1821  返回列表 华夏源行业研究组 出品 文章摘要 ● 1985年HER2靶点发现到1998年首款HER2靶向药“赫赛汀”诞生,到迄今为止”赫赛汀”的成功,充分体现医生、科学家和制药公司之间的完美合作; ● 靶点HER2由此被证明可显著改善乳腺癌和胃癌,突破性得成为乳腺癌与胃癌的首款生物靶向药一线疗法; ● 另一方面,CAR-T在血液瘤的成功,临床开始尝试将CAR-T用于HER2为代表“明星靶点”的实体瘤。但肿瘤微环境的限制使得靶向HER2的CAR-T在实体瘤的进展举步维艰; ● 2020年,包括"CAR-T之父"Carl June在内的宾夕法尼亚大学CAR-T细胞团队成功构建靶向HER2的CAR-M(巨噬细胞),并于2021年完成全球首次患者给药。 ● HER2作为一个广谱靶点,未来无论常规的单抗,还是ADC、双抗及细胞治疗等各具特色的新型成药方式,将愈发造福更多的患者。
01 从发现到认可 明星靶点HER2曾两度遭放弃,最终成就重磅单品 2019年9月10日,在生命科学和医学界素有“诺奖风向标”之称的美国拉斯克奖(The Lasker Awards)临床医学奖颁发给了“乳腺癌救命药”之称赫赛汀(Herceptin)发明团队:迈克尔·谢泼德(H. Michael Shepard)博士,丹尼斯·史莱门(Dennis J. Slamon)博士,以及阿克塞尔·奥瑞克(Axel Ullrich)博士。
△赫赛汀发明团队:Michael Shepard基因泰克前科学家;Dennis Slamon前肿瘤临床医生,现任UCLA血液学和肿瘤学主席;Axel Ullrich德国马克斯普朗克生物化学研究所、基因泰克前科学家; 一时间,“赫赛汀”这款屹立肿瘤界二十余年不倒的靶向药风光无限。精准医疗时代下,靶向药更新换代,层出不穷。赫赛汀的成功,不仅充分体现了临床医生、科学家和制药公司之间的完美合作,也让背后最富盛名的“明星靶点”—HER2再次步入大众视野,为人所详谈。 HER2的前生:基因泰克的科学另类,那偶然的致癌基因的发现 1979年1月,时任加州大学旧金山分校(UCSF)博士后、在《自然》期刊等重磅杂志发表起最重要的科研成果-克隆大鼠的胰岛素基因的阿克塞尔·奥瑞克(Axel Ullrich,“奥瑞克”)在时任基因泰克的CEO斯万森(Bob Swanson)数次力邀下加盟了基因泰克公司。
△80年代的奥瑞克(Axel Ullrich):进入基因泰克后奥瑞克学术成果累累,1980 - 1989年期间,作为第一作者或最后作者在《自然》或《科学》期刊上发表了近10篇论文;奥瑞克与英国的沃特菲尔德(Mike Waterfield)团队合作,在1984年克隆了全长的人源表皮生长因子受体(EGFR)基因,发表在《自然》期刊上; 不得不提,基因泰克早期的科研团队是由数名勤奋带着些许执着且怪癖的年轻科学家组成,而奥瑞克又是这些怪癖中的“另类”:他不以产品研发为导向,纯凭自己兴起启动和研究项目。比如回答一些有趣的科研问题、发表高质量的论文。 只是没人能预料到,这样随心所欲、跌跌撞撞了六年,基因泰克史上最关键的产品是来自奥瑞克的一次“偶然”的基础科研。
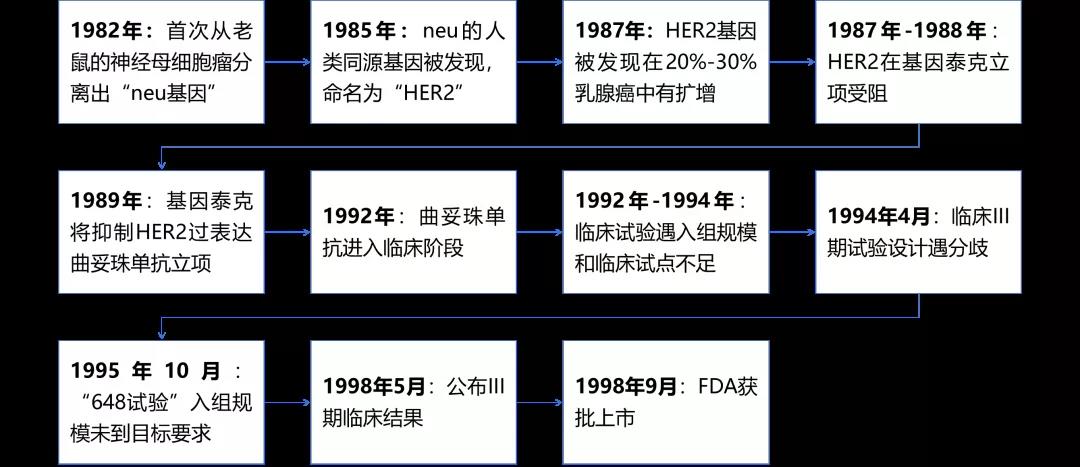
1982年,MIT的温伯格(Robert Weinberg)团队从老鼠的神经母细胞瘤分离出一种致癌基因,根据基因种类取名为“neu基因”。随后1985年,奥瑞克和莱文森(Arthur Levinson,后来成为基因泰克第三任CEO)团队用v-erb基因探针在人类基因组DNA库中“钓鱼”找到了neu的人类同源基因,与另一个人类表皮生长因子受体基因HER一致,为有所区分,团队把新发现的基因重新命名为HER2。
△1985年在《Science》上科研成果发表 1985年12月,奥瑞克和莱文森将HER2的成果论文在《科学》期刊上发表并在文章指出:HER2基因和几年前MIT的温伯格团队在大鼠成神经细胞瘤中发现的致癌基因neu在染色体上定位一致,二者极有可能是同一个致癌基因。 至此,奥瑞克对HER2基因进行了重新定义,但要想说服基因泰克立项开发此类药物,两者还缺少一个关键环节,即:找到HER2基因活跃表达的癌症,否则无病可治的药物毫无用处。 HER2在乳腺癌的开端:一场35年前丹佛机场的几乎错过的对话 1986年4月,奥瑞克在丹佛地区参加一个以致癌基因为主题的学术会议,听到一位来自加州大学洛杉矶分校(UCLA)的名为丹尼斯·史莱门(Dennis J. Slamon,“史莱门”)年轻医生讲述自己的科研工作,给奥瑞克印象深刻的除布满内容的“Southern Blot(一种基于核酸杂交DNA序列检测技术)”照片,相比奥瑞克所不具备的,还有史莱门作为临床肿瘤医生的身份,他可以直接接触到患者的肿瘤组织。
△80年代的史莱门,比奥瑞克小5岁,是医学和细胞生物学双料博士; 奥瑞克带着“HER2基因在真正的肿瘤患者是否突变或扩增”疑虑赶往机场返回加州。在丹佛机场安检口,奥瑞克再次见到了史莱门,两个人准备朝相反方向前往登机口。在稍纵即逝的瞬间,奥瑞克叫住了史莱门。奥瑞克介绍了自己并说下一步想在肿瘤组织中检测几个致癌或原癌基因的表达,问史莱门有没有兴趣合作。 两个人无论如何也没想到,一次差点没有发生的合作交谈,从此改变了一个历史性药物的研发历程和数百万患者的命运。 1987年,奥瑞克和史莱门第利用7个DNA探针首次建立了HER2基因和乳腺癌的关联。他们发现HER2基因在20%-30%乳腺癌中有扩增,与很多致癌基因不同,HER2基因在肿瘤组织中没有突变只有扩增。也就是说,20%-30%的乳腺癌细胞表面表达的是正常HER2蛋白,数量却比正常乳腺细胞高得多(正常乳腺细胞表面表达5万/HER2分子,乳腺癌细胞表面表达超过一百万个)。同时,基于乳腺癌染色模式,可以将乳腺癌分为HER2阳性和HER2阴性,其中HER2阳性的肿瘤预后较差,发病更凶猛且更易转移。
△1987年在《Science》上科研成果发表:在对189个乳腺癌患者的肿瘤组织分析后,他们发现HER2基因在约30%的乳腺癌中扩增2-20倍不等。这189个肿瘤组织来自他们在德克萨斯州的合作者麦奎尔(Bill McGuire)医生。麦奎尔在组织一个关于乳腺癌的临床研究。把HER2的状态和这些患者的癌症的进展直接挂钩,他们还发现有HER2扩增的肿瘤生长和扩散都更快,患者的生存率和无病生存率更低。 由此看来,HER2的发现与成功伴随着坚持与些许运气。在后续,奥瑞克和史莱门试图从癌症DNA中用其他致癌基因“钓”出另一个新的致癌基因,但却毫无所获。 HER2的立项遇阻:来自学术界的质疑与基因泰克的迟疑 谁也未料到,HER2项目往后却几经波折。首先,自奥瑞克和史莱门《科学》论文发表后难获学术界认可,备受“实验室无法重复试验结果”、“数据不可信”等质疑。为此,奥瑞克和史莱门花2年时间使用新的肿瘤样品测试验证之前的结论,除此外,还系统证明了其余实验室无法完成试验的理由包括试剂不纯和技术难点等。1989年,这些验证结果发表在《科学》杂志上,却还是难以彻底消除学术界的质疑。
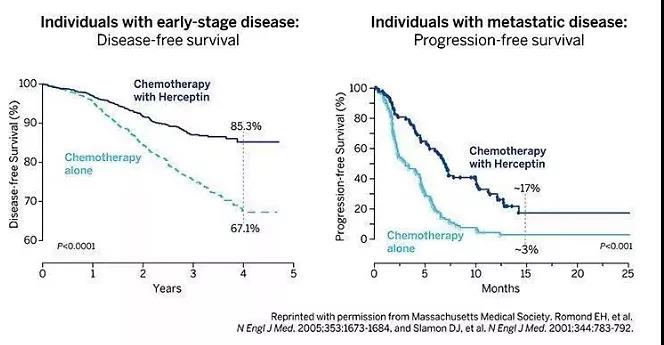
△1989年在《Science》上科研成果发表 其次,基因泰克立项遇到推迟。在奥瑞克和同事迈克尔·谢泼德(Michael Shepard,“谢泼德”)发现“单抗4D5在细胞和动物试验中可阻断HER2信号传导,抑制过表达HER2肿瘤的生长”数次申请将HER2项目转到开发阶段时,彼时已发展为1,700名员工大公司的基因泰克以此前干扰素抗癌药失败和无单抗药物开发经历,且任何开发项目要经历复杂耗时的流程为由推迟,直至1989年底,终将4D5人源化单抗立项。 HER2到赫赛汀:几经周折的药物临床研发终获成功 1992年,4D5单抗也就是往后的曲妥珠单抗(Trastuzumab)正式进入临床阶段,作为一个潜在药物,也很快被命名为“赫赛汀(意为HER2+Intercept+Inhibitor=Herceptin)”却再遭临床试验的拖延。首先,基因泰克彼时组织抗癌药的大型临床试验经验远不足,仅靠史莱门作为临床项目负责人(PI)和南加州一个临床试验点远远不够入组规模;其次,临床PI在III期临床设计上花了半年时间解决曲妥珠单抗与化疗联用机制(与环磷酰胺和阿霉素 “CA”加紫杉醇);最后,III期临床患者入组速度太慢,1994年4月到1995年10月底“648号试验”才入组14名(目标450名),直到1996年年中才提高患者整体入组速度。 1998年5月,在美国临床肿瘤学会(ASCO)的第34次会议上,史莱门报道了最关键III期临床“648试验”纳入469例患者结果:随访12个月,相比化疗,曲妥珠单抗联合化疗在转移性乳腺癌中ORR达53%,无进展生存期(PFS)从4.6个月提高到7.4个月,生存率的改善达30%,且未出现化疗常见副作用反应。 基于“648试验”结果,1998年9月,FDA批准曲妥珠单抗上市用于HER2阳性转移性乳腺癌,从此彻底改变乳腺癌的治疗方案。 赫赛汀的获批也大幅增加基因泰克的销售额和股价(收入从10亿跃升到90亿美金,公司利润由当年亏损10亿猛增至20亿美金,市值跨越750亿美金大关),使得原本罗氏持股66%并原定有权1999年7月购买剩余股份的基因泰克多得了10年的独立运营,到2009年罗氏执行对剩余股份的全部收购。
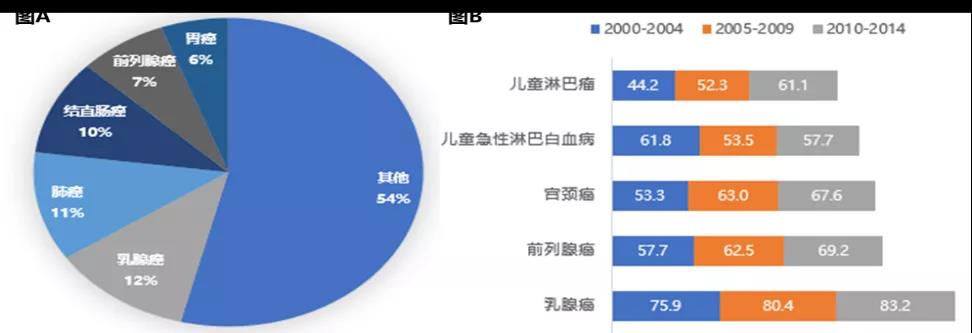
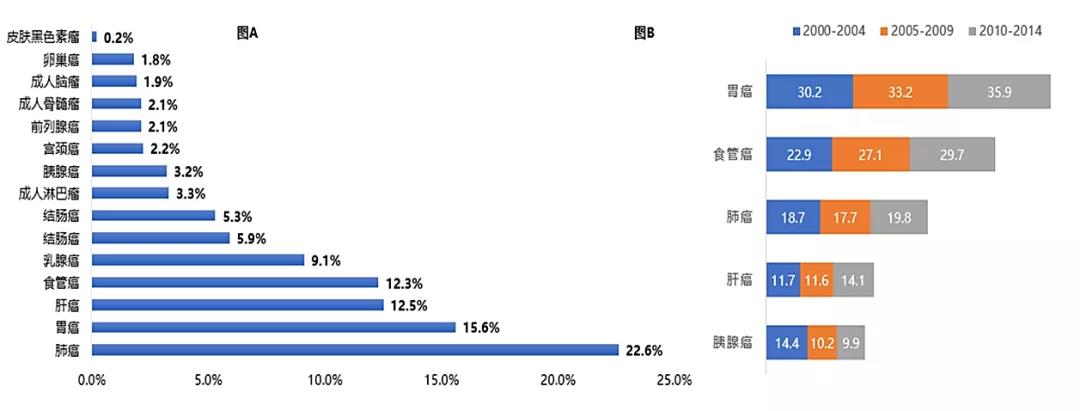
△HER2靶点从发现到获批的一波三折之路 赫赛汀作为第一个靶向致癌蛋白的单抗,第三个获批的人源化抗体,第六个进入市场的单抗药,为乳腺癌治疗开启了靶向药时代,使得至少超过230万女性患者获益。 2018年在第一个适应症获批第二十年中,赫赛汀全球销售峰值达到71亿美金。乳腺癌之外,赫赛汀也被扩展适应症到胃癌(20%胃癌患者呈HER2阳性)。除此外,赫赛汀的衍生药物(ADC、双抗)也被证明对赫赛汀产生耐药性患者有效。 至今,HER2仍是炙手可热的“明星靶点”。正如34年后拉斯克临床医学颁奖典礼上诺贝尔奖得主迈克尔·布朗笑言:HER2这个名字很有预见性,恰巧是英文中的“她”,那时也不知道它会导致乳腺癌。 02 乳腺癌的划时代意义 HRE2改变女性健康“头号杀手”治疗格局 据国际癌症研究协会统计,2020年全球约685,000人死于乳腺癌,在女性相关癌症死亡中,乳腺癌约占15.5%。在2020年全球有约230万人确诊乳腺癌,已经超过肺癌成为女性健康的头号杀手。由于中国人口基数较庞大,新发病例数和死亡病例数仍在世界范围位居前列,女性乳腺癌发病例数占全球发病人数的11.2%,仅次于美国,并且发病率年复合增速更是以3%位列世界首位。
△图A:2020年全球新发肿瘤缓则人群占比;图B:中国年标化的5年净化生存率(%)前五位 虽然拥有较高发病率,得益于医疗技术的进步,乳腺癌目前是众多癌症中治疗选择较多、预后较好癌种之一,2007年至2016年,乳腺癌的死亡率每年以1.8%的速率下降。根据2018年统计,中国乳腺癌5年生存率为83.2%,是中国5年生存率最高的癌种,但仍低于美国(90.2%)、澳大利亚(89.5%)等西方国家和邻国日本(89.4%)。 纵观乳腺癌的治疗发展,HER2的发现和药物的开发,不仅给患者提供多种选择,也大大提高了患者生存期,将乳腺癌治疗带入新的阶段。 乳腺癌的分类:HER2主力分子的分型以及差异性治疗策略 在HER2靶点明确分子分型之前,传统的乳腺癌治疗参照“AJCC乳腺癌TNM(T:肿瘤大小和侵犯部位;N:淋巴结转移个数;M:有无远处转移)分期”,治疗主要集中在手术为主,辅以化疗联合激素。 随着对分子机型的认知提升,临床上根据免疫组织化学检测将乳腺癌雌激素受体(ER)、孕激素受体(PR)、HER 2,增殖细胞核抗原Ki-67这四个指标表达程度来划分不同分型。其中激素受体阳性(HR+)、HER2阴性(HER2-)是乳腺癌最常见亚型,患者占比约70%。 因而,根据肿瘤分子分型,HER 2阳性患者一般会叠加靶向治疗,HR激素受体阳性患者会使用内分泌治疗,该分子特征的明确也丰富了患者的治疗选择。 破局HER2阳性乳腺癌:赫赛汀为基石的靶向药物治疗攻不可没 HER2作为乳腺癌明确的预后指标和药物治疗效果的预测指标,被认为是乳腺癌较为理想的治疗靶点。近年,抗乳腺癌药物靶向HER2新药不断涌现,成药形态也逐步差异化,主要以抗体类药物、抗体偶联药物(ADC)以小分子酪氨酸激酶抑制剂(TKI)分类为主。 所有HER2抗体类药物中,最先获批的“赫赛汀”是HER2靶向抗体治疗乳腺癌的基石药物,凭着优秀临床表现,现已成为NCCN、ESMO和CSCO指南中HER2阳性乳腺癌的全疗程用药推荐,是乳腺癌领域名副其实的“药王”。
△1998年FDA批准赫赛汀联合紫杉醇用于一线治疗HER2阳性转移性乳腺癌患者临床结果 赫赛汀自美国上市以来, 2018年和2019年的销售额分别达29.5和31.8亿美金。2019年赫赛汀原研药专利期在美国届满,一系列曲妥珠单抗生物类似药相继获批上市冲击赫赛汀的市场。2020年,赫赛汀在美国年销售额仅为14.8亿美金,同比下降达53.4%。 针对赫赛汀仍有些许缺陷的里程碑原研药,罗氏对其结构进行改良,2012和2013年相继诞生了帕妥珠单抗(HER二聚化抑制剂)和曲妥珠单抗 DM1 偶联物(TDM1),并凭借不俗的临床结果,分别跻身晚期HER2阳性乳腺癌“双靶联合”一线治疗和单药二线治疗。
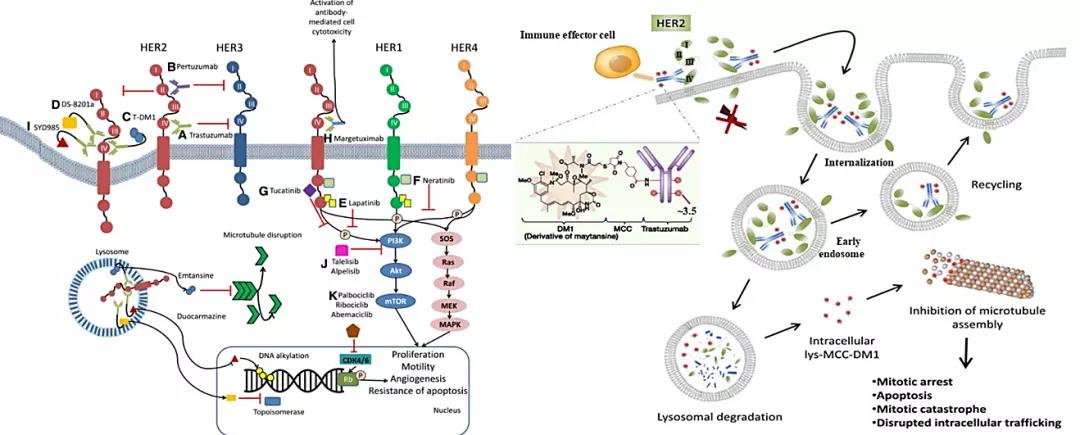
△帕妥珠单抗通过结合HER2,阻滞HER2与其它HER受体的杂二聚,从而减缓了肿瘤的生长;恩美曲妥珠单抗生物活性与其类似,可以特异性的将强效抗微管药物DM1(美坦辛衍生物)释放至HER2过表达的癌细胞内
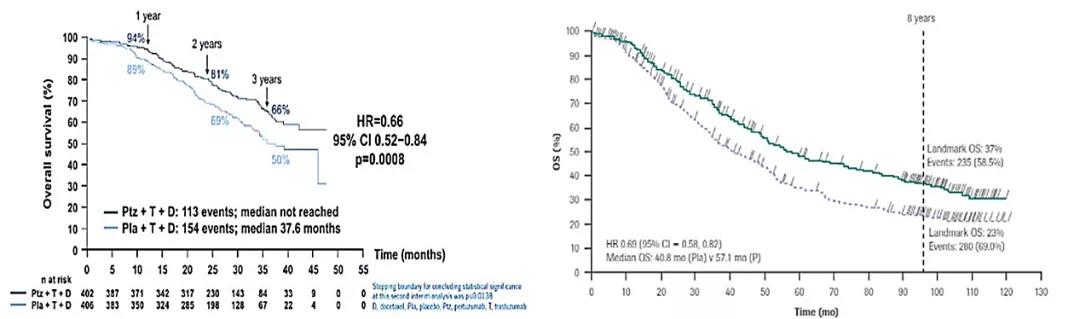
△奠定帕妥珠单抗“双靶联合”1L地位“CLEOPATRA 研究”:2012年首次披露帕妥珠单抗联合多西他赛治疗延长总OS;随访99个月2019年证实帕妥珠+曲妥珠+多西他赛比帕妥珠+多西他赛可带来持续性OS获益
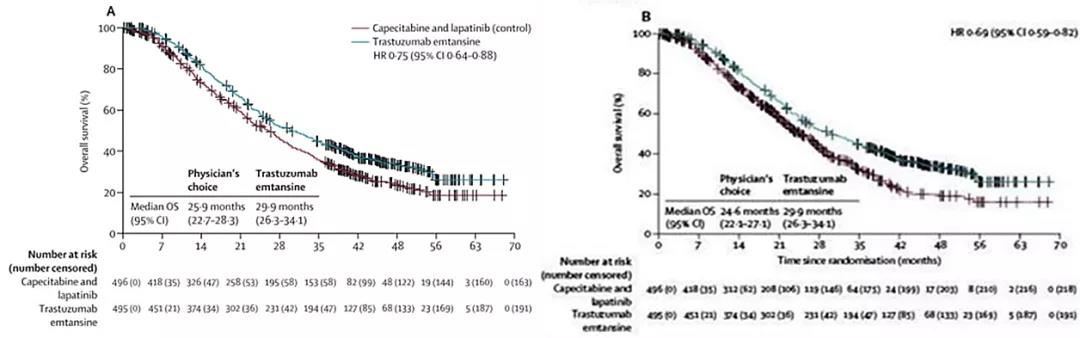
△NCCN和CSCO将恩美曲妥珠单抗纳入2L治疗“EMILIA研究”:2009-2011年入组991例mBC,T-DM1相较于拉帕替尼和卡倍他滨同样显著延长了患者生存,mOS达到29.9个月,降低患者死亡风险25%
△HER2主要的三大靶向药物:曲妥珠单抗、帕妥珠单抗、恩美曲妥珠单抗 如今看来,罗氏以Herceptin(曲妥珠单抗)、Perjeta(帕妥珠单抗)和Kadcyla(恩美曲妥珠单抗)HER2靶向药界的“三大王牌”独霸市场数年,贯穿HER2阳性乳腺癌治疗全生命周期。 目前根据中国抗癌协会最新《HER2阳性乳腺癌临床诊疗共识》和2021年《NCCN乳腺癌治疗指南》,“帕妥珠+曲妥珠+多西三联”治疗已成为HER2阳性乳腺癌国际金标准。 由此看来,以首款HER2靶向药赫赛汀为基石打造的“妥妥双靶”格局,为乳腺癌患者构建起从新辅助、术后辅助到晚期治疗的全程管理。 03 精准医疗下的突破 HER2助力开启胃癌靶向治疗的新时代 胃癌定义较为宽泛,包括胃食管结合部(GEJ)腺癌在内的多种癌症均可被归属于胃癌。根据2018年全球癌症调查数据,胃癌是全球第五大常见肿瘤和第三大致死肿瘤,2020年全球新增胃癌约109万人,死亡约76.8万人。而中国发病数与死亡数分别占全球44%和50%,且80%的中国胃癌患者在确诊时已处于晚期。
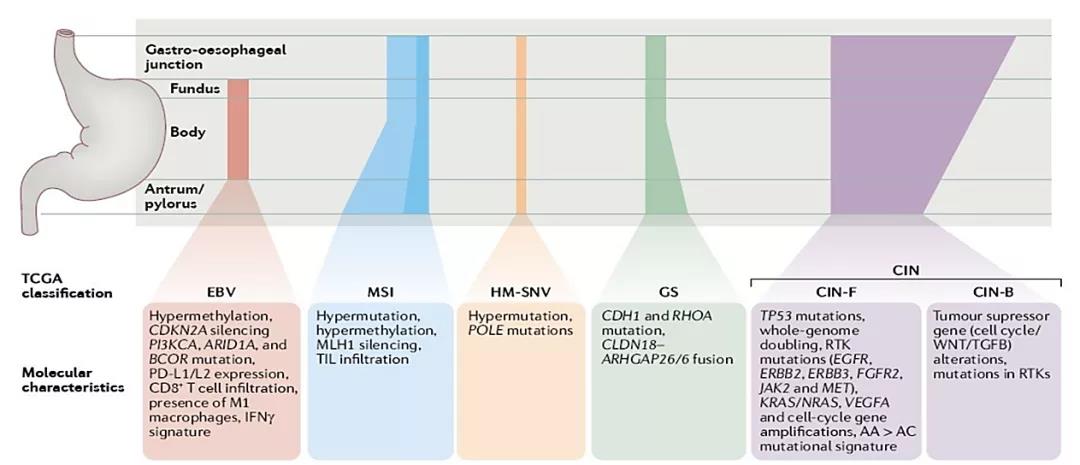
△图A:中国2000-2014年主要癌症分布;图B:中国年标化的5年净化生存率(%)后五位 由于众多患者会因病情恶化而无法耐受后续治疗,胃癌一线治疗往往是决定患者生存获益和后续治疗的最佳机会。过去几十年对大部分晚期胃癌患者,化疗仍是一线治疗的首要选择,然而化疗的治疗效果有限,晚期或转移性胃癌患者5年生存率仅5%,平均5年生存期(35.9%)相比与邻居国家日本(60.3%)差近一倍。 因此,无论什么类型的胃癌患者都面临生存期较、预后较差困境,基于目前相似的治疗方案显然有进一步待改进的空间。 重新分类胃癌:HER2使不同亚型的胃癌具更精准的靶向治疗 基因检测技术的进步使人们意识到胃癌是一个复杂的疾病。2014年,癌症基因组图谱(TCGA)计划对295名原发性胃及胃食管结合部腺癌(GEJ)体细胞拷贝数、全外显子组测序、DNA甲基化、mRNA和microRNA测序以及蛋白阵列数据进行非监督聚类分析,将胃癌分为四种不同的亚型:EBV病毒阳性亚型(EBV),微卫星不稳定亚型(MSI),基因组稳定亚型(GS)和染色体不稳定亚型(CIN)。
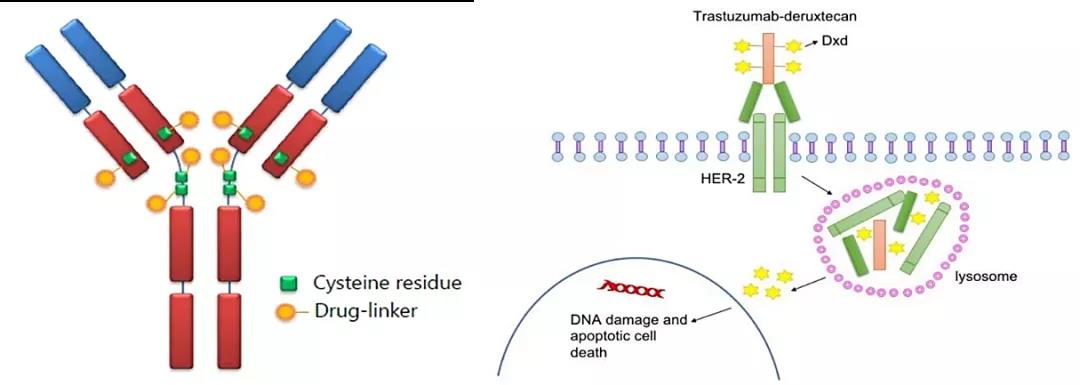
△不同亚型的胃癌分子、临床特征及解剖学分布 根据不同的分子生物学特征,将胃癌患者归为不同亚型,针对亚型开发或使用具有针对性的靶向疗法,正成为胃癌治疗新模式。其中,除了Claudin 18.2、FGFR2b、EGFR、PD-1/PD-L1、VEGF、MET、PARP等常规探寻的靶点,HER2作为人类表皮生长因子成员,通过IHC和FISH的鉴定被发现在15%-25%胃癌/GEJC中过度表达,以此跻身为最常见的胃癌靶点之一,相继的靶向疗法也陆续开发。 HER2成迄今胃癌最透彻靶点:首个分子靶向药赫赛汀再进一线 2010年,FDA根据具有里程碑意义的“ToGA试验(全球第一个证明靶向治疗能延长晚期胃癌生存时间的大型III期临床)”批准曲妥珠单抗联合化疗一线治疗HER2阳性转移性胃癌,使HER2再度在胃癌领域成为明星靶点,该疗法也一跃成为HER2阳性晚期胃癌(GC)及胃食管结合部腺癌(GEJC)的标准一线疗法。虽然耐药性和不同癌肿之间的治疗差异,使得曲妥珠单抗并未像业界期待胃癌也能那样像乳腺癌靶向治疗一样取得成功,但业界对HER2靶点的探索从未停止,成药形式也是多种多样。 2021年1月15日,FDA批准了第一三共和阿斯利康合作开发的新型HER2靶向ADC药物T-DXd(Enhertu)用于治疗局部晚期或转移性HER2阳性胃癌(GC)或胃食管腺癌(GEA)成年患者。Enhertu 的腾空出世,带动ADC领域新一轮HER2在胃癌的热潮。
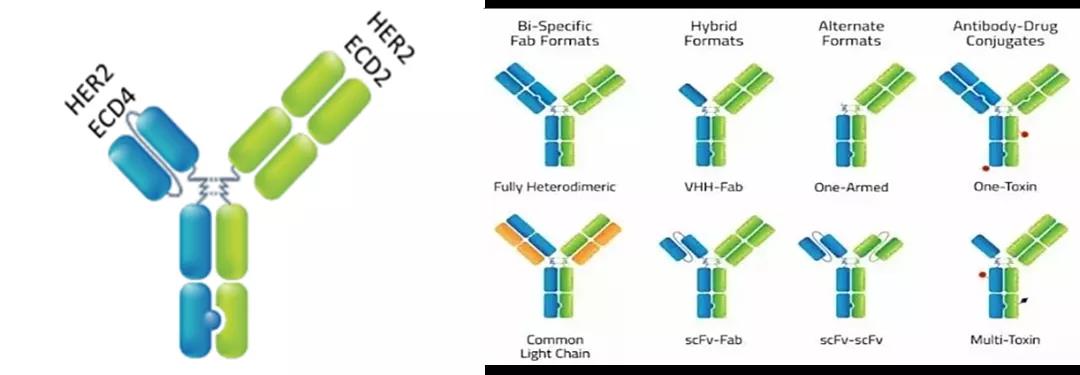
△T-DXd是由抗HER2单抗体(MAAL-9001)与依沙替康衍生物MAAA-1181a(DXd)组成,抗体部分氨基酸序列与曲妥珠单抗相同,DXd是一种DNA拓扑异构酶I抑制剂,与伊立替康的活性代谢物SN-38相比,其抑制效力高出10倍。与HER2结合后,T-DXd会破坏HER2信号并介导抗体依赖的细胞毒性反应 除此外,百济神州在2018年11月以4,000万美金首付款,至多3.9亿美金潜在里程碑付款获得了包括Zymeworks开发的双特异性抗体ZW25在内的两款药物在亚洲(除日本外)、澳大利亚和新西兰的独家开发和商业化权利。ZW25是一款可同时结合两个非重叠的HER2表位双抗,与化疗联用一线治疗HER2阳性胃食管腺癌(GEA)被FDA授予快速通道资格。
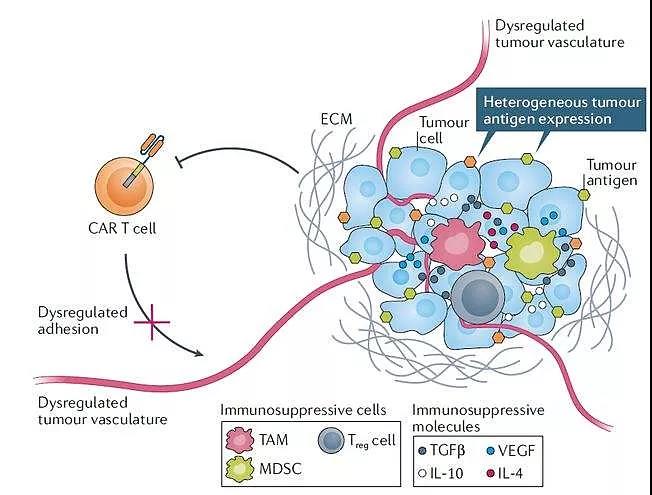
△ZW25是一种双特异性抗体,源自Azymetric™平台,可以同时结合两个非重叠的HER2表位,从而阻断双重HER2信号,增强结合和去除细胞表面的HER2蛋白以及有效的抗体效应子功能。 HER2作为第一个成功实现胃癌的靶点,曲妥珠单抗的问世标志胃癌正式踏入靶向治疗时代。基于胃癌复杂和重要性,未来HER2阳性胃癌临床二三线治疗需求仍存在很大的开发空间。 04 免疫细胞疗法下的再出发 HER2为实体瘤治疗打开新思路 近年来,免疫细胞治疗已成为继手术、靶向药、放射治疗后最有前景肿瘤疗法之一。在全球癌症细胞免疫治疗领域,CAR-T疗法无疑独占鳌头。目前,已有5款CAR-T疗法在血液肿瘤中获批,确立了CAR-T疗法在血液瘤治疗中的领先地位。 基于实体瘤较大的临床需求,越来越多的临床试验开始尝试将CAR-T疗法用于实体瘤,对于至关重要靶点选择,不乏以HER2、Claudin 18.2、GPC3、MSLN、EGFR为代表的实体瘤“明星靶点”。 实体瘤治疗遇困境:攻克肿瘤微环境(TME)成细胞治疗的难题 尽管CAR-T疗法在血液瘤治疗“战功累累”,但在实体瘤中疗效如今差强人意。从目前早期临床统计结果来看,相较于血液瘤几乎100%的总缓解率,在实体瘤的总响应率却不及50%。 造成CAR-T在实体瘤治疗“屡屡碰壁”主要挑战是,与血液瘤不同,实体瘤存在“肿瘤微环境(TME)”。TME中大量血管与基质障碍及抑制性细胞,引发肿瘤耐受,不利于CAR-T进入肿瘤组织发挥作用。
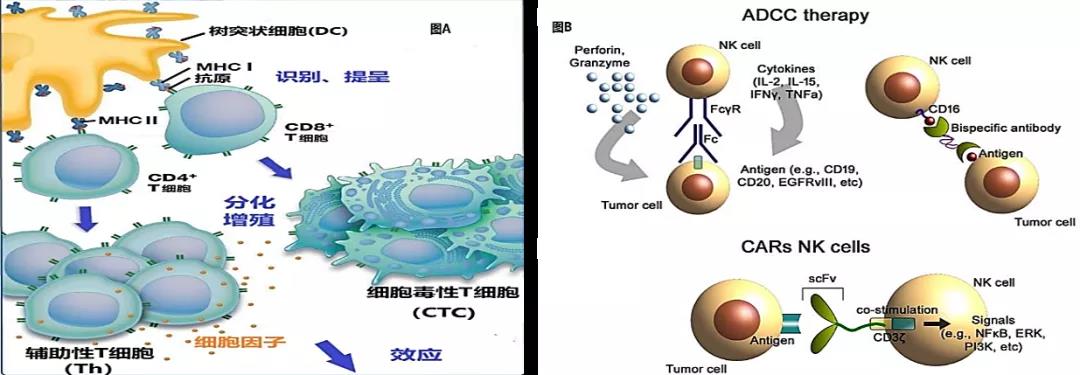
△实体瘤的肿瘤微环境中可能影响CAR-T细胞效力的多种因素 HER2再发威:CAR体外改造巨噬细胞从TME入手攻克实体瘤 可以说,有些先天性的优势决定后续根本性差异。在免疫细胞机理上,T细胞和NK细胞都属于淋巴细胞系,杀伤肿瘤需要通过识别肿瘤表面特异性抗原来杀伤靶细胞。因而,实体瘤复杂的TME,使T细胞和NK细胞难以进入起到杀伤效应。
△图A:T细胞属于适应性免疫,通过识别MHC分子呈递表面抗原,释放穿孔素和颗粒酶导致肿瘤凋亡;图B:NK细胞属于先天性免疫,通常联合单抗药物来诱导抗体特异的细胞毒性(ADCC),杀伤肿瘤细胞 2021年9月,全球首个靶向HER2嵌合抗原受体巨噬细胞(CAR-M)CT-0508获得FDA快速通道资格,使不同淋巴细胞系的髓系细胞:巨噬细胞,在肿瘤免疫治疗中步入大众视野。
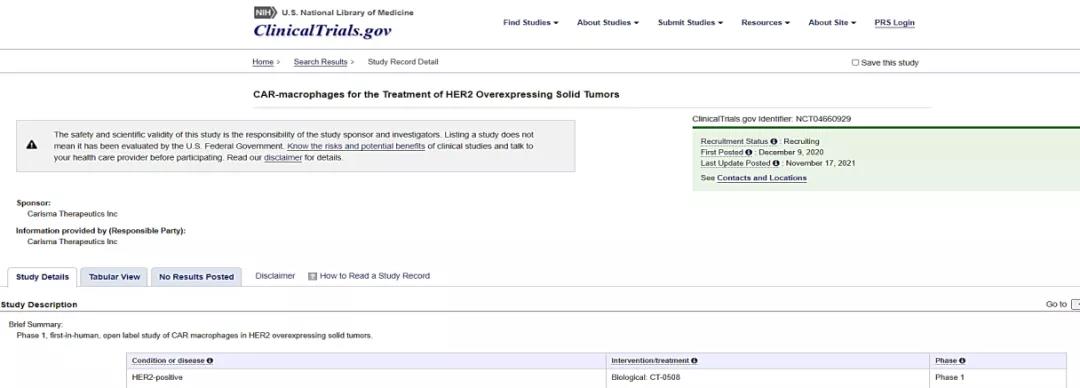
△CT-0508正进行多中心、开放性I期临床试验,试验重点是复发或转移性HER2过表达实体瘤患者 巨噬细胞又称“吞噬细胞”,具备激活后天免疫和吞噬功能,在75%肿瘤中都存在“肿瘤相关巨噬细胞(TAM)”,在细胞因子刺激下向M1(抗肿瘤)或M2(促肿瘤)极化,在TME中具备高度可塑性。因而,靶向TAM改造巨噬细胞有望提高浸入实体瘤TME可能性。
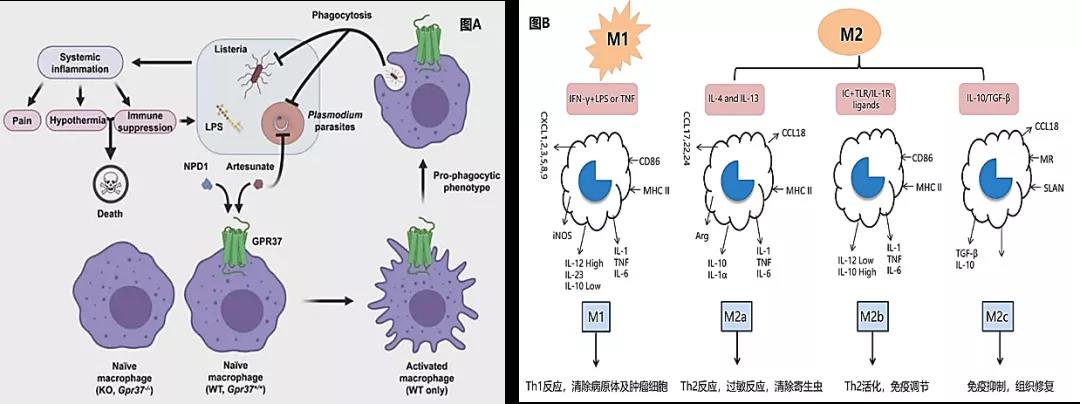
△图A:激活巨噬细胞吞噬细菌的过程;图B:TAM在不同激活条件下分成M1和M2表型 基于该策略,宾夕法尼亚大学佩勒曼医学院研究者首次发现,Ad5f35腺病毒载体构建靶向HER2的CAR体外转导巨噬细胞,可增加对肿瘤吞噬活性和抗原呈递,大幅提高实体瘤动物模型总体存活率。
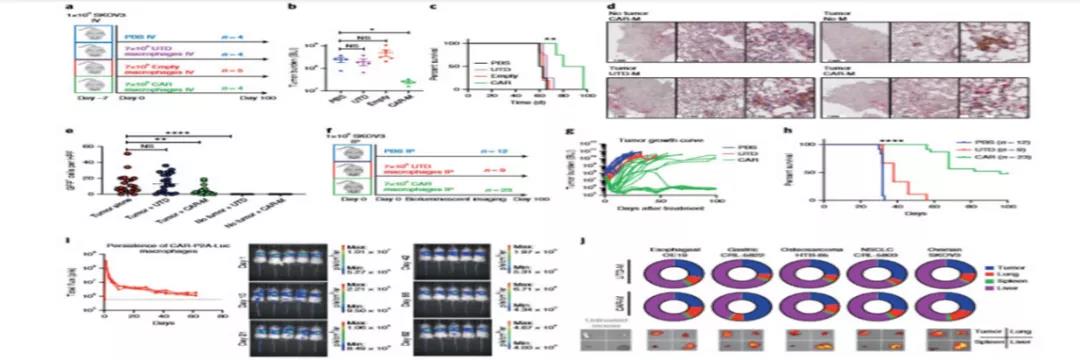
△《Nature biotechnology》期刊首次报道新型疗法CAR-M
△抗HER2的CAR-Ms在异种移植模型中的抗肿瘤活性、持久性和转运评价 同时,CAR-T技术发明人CARL JUNE联手宾夕法尼亚大学CAR-T细胞Saar Gill博士和Michael Klichinsky博士孵化创立CAR-M领头公司Carisma Therapeutics,依据自有技术平台塑造的HER2 CAR-M最快管线CT0508已完成首例患者给药,预计至2022年2月持续扩大临床试验,以深入证明HER2 CAR-M有效性。
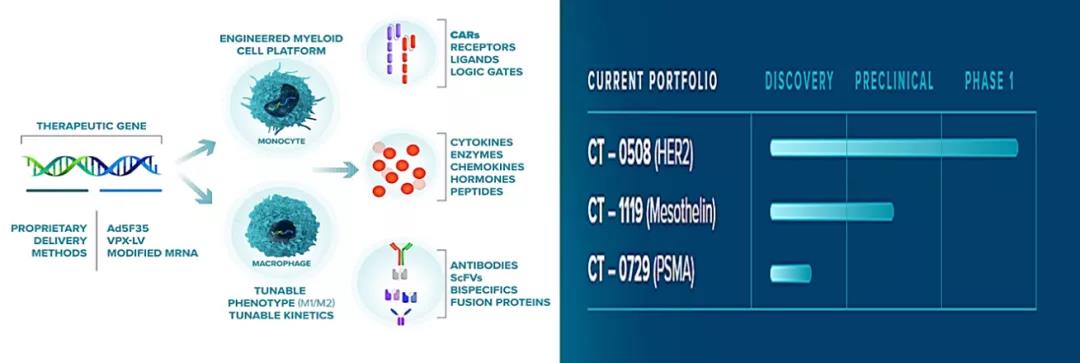
△CARISMA公司的技术平台和管线分布 随着科学研究和技术的进步,无论是单抗为主常规的靶向药,还是ADC、双抗或CAR -T和CAR-M为代表的细胞治疗等各具特色的新型药物的不断涌现,HER 2作为一个广谱靶点,相信未来伴随着差异化和联合用药的实施,HER 2靶向药将会越来越造福人类。 参考文献: [1]https://laskerfoundation.org/winners/herceptin-a-targeted-antibody-therapy-for-breast-cancer/; [2]https://youtu.be/QFXVprOlu84; [3]https://www.zymeworks.com/; [4]http://www.remegen.cn/Invest2.aspx?ID=395; [5]https://www.astrazeneca.com/media-centre/press-releases/2021/enhertu-approved-in-the-us-for-gastric-cancer.html; [6]https://www.ncbi.nlm.nih.gov/pmc/articles/PMC6801189; [7]https://stm.sciencemag.org/content/12/571/eabd6169; [8]https://clinicaltrials.gov/ct2/show/study/NCT04660929; [9]https://carismatx.com/technology/; [10]Coussens L,Yang-Feng TL, Liao YC, Chen E, Gray A, McGrath J, et al. Science. 1985;230(4730):1132-9.; [11]Slamon DJ, Clark GM, Wong SG, Levin WJ, Ullrich A, McGuire WL. Science. 1987;235(4785):177-82. [12]Slamon DJ, Godolphin W, Jones LA, Holt JA, Wong SG, Keith DE, et al. Science. 1989;244(4905):707-12.; [13]King RT. Genentech Drug is Viewed to Be Successful Against Breast Cancer. The Wall Street Journal. 1998.; [14]Maryam Eini, Nahid Zainodini, Hamed Montazeri et al. A Review of Therapeutic Antibodies in Breast Cancer. J Pharm Pharm 2021; [15]Global surveillance of trends in cancer survival 2000–14 (CONCORD-3): analysis of individual records for 37 513 025 patients diagnosed with one of 18 cancers from 322 population-based registries in 71 countries; The Lancet. 2018; [16]Romond EH, et al. N Engl J Med. 2005; 353;1673-1684. and Slamon DJ. Et al. N Engl J Me. 2001;344;783-792.; [17]Nat RevClin Oncol 17, 33–48; [18]Breast Cancer Research 2014, 16:209; [19]Pertuzumab, Trastuzumab, and Docetaxel in HER2-Positive Metastatic Breast Cancer. N Engl J Med 2015; 372:724-734; [20]Diéras V, Miles D, Verma S, Pegram M, Welslau M, Baselga J, Krop IE, Blackwell K, Hoersch S, Xu J, Green M, Gianni L. Trastuzumab emtansine versus capecitabine plus lapatinib in patients with previously treated HER2-positive advanced breast cancer (EMILIA): a descriptive analysis of final overall survival results from a randomised, open-label, phase 3 trial. Lancet Oncol. 2017 Jun;18(6):732-742.; [21]Aiko Nagayama, Neelima Vidula, Leif Ellisen et al. Novelantibody–drug conjugates for triple negative breast cancer. Therapeutic Advances inMedical Oncology 2020; [22]Incidence and mortality of stomach cancer in China, 2014.《中国癌症研究》英文杂志,2018 年第 3 期; [23]Trastuzumab Deruxtecan: Changing the Destiny of HER2 Expressing Solid Tumors. Int. J. Mol. Sci. 2021, 22, 4774; [24]Upadhaya, Samik, et al. "The clinical pipeline for cancer cell therapies." Nature reviews. drug Discovery (2021); [25]Nature Reviews Drug Discovery, https://doi.org/10.1038/s41573-021-00189-2; [26]Laurie E. Harrington, T-Cell Development, Chapter 8, Clinical Immunology, 2019; [27]Morvan, M. G. & Lanier, L. L. NK cells and cancer: you can teach innate cells new tricks. Nat. Rev. Cancer 16, 7-19 (2016); [28]Nature biotechnology. doi.org/10.1038/s41587-020-0462-y;  
|
【本文地址】