| 课堂笔记 | 您所在的位置:网站首页 › 公司cdp是什么意思 › 课堂笔记 |
课堂笔记
|
随着模块3“TPP和CDP的制定”,临床研究管理已完成3个模块的学习。课堂的学习虽然短暂,但对我的启发和收获颇多,至今余音缭绕。而每个模块学习的结束,都让我们踏上新的起点,需要我们将所学运用到实践,才能更加深入的理解。 模块3的“5个最”和“2点感悟”
“5个最”:模块3是最感兴趣的一门课程;是最难一门课程;是新概念最多的一门课程;是启发思维最有用的一门课程;也是收获最大的一门课程。 “2点感悟”:通过4天8位资深老师深入浅出的基本概念讲解和案例分享,不仅学习到了TPP/CDP/RSDP在产品开发中新的工具,而且收获最主要的两点感悟:一是新药临床开发过程,好比行军打仗,不能盲目前进,行军之前需要制定一个好的战略(TPP)、战术(CDP),战场上更是需要一个好士兵团队(多部门共建);二是随着战争的进行,需要不变调整我们的战略、战术(TPP/CDP形成、完善、确定阶段),最终才能取胜(NDA获批)。
如何“内忧外患”地开展新药临床开发?
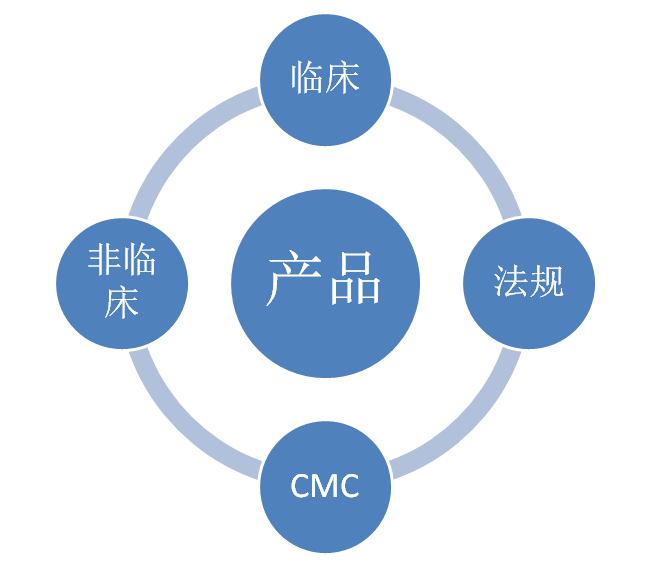
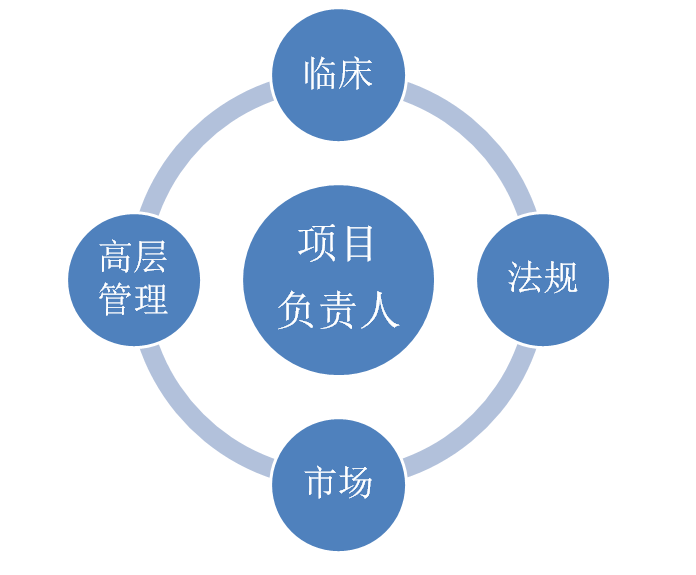
新药临床开发过程,可以说“内忧外患”,内部需考虑药物CRC、生产、临床前和临床的有效性和安全性,以及资金和人力资源等是否充足;外部需考虑市场竞争产品、同类品种研发、政策法规变化、诊疗新进展、市场准入、医保等问题。然而,在面临高风险和高成本等复杂性和挑战性问题的同时,临床开发必须要做到“多、快、好、省、胜”,才能够争取早一日占领市场,获得更多的回报。 那么,怎么样才能做到临床开发的“多、快、好、省、胜”呢?在临床研究中“以终为始”的理念具体怎么执行?这就需要我们首先制定我们的战略-TPP(what),有了战略,还需要通过我们的战术-CDP(why、how、when、where)来达成,而产品研发最终的目标是为了获批上市,从一开始就介入注册策略(RSDP)将使得研发思路更加的清晰。因此,TPP、CDP、RSDP是新药研发的蓝图,而如何绘制好蓝图,需要多部门团队共同完成。
TPP目标产品概况
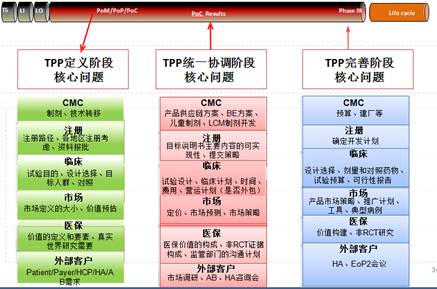
是战略!是新药开发的明确目标!是制定CDP的基础! 下面是根据老师所讲,我尝试总结归纳的图表。 表1.1--TPP概要图(举例) 属性 理想的TPP Acceptable profile 拟上市适应症 Braf V600E/V600K突变的无法切除或转移性黑色素瘤 Braf V600E/V600K突变的无法切除或转移性黑色素瘤 药物形式 小分子 小分子 MOA 双靶点:BRAF和MEK 双靶点:BRAF和MEK 剂型 口服 口服 疗效 ORR>80%;mPFS>17.5m;OS>31m ORR>75%;mPFS>14.5m;OS>28m 安全性 与Vemurafenib具有可比性 与Vemurafenib具有可比性 药物相互作用 无 无 预计上市时间 2013 2013 专利过期时间 2040年之后 2035年 售价 15万RMB/年 20%折扣 图1.1—TPP形成三个阶段及研究团队所起的作用
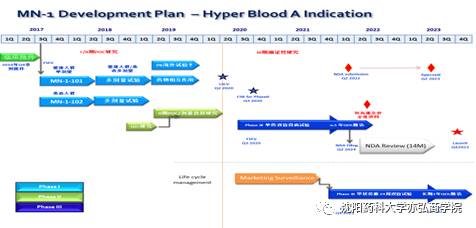
CDP(临床开发计划)
是战术!是达到TPP所规划的目标的线路图! 图2.1--CDP流程图(举例)
图2.2—决策图(举例) 第一层级:产品开发团队
第二层级:临床开发团队
第三层级:临床团队
RSDP(注册策略计划) 是在CDP和TPP的基础上,确保CDP能满足监管机构要求,合理利用法规,与监督机构高效合作,理性沟通风险的线路图! 表3.1—FDA快审审评通道(注册策略考量之一) 通道 适用阶段/条件 快审通道(Fast Track) --IND最初阶段或临床I期--持续递交、加强沟通 突破性治疗(Breakthrough Therapy Designation) --临床I期、II期阶段--优于现有治疗 加速审评(Accelerated Approval) --临床III期阶段--替代终点或中间临床终点指标,有条件批准 优先审评(Priority Review) --NDA阶段--6个月审评时间(标准时间为10个月) 表3.2—FDA的会议类型(注册策略考量之二) 类型 目的 Pre-IND※ Verify acceptability of investigational Plan End of Phase I(rare) Confirm early safety End of phase IIa Setting adequate dose-response evaluation End of phase II Confirm early efficacy; agree on Phase III plan Pre-NDA※ Agree medical establishment concerns Ad-hoc Technical Meetings CMC, Tox, Clinical issues Advisory Committee Meetings Address medical establishment concerns Teleconferences Discuss specific issues Labeling Meeting※ Negotiate final labeling(Prescribing Information) 注:标※的为一定要召开的会议。 结语 TPP、CDP、RSDP是新药开发中的有用工具,工具中的所有数据都需要通过系统的、科学的考量。因此,TPP、CDP、RSDP的制定需要共建多部门、多学科的团队,并且,有了TPP、CDP、RSDP纲领性的文件,才能指引团队人员齐心并进,避免偏离最初的目标。不忘初心,方得始终。 敬请关注亦弘商学院“临床研究管理”课堂,精彩持续放送! 学员笔记返回搜狐,查看更多 |
【本文地址】