| 橙皮书系列之市场独占权(4) | 您所在的位置:网站首页 › 什么是药品anda申请 › 橙皮书系列之市场独占权(4) |
橙皮书系列之市场独占权(4)
|
针对上述情况,2015年,FDA向Restasis仿制药申请人征求意见 (1)申请人X是否是首个申请人? (2)当979专利失效,此产品是否就丧失了180天市场独占期?也就是说,此后的所有申请人都失去了获得180天市场独占期的资格。 共有6家公司进行了回复,其中4家对两个问题的回复都是“yes”,另2家对两个问题回复的都是“No” (其中一家为Teva)。 如何判定“首个申请人”? (1)在MMA(医疗保险处方药报销和革新法)之前 FDA采用“First Effective Approach”的方式来判定“首个申请人”:① 提交一份基本完整的申请,其中包含[IV]证书②及时提供第Ⅳ段声明 通知,使之生效,才有资格获得180天。 借用Glucophage(盐酸二甲双胍缓释制剂)案例来阐述一下及时通知原研企业的重要性: 2002年7月Purepac公司首先提交了ANDA; 2002年11月21日,原研在橙皮书中登记了新专利; 2002年11月25日,Purepac公司补交了针对新专利的PⅣ 声明。同日,IVAX公司也提交了含PⅣ 声明的ANDA并 先于Purepac公司通知原研。 最初FDA认定IVAX公司为首个申请人,IVAX获得180天市场独占期。 后来Purepac公司起诉FDA,最终和IVAX公司分享了180天。 上述案例表明:FDA对于首个申请人的判断,不仅要看ANDA和PⅣ提交的时间,同时还要考虑通知原研的时间。 (2)2003年MMA(医疗保险处方药报销和革新法) 给出首个申请人的定义:在第一天提交一份①基本完整的申请,其中②包含第Ⅳ段证书…以申请批准药品;并且是③法律维护(lawfully maintains) 的第Ⅳ段声明。 (3)MMA之后 FDA在MMA之后一段时间内 仍然采用之前的“First Effective Approach”的方式来判定“首个申请人”。 2017年FDA《Guidance for industry 180-day exclusivity: Q&A》中将申请人的定义与MMA统一。 2018年7月,FDA在Suboxone(丁丙诺啡/纳洛酮舌下膜剂)案例中提到了对首个申请人的判定无需考虑其是否通知原研或专利权人,即申请人不会因为未能及时向原研提供第Ⅳ段声明的通知而失去首个申请人的资格。此观点颠覆了此前Purepac公司案例中的认知。按此观点,在Restasis案例中, 申请人X应属于首个申请人,并且导致其他申请人失去“首个申请人”的资格,不能享有180天市场独占期。 2018年10月,Teva起诉FDA。Teva认为,按照“First Effective Approach”方式判定,申请人X因没有通知原研,不应属于首个申请人,自己才是“首个申请人”,并且应该享有180天市场独占期。而FDA表示不确定Teva何时以及是否能够获得批准,并且即使获得批准,其批准日期也已晚于申请日后的30个月(180天失效条款Ⅳ) ,也会因此失去180天的市场独占期。 2、180天的失效条款-以Suboxone(丁丙诺啡/纳洛酮舌下膜剂)为 例 以下6种情况之一 会导致失去180天市场独占期: Ⅰ在下述截止时间未能上市
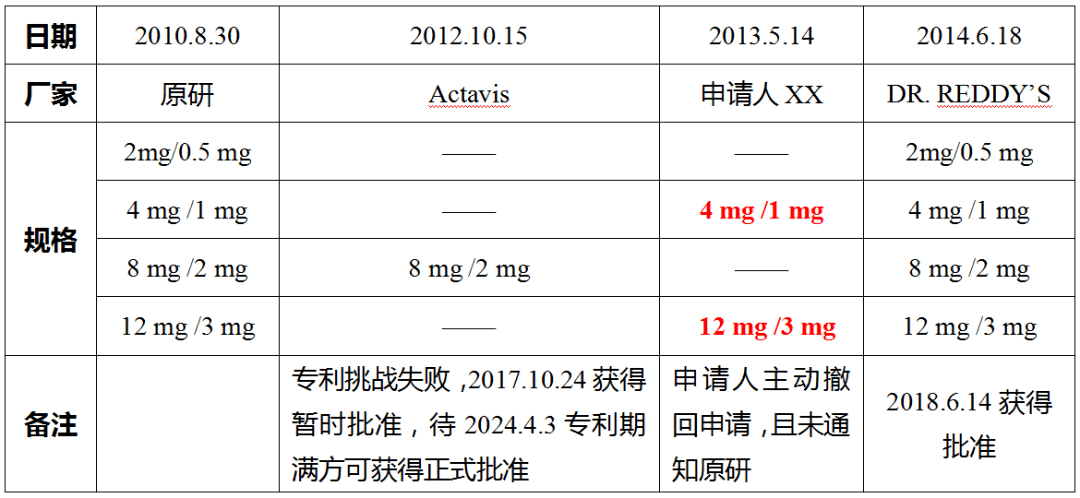
Ⅱ撤回申请;Ⅲ修改专利声明;Ⅳ申请日起30个月未能获得暂时批准;Ⅴ与其他申请人达成协议;Ⅵ所有专利期满。 Suboxone的原研厂家为INDIVIOR INC,该产品共有四个规格,后续仿制药厂家分别针对不同规格提交含第Ⅳ 段声明的ANDA,具体如下表所示。
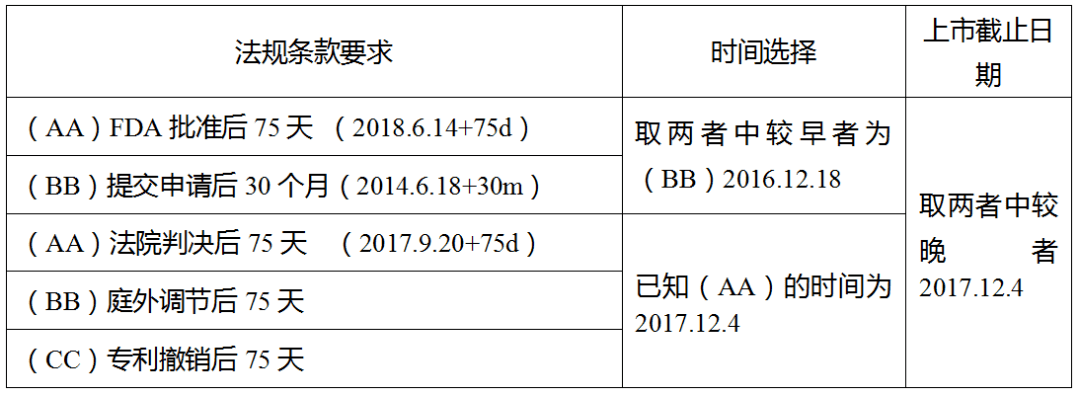
(1) 规格8mg/2mg 该规格的首个申请人为Actavis,申请日为2012.10.15,并且Actavis也通知了原研和专利权人。 然而,Actavis获得暂时批准的日期为2017年10月24日 (从申请日起已超过30个月) 。因此,Actavis 未能在申请日起30个月内获得暂时批准( 180天失效条款Ⅳ),从而 失去该规格的180天市场独占期,其他申请人则因失去首个申请人资格而丧失该 规格的180天市场独占期。对此,Teva应该也没有异议,有异议的是下面两个规格。 (2)规格4 mg /1 mg和12 mg /3 mg 对于这两个规格,申请人XX于2013年5月14日提交了4 mg /1 mg和12 mg /3 mg规格第Ⅳ 段声明的ANDA,但是后续撤回了申请并且未向原研或专利持有人提交第Ⅳ段声明的通知。 对此,FDA不再采用“First Effective Approach”的方式来判定“首个申请人”,即不再考虑 申请人XX是否通知原研或专利权人。 那么,对于4 mg /1 mg和12 mg /3 mg 规格的“首个申请人” 就是申请人XX。 因为申请的撤回(180天失效条款Ⅱ) ,不仅申请人XX失去 了180天市场独占期,而且 导致其他申请人不能再享有180天市场独占期。 (3)规格2mg/0.5 mg DR. REDDY’ S是否享有该规格的180天? 简单套用一下180天失效条款Ⅰ来判断
该规格FDA批准上市的时间为2018年6月14日,晚于上述截止时间2017年12月4日,按此判断,应该也失去了180天的市场独占期。 3、小结——如何确保“首个”? (1)以下时间点要争先 ①ANDA提交时间;②PⅣ提交时间;③通知原研的时间(这个是案例中争议最大的) (2)从内容上要保证 ①基本完整的申请(如及早 收到FDA的AL,确保在30个月获得暂时批准); ②包含第Ⅳ 段证书(针对橙皮书中新增的专利,后续可以增补PⅣ) ③ 法律维护(期间不变更声明的类型,如从PⅣ 变成PⅢ) 本篇内容选择的案例之间相互关联,这个过程中首个申请人的判断标准又发生了变化,为便于阐述,文中仅截取所需的部分,难免断章取义,加上个人水平所限,其中的争议点也未能阐述清楚,敬请谅解。 感谢小林对本篇内容的梳理修订,感谢苏编排版整理。下一篇我们讨论一下专利挑战中重要的时间节点。 本文版权归原作者所有,申请转载或合作请联系[email protected]返回搜狐,查看更多 |
【本文地址】