| 阿替普酶、尿激酶原、替奈普酶,谁是王者“溶药”? | 您所在的位置:网站首页 › tpa一100价格 › 阿替普酶、尿激酶原、替奈普酶,谁是王者“溶药”? |
阿替普酶、尿激酶原、替奈普酶,谁是王者“溶药”?
|
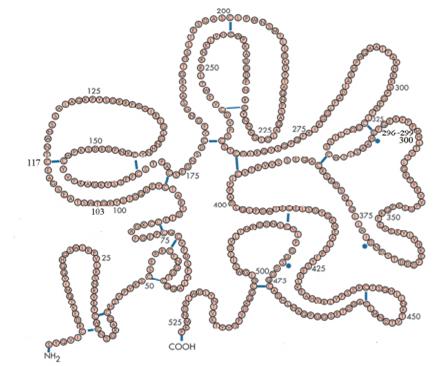
从发展历程看,国内溶栓药开发要远远落后于国外,且基于我国国情,尿激酶在基层使用仍较为普及,但是随着胸痛中心及卒中中心在基层的广泛建立,新型溶栓药将不断普及。 二、溶栓药的溶栓机制 血液中有2种纤溶酶原激活剂(PA),一种是血管内皮细胞分泌的组织型纤溶酶原激活剂(t-PA),另一种是由肾细胞分泌的单链尿激酶纤溶酶原激活剂(scu-PA),在PA的作用下,纤溶酶原(Pg)转变为纤溶酶(Pm),Pm将血凝块上不溶性纤维蛋白降解为可溶性产物,从而使血栓溶解。 三、溶栓药的三个特性 1.溶栓药对纤维蛋白的特异性是决定溶栓治疗最重要的药理学特性。 溶栓药对纤维蛋白选择性越高,溶栓的特异性就越高,全身出血风险就越低。 2.溶栓药第二个特性就是半衰期, 半衰期偏长增加出血风险,偏短需持续给药,合理的半衰期既保证疗效又带来使用的方便性。 3.溶栓药第三个特性是 对I型纤溶酶原激活物抑制剂(PAI-1)的抗性,PAI-1是纤溶系统的主要生理抑制剂,可与组织型(t-PA)和单链尿激酶型纤溶酶原激活物scu-pA)特异性结合,使二者迅速失活,从而发挥抗纤溶作用。 溶栓药对PAI-1抗性低,会导致药物到达血栓部位出现对溶栓效果的中和作用,而降低溶栓效果。 四、溶栓药的代表 根据发现时间的先后和药物的特点, 可将溶栓制剂分为三代。根据溶栓药物是否选择性作用于纤维蛋白而分为非特异性纤溶酶原激活剂和特异性纤溶酶原激活剂两大类。 第一代溶栓药:尿激酶(UK,非特异性纤溶酶原激活剂) 1951年Willams从尿中发现尿激酶,由人肾细胞合成并可从尿液中提取的一种蛋白水解酶,所以称之为尿激酶,现多采用基因工程技术合成,由两条肽链组成,分子量54000。以前有人认为尿激酶有不同分子量形式,其实低分子量(32000)的尿激酶实际上是高分子量54000尿激酶的酶解产物。尿激酶通过水解纤溶酶原中的Arg560-Val561肽腱,将血液循环中的纤溶酶原激活为纤溶酶。 注射用尿激酶:410个氨基酸组成的双链丝氨酸蛋白酶。 特点:①尿激酶对纤维蛋白没有特异亲和性,将纤溶酶原转变为纤溶酶时不需纤维蛋白作辅因子,而是直接将纤溶酶原转变成纤溶酶。由于缺乏特异性,循环中的及已结合的纤溶酶原都被转变成纤溶酶,从而导致过量的纤溶酶,并使体内可利用的抑制剂快速耗竭。过量的纤溶酶可不加区别地消化纤维蛋白原,即造成全身性纤溶状态,增加病人的出血。②尿激酶在体内半衰期短,一次静脉注射后半衰期为9.3分钟,而滴注后半衰期为16.1分钟。③血管开通率较低。 应用:价格低廉,在基层医疗机构应用较多。 注意:溶解新鲜血栓,对已机化的陈旧血栓无效。 因此,以特异性纤溶酶原激活剂为重点的第二代溶栓药应运而生。 第二代溶栓药:阿替普酶、尿激酶原 1.组织型纤溶酶原激活剂(t-PA): 1983年,Collen提出调节体内纤维蛋白溶解的分子模式:在缺乏纤维蛋白时,t-PA对纤溶酶原的亲和力弱,而当有血栓形成时,t-PA便与纤维蛋白结合形成复合物。纤溶酶原对此复合物有高度亲和力,并通过纤维蛋白表面的环状纤维桥被t-PA充分激活,局部浓度增高。在此反应中,纤溶酶原主要通过所谓的“赖氨酸特殊结合部位”与纤维蛋白相结合。因此,在纤维蛋白表面形成的纤溶酶,由于其赖氨酸结合部位和作用部位已被纤维蛋白占据,使得α2-抗纤溶酶只能使其缓慢失活。而释放入血的纤溶酶由于其赖氨酸结合部位未被占据,则迅速被α2-抗纤溶酶所结合而失活。所以理论上t-PA只引起局部溶栓而不产生全身性纤溶状态。 阿替普酶(rt-PA)是用基因工程技术制备的重组t-PA,由527个氨基酸组成的单链丝氨酸蛋白酶。
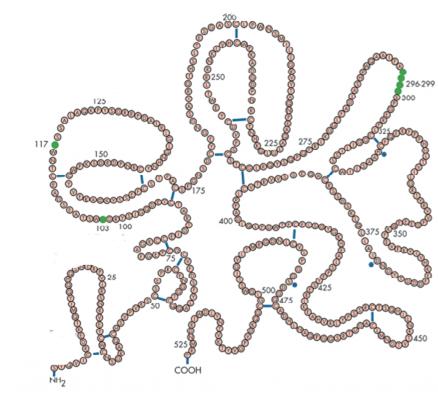
图1:阿替普酶 特点:①对纤溶酶原的激活是间接性的,仅仅激活血栓中已与纤维蛋白结合的纤溶酶原,对血浆中游离的纤溶酶原无激活作用,因此,对纤维蛋白降解具有特异性。②肝脏代谢,半衰期短4~5分钟。 应用:价格较贵,被称为卒中溶栓的金标准。 注意:但由于半衰期短,需要静脉推注+持续静脉滴注,颅内出血风险依然存在。 2.单链尿激酶型纤溶酶原激活剂(scu-PA): 1973年Berink首先在组织培养液中发现了尿激酶原,接着1979年Husain等从尿中纯化出一种新的高分子的单链尿激酶,1981年Wun等证明它是尿激酶的前体,所以称它为尿激酶原( prourokinase,pro-UK )。1985年国际血栓形成和止血委员会正式称该酶为单链尿激酶型纤溶酶原激活剂。 同t-PA一样,因为是人体生理性纤溶酶原激活剂,在无血栓存在时,其激活纤溶蛋白酶原的活力极低;而在遇到血栓后,纤维蛋白E片段促进尿激酶原的酶活力,使其将纤溶蛋白酶原转变成纤溶蛋白的活力增加500倍以上,由于这一特性,只有结合在血栓上的纤溶蛋白酶原才能被转化成纤溶蛋白,后者又在血栓表面将尿激酶原转化成UK,使得血栓表面纤溶蛋白生成的速度进一步加快。由于所有这些过程均在血栓表面进行,当这些在血栓表面形成的纤溶酶或UK离开血栓后即被血液中的抑制剂中和,因而不会导致系统性纤溶蛋白原活化及纤维蛋白原的降解。 注射用尿激酶原(rhPro-UK):是用基因工程技术制备的重组尿激酶原,由411个氨基酸组成的单链丝氨酸蛋白酶。 在Lys 158 -Ile 159 间(下图箭头所示处),该肽链可被纤溶酶、胰蛋白酶、激肽释放酶等水解成A、B两条链,水解后接着将A链羧基端158位点的赖氨酸残基除去,最终A链由第1~157位氨基酸残基组成,B链由第159~411残基组成,A、B两条链间由Cys148和Cys279之间的二硫键相连组成双链UK,由此pro-UK就被转变成为具有高催化活性的尿激酶。
图2:尿激酶 特点:①对纤维蛋白降解具有特异性性。②血管开通率70%以上。③肝脏代谢,半衰期随剂量增加而减少,存在非线性动力学过程,一般在7-10min。 应用:国外研究较早,并且证实在疗效上显著优于第一代溶栓药,但在副作用方面没有明显优势,未批准其上市。国内批准用于急性ST段抬高性心肌梗死治疗。 注意:当血液中尿激酶原浓度高过一定程度后,尿激酶原转化成UK的速度急聚增加,由此形成的UK超过了抑制剂的中和能力后,所有的UK的不良特性 便显示出来。当血液中的尿激酶原浓度低于一定程度时,其被转变成UK的速度也很低,在血液中基本上是以尿激酶原的方式存在。由此提示,在使用尿激酶原作为溶栓治疗时,给药剂量与溶栓效果及副作用极其相关。 总的来说第二代溶栓药虽然在特异性得到提高,但溶栓药另外两个特性仍旧不能令人满意,于是注重安全、有效、与更为简便的给药操作的第三代溶栓药诞生了。 第三代溶栓药:替奈普酶(TNK-tPA)
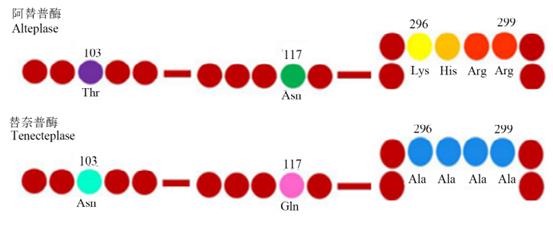
图3:萘替普酶 TNK-tPA是t-PA的多点变异产物,即103位点的苏氨酸被天冬酰胺替代,增加了一个新的糖基化位点,扩大分子的同时也延长了它的半衰期;117位点的谷氨酰胺被天冬酰胺替换后减少了一条高甘露糖型侧链,使其清除率降低、半衰期延长;296-299位点的氨基酸替换后提高了其对于PAI-1的抵抗能力和对于Fb的特异性。
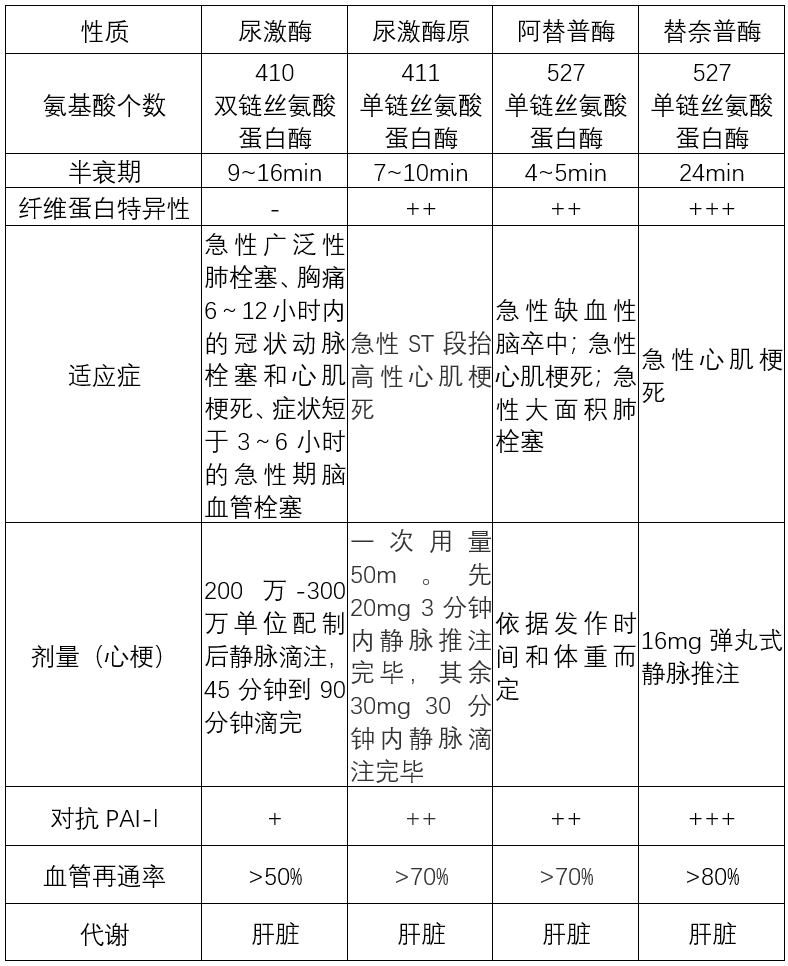
图4:阿替普酶与替奈普酶的氨基酸序列差异 特点:①纤维蛋白的选择性较rt-PA高14倍。②对PAI-1的抵抗能力较rt-PA高80倍。③肝脏代谢,血液循环中半衰期接近24min。 应用:急性心肌梗死。 注意:目前在急性缺血性脑卒中临床研究中已显现其不错的临床获益,并且仍有多项关于替奈普酶的研究正在进行中。 五、一表总结
总的来说:比起r-tPA的溶栓效果而言,一点小繁琐的计算和操作不算什么;尽管如此,如果可以将总量一次团注,那自然是更完美,替奈普酶似乎已显示王者“溶药”的风范,能否挑战阿替普酶在卒中的地位,还将拭目以待。 参考文献: [1] 王兆钺. 一种新的溶栓药一组织纤维蛋溶酶原活化剂[J]. 新药与临床,1989,8(6):378-380. [2] 奉涛. 溶栓药物的临床应用及其进展[J]. 临床合理用药,2011,4(6B):145-146. [3] 蔡汉民. 链激酶、尿激酶的药理及应用[J]. 河北医药,1980,04:49-54. [4] 郑兴. 新的冠脉溶栓剂: 人体组织型纤溶酶原激活剂[J]. 国外医学分册· 心血管疾病分册,1986,06330-333. [5] 张正光, 肖成祖, 胡显文, 等. 国产人尿激酶原的药效学、药理学和毒理学研究[J]. 中国科学,2011,41(10):1024 ~ 1029. [6] 俞炜源, 张正光, 肖成祖. 尿激酶原的性质、结构、功能及其药代动力学和临床应用效果[J]. 生物技术通讯,1998,9(1):35-44. [7] 刘秀文, 孙自勇, 窦桂芳. 重组人尿激酶原药代动力学的研究[J]. 南京大学学报,2001,37(4):435-449. [8] 张正光. 重组人尿激酶原的临床研究概况[J]. 生物技术通讯,2012,23(2):294-299. [9] 孙旭红, 吴菁. 替奈普酶治疗急性缺血性脑卒中[J].Chin J Clin Neurosci,2019,27(6):676 ~686,699. 返回搜狐,查看更多 |
【本文地址】