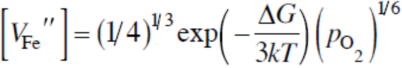| 缺陷化学总结(二) | 您所在的位置:网站首页 › tio2化学性质稳定吗 › 缺陷化学总结(二) |
缺陷化学总结(二)
|
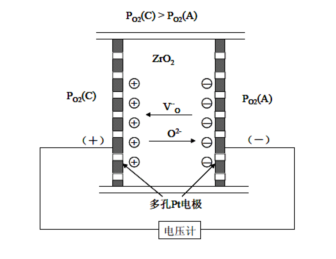
考虑到体系中失去的氧很少,认为;从反应式中可得,则3-3-4 平衡常数K与反应吉布斯自由能变的关系为: 即对一定的反应,K是温度的函数。则温度一定的情况下,由式3-3-4有: 由于TiO2是电子导电,其电导率,所以。 从以上的推导中,我们得到了TiO2电导率与氧分压的关系,其它的缺阴离子型非化学计量化合物也有类似的关系成立。利用这种关系,可以制作氧分压传感器、氧离子导体和燃料电池。ZrO2与TiO2不同之处在于:ZrO2氧离子空位扩散速度快,氧离子通过空位的扩散是电导的主要因素。图3-6为ZrO2氧分压传感器示意图。
图3-6氧分压传感器的示意图 氧离子O2-从高氧分压侧PO2(C)低氧分压侧PO2(A)移动,结果在高氧分压侧产生电荷积累,在低氧分压侧产生负电荷积累,即 在阳极侧: 在阴极侧: 按照能斯脱理论,产生的电动势为: 式中,R为气体常数,F为法拉第常数,T是热力学温度。当一侧的氧分压已知的条件下,可以检测另一侧的氧分压的大小。ZrO2氧敏元件广泛应用于汽车锅炉燃烧空然比的控制、冶炼金属中氧浓度以及氧化物热力学数据的测量等。若从外部施加电压,还可以用作控制氧浓度的化学泵。 可以把ZrO2看作氧离子导体,当其两侧的氧分压不同时,在ZrO2内部会产生由高氧分压到低氧分压的氧离子流。用这种性质制作的氧分压传感器可以用来测燃烧过程中的还原—氧化比。 CO和CO2的分压比可以看作燃烧过程的还原—氧化比,其反应式为:,平衡常数,则还原—氧化比为:。查得此反应的平衡常数,再用氧分压传感器测氧分压,代入上式,即可得出还原—氧化比。 若将某一侧的氧气换成氢气或一氧化碳,控制该侧的氧分压,则在两侧形成固定的电势差,可制成无汞无污染的“燃料电池”,有很好的前景。 2.阳离子间隙型 以ZnO和CdO为代表,它们都是阳离子处在晶格间隙的类型,并由此产生弱束缚电子,是N型半导体材料。 将ZnO放入Zn蒸汽中加热,Zn会进入ZnO的晶格间隙,缺陷反应方程式为: 3-3-5 或3-3-6 一般以式3-3-5为主,因为Zn完全电离为Zni..比较困难。式3-3-5对应的反应平衡常数为: 从而得到的ZnO电导率为: 对于阳离子间隙型化合物,其缺陷反应的实质就是: 3-3-7 3.阴离子间隙型 以UO2为代表,其缺陷反应实质为: 3-3-8 可见阴离子间隙型化合物的导电机制是电子空穴导电,所以是p型半导体材料。同样,用平衡常数表达式可以推出其电导率为: 4.阳离子空位型 以FeO为例,FeO中总有正二价的亚铁离子变成正三价的铁离子,并产生二价铁离子空位。一般也称FeO为“非化学整比化合物”,其缺陷反应方程式如下: 实质是:3-3-9 而且
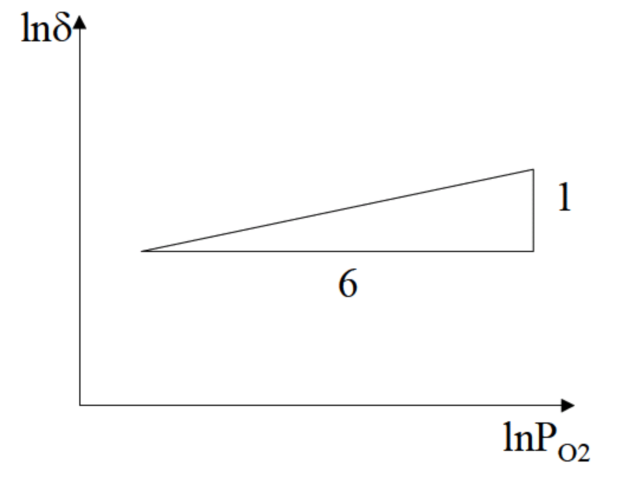
由平衡常数表达式推出的电导率为: FeO电导率和氧分压之间的关系可用图3-7表示。
图3-7FeO电导率和氧分压之间的关系 以上给出了四种常见的非化学计量化合物的缺陷反应式,它们的导电机制和电导率与氧分压的关系。为方便查询,将这四种的代表化合物的化学式列出: Ⅰ型(缺阴离子型): Ⅱ型(阳离子间隙型): Ⅲ型(阴离子间隙型):UO2+x Ⅳ型(缺阳离子型): 可以看出:首先,对某种化合物来说,分类并不是固定的。如TiO2,在不同的氧分压下其导电机制是不同的。低氧分压下是电子导电,高氧分压下是空穴导电;其次,由于以上的非化学计量化合物的电导率都与氧分压的次方成比例,故可以做ln(deta)~lnPO2图,从斜率就可判断该化合物的导电机制。 ZnO这种材料容易受激,产生弱束缚的电子和空穴。若将ZnO放在H2S水溶液中,并用紫外光照射激发,则产生的弱束缚电子和空穴会与H2S反应: 从而除去硫化氢。由于石油裂解过程是在氢气气氛下进行,石油中的硫会形成硫化氢。所以ZnO可用于石油的脱硫。 b.化学式 化学式的写法要遵守电中性原则。一般考虑1mol基体对应xmol置换离子。举例如下: 1)向1mol的ZrO2中掺入xmol CaO发生置换反应,方程式为: 则ZrO2的化学式为:Zr1-xCaxO2-x它表示xmol CaO提供xmol的钙离子,置换了xmol的锆离子,并由于置换离子的价数不同,在基体中造成了xmol氧空位。用电中性原则检验有:。 2)向1mol的ZrO2中掺入CaO发生反应: 即一部分钙离子置换了锆离子,另一部分钙离子填在氧化锆晶格的间隙中形成间隙离子。仍以置换离子数为xmol,则共有2xmol钙离子反应,ZrO2的化学式为:Zr1-xCa2xO2。 3)向1mol的Al2O3中掺入xmol MgO发生置换反应,方程式为: 按前述原则,Al2O3的化学式为:Al2-xMgxO3-0.5x。 4)向1mol的Al2O3中掺入xmol MgO发生填隙反应: 按上述原则,Al2O3的化学式为:Al2-0.667xMgxO3。 5)向1mol的Al2O3中掺入Cr2O3发生置换反应: 此为等价置换,认为掺杂的铬离子为xmol,则Al2O3的化学式为Al2-xCrxO3。 6)1mol的5)中形成的Al2-xCrxO3中再掺入xmol NiO,发生置换反应: 。则Al2O3的化学式为Al2-x-yCrxNiyO3-0.5y。用电中性条件检验:3(2-x-y)+3x+2y-2(3-0.5x)=0。 1 3 4 今天就到这里啦,大家下次见么么哒~~~返回搜狐,查看更多 |
【本文地址】