| 除了Swan–Ganz导管,血流动力学监测我们还有…… | 您所在的位置:网站首页 › svo2怎么计算 › 除了Swan–Ganz导管,血流动力学监测我们还有…… |
除了Swan–Ganz导管,血流动力学监测我们还有……
|
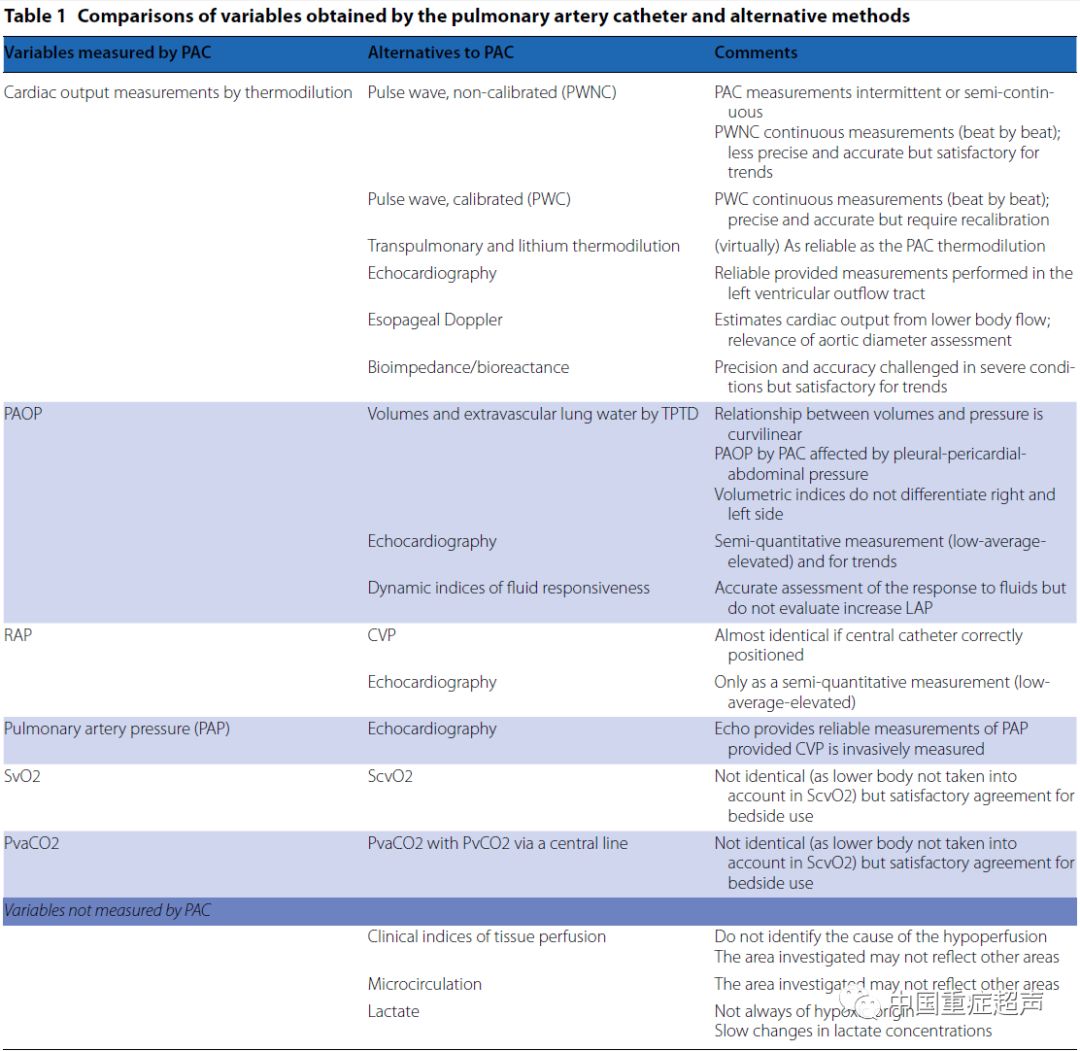
由于对PAC的侵袭性操作的担忧,微创甚至是无创的技术已经越来越多被应用于临床。其他的技术,包括微创监测和心脏超声,可以显示PAC所捕获的许多血流动力学值和变量。这些设备中的一些可以提供一些PAC以外提供的信息。 重要的是要知道变量的内在价值和替代设备的局限性,以及丢失的信息, 并要确定这些设备在哪些条件下可用或不可用,或这些替代技术什么时候能提供PAC不适合提供的信息(表1)。这项宏伟的回顾性分析/共识旨在解决使用这些替代血流动力学监测装置所涉及的许多问题。
组织灌注的临床指标 在循环休克的早期,临床检查提供有价值的信息。谵妄,意识模糊,呼吸急促,皮肤冰冷或湿冷,持续皮肤紫绀是其中颇为显著的异常,并被用于描述休克和评估组织灌注异常的患者。除了比较客观的测量方法外,还存在相对简单的外围灌注主观测量方法。对皮肤温度、大脚趾温度、大脚趾温度差和中心温度/环境温度的主观评价,以及远端手臂与手指的皮肤温差均具有临床相关性。主要的问题是确定参考点是否应该是环境或中心温度,以及何种程度的治疗应受温度差异的影响。 组织灌注的生物学指标
1 中心静脉氧饱和度(ScvO2)的测量通常被认为是SvO2的替代物,但它并不等同于SvO2。ScvO2是用身体上半部分的血液测量的,而不是从下半部分和冠状窦流出的血液测量。由于内脏器官占心脏输出的四分之一到三分之一,在休克状态的内脏区域的血流首先出现减少,肝静脉的氧饱和度会显著影响SvO2和ScvO2之间的一致性。在正常情况下,因为高肾静脉氧饱和度的贡献,SvO2值略高于ScvO2。休克状态下,SvO2值通常比ScvO2低,因为内脏和肾循环中静脉饱和度下降的幅度更大。因此,在全身范围来讲,ScvO2与SvO2相比对灌注减少的敏感性较低。ScvO2没有说明血流动力学改变的来源。此外,由于微循环的改变和/或细胞功能障碍,它在分布性休克中经常升高。尽管有这些局限性,测量ScvO2有助于解释其他血流动力学设备收集的数据,这是很重要的。总之,低的ScvO2值反映了循环收到威胁,而正常的ScvO2值并不保证循环流量的充足性。 2
血乳酸是组织灌注不足的重要标志。在实验条件下,一旦耗氧量受到氧气输送的限制,乳酸含量就会急剧上升。因此,它是休克管理中的关键措施之一。然而,对乳酸测定的解释有两个潜在的问题。首先,乳酸不仅是低氧的来源,而且也可能是由于炎症或儿茶酚胺的影响而激活的糖酵解途径。其次,当乳酸含量在缺氧情况下急剧上升时,乳酸值的降低可能需要时间,因为它的间隙也可能受到影响。然而,推荐观察乳酸水平和它们的动力学在休克状态的管理中。
3 对静脉和动脉PCO2 (PvaCO2)之间的梯度的测量也有助于评估组织灌注的充分性。在正常情况下,这个梯度是6毫米汞柱,因此,若这一梯度> 6 mmHg提示一个组织灌注可能存在不充分。增加的PvaCO2可能是心输出量不足(然后ScvO2水平也应该低)或微循环功能障碍(然后ScvO2水平通常很高)的结果。 更重要的是需要认识到,ScvO2、乳酸和PvaCO2的绝对值表明存在一个循环问题,但这些都不能直接告诉医生疾病的根源。因此势必将这些生物指标与其他血流动力学变量结合起来。 4
重要的是要认识到,ScvO2、乳酸和PvaCO2的值表明存在一个循环问题,但这些都不能说明问题的根源。因此建议将这些生物指标与其他血流动力学变量结合起来。 中心静脉压:使用和误用 中心静脉压(CVP)在中心静脉导管尖端测量。它的正常值范围在0到3毫米汞柱之间。它是RAP的公认的替代。CVP可以用于多种用途。 为了优化组织灌注压力:CVP是静脉回流的下游的压力,升高的CVP导致组织毛细血管压力升高,引起“静水压增高”组织水肿,并通过降低器官灌注压降低器官灌注。在实践中,选择最优平均动脉压(即器官血流的上游压力)。CVP高时应考虑,低时可忽略不计。 指导液体复苏:CVP也被认为是RV充盈压力的代表,因此被用来估计RV前负荷。然而,这两个假设在任何情况下都可能不正确。首先,CVP表示RV的填充压力只有在RV周围的压力既不太高也不太低的情况下。RV周围的压力是心包或胸腔内压,两者更高。为了尽量减少胸内压力的增加,必须在终末期测量CVP。然而,在(外部或内在)正性呼气压力的情况下,测量的CVP会高估了跨壁CVP。在实际操作中很难确定跨壁CVP。其次,RV充盈压力与RV前负荷的关系是复杂的:在正常情况下,RV舒张压力随RV的舒张而增大。在RV过度扩张或肥厚的情况下,出现相反的现象,导致CVP高估了RV体积的增加。因此,CVP及其变化不是RV前负荷的标志。重要的是,即使我们假设CVP反映了RV前负荷,它还是一个相当糟糕的前负荷标志。实际上,由于RV前负荷-心搏量的关系(Frank-Starling机制)之间的个体差异,评估前负荷不评估前负荷反应性。因此,前负荷的标记不能可靠地预测液体的反应性,即使极端值可以用来预测液体的反应。因此,最近的指南建议在脓毒症患者中使用液体反应的动态标记物来进行液体复苏。然而,CVP的动态评价可用于评价患者对液体管理的耐受性。 评价右心室功能障碍:如上所述,CVP与右室容积之间的关系是曲线。因此,一个显著的右心室功能障碍与增加的CVP相关。综上所述,CVP是重要的:(1)估计静脉回流压;(2)鉴别引起高RV充盈压的原因(应考虑跨壁CVP)和RV功能障碍(通过心脏超声证实)。CVP是对液体反应性的一个较差的预测指标,但CVP的动态评估可用于评估患者对液体的耐受性。 脉搏波分析的心脏输出测量 在对动脉血压波形进行数学分析的基础上,对每搏量(SV)和心输出量(CO)的估计称为脉搏波分析、脉压分析或脉冲轮廓分析。左心室SV是定义动脉脉压的主要变量之一,因此从脉压推断SV似乎是合理的。 利用脉冲波分析方法,开发了多种算法。波形的形状取决于各种因素,包括心室射血、主动脉阻抗、动脉顺应性和血管舒缩性,这些因素都影响着大动脉内压力波的速度和周围动脉的压力波反射的程度。 脉搏波分析所用的动脉血压波形可以用动脉导管或非侵入性的方式记录在患者手指上(血管剥离技术,也称为卷钳法或简单的指套技术)或通过桡动脉(自动桡动脉平压测量)脉搏波分析的测量性能依赖于动脉血压波形的完美质量,这在严重血管收缩的患者中经常受损。 根据所使用的系统,SV或CO的脉冲波分析值可以不校准或校准到外部值(例如,用稀释技术获得)。将CO值校准到一个外部参考CO值可以提高脉搏波分析的准确性和精度,并推荐给那些血管舒缩功能失常的患者,例如脓毒症患者或肝功能衰竭患者。然而,这些需要频繁的重新校准,特别是当血管张力改变时。未经校准的系统仅通过分析其特征来估计CO的值。在动脉压力波形和使用病人特定的人体测量,生物统计,和人口数据。未校准的系统在评估动脉压力波形变化的程度上有不同之处,这些变化是由于SV的变化和/或血管张力的改变引起的。在大多数情况下,未校准设备的精度和精度都是中等到差,但是由流体引起的变化可以可靠地跟踪。一些系统使用专用的算法来考虑血管张力。虽然最初的版本在血管张力低的患者中并不可靠,但最近的发展使得这些患者更可靠。 无论使用何种系统,标记和/或周围血管阻力的快速变化都可能影响从脉冲波分析中测量CO的可靠性。在校准的方法中,再校准有助于恢复准确性。未校准的评估血管张力的方法需要时间来恢复准确性,并且在达到新的平衡之前失去可靠性。 脉冲波分析的主要优点是它提供了实时CO的连续估计,可以即时检测CO对时间、处理或机动的变化。当SV的值随着单个节拍的变化而变化时,脉搏波分析也可以提供动态的心脏预负荷变量[在被动的腿抬高试验中,脉压(PPV)和SV的呼吸变化或心脏输出的反应]。这些指数的表现超过了对液体反应性的预测,现在推荐用于治疗休克和脓毒症。 大多数方法的主要缺点是(除了经肺热稀释法—见下图),提供了关于心脏输出测量和动态心脏前负荷变量的最小信息,使其在复杂患者中使用较少。 经肺热稀释法 采用(经肺热稀释法)TPTD技术对一些脉冲轮廓/脉冲波分析设备进行标定。经肺热稀释法和经右心热稀释法对心输出量的测量一样可靠。 除了CO之外,TPTD还提供了以下变量:全心舒张末容积(GEDV),它可以评估前负荷容积;血管外肺水(EVLW),评估肺水肿程度;肺血管通透性指数(PVPI)则有助于区分心源性和渗透性肺水肿。表2给出了各变量各自的优缺点。注意,EVLW和PAOP不提供相同的信息。EVLW提供了肺内积液量的信息,而PAOP(或更好的是肺动脉毛细血管压力,不幸的是在日常实践中难以测量)表示瞬时静水动力。 当用PAC作为充盈压力时,心脏体积的测量对于心脏功能的评估是非常有趣的。和其他静态测量一样,心脏体积也不能预测液体的反应。此外,当面对增加的舒张末期容积时,区分右心和左心的扩张是不可能的。因此,需要心脏超声来确认心脏体积改变时的诊断。 有趣的是,最近的一项对127例脓毒性休克患者同时获得TPTD和重症心脏超声的研究数据,发现有78%的患者与治疗决定的一致性有良好的一致性。虽然这并不意味着在其他类型的休克中也会观察到类似的发现,但这说明了测量变量的临床意义。 所有被测变量的结合使得经肺热稀释法成为一种有价值的、侵入性较低的替代PAC设备,特别是在复杂的情况下,如与急性呼吸窘迫综合征(ARDS)相关的血流动力学不稳定,每一种可能的干预都可能带来严重的伤害(治疗矛盾)。特别是基于液体反应变量的液体管理比基于充盈压力的液体管理有更好的理论基础。同时测量的EVLW和PVPI可识别在液体管理过程中存在肺水肿风险的患者。 TPTD提供的额外信息已被证明可以显著改变医生的治疗决定。与PAC一起,在严重休克和复杂情况下的患者的管理中建议使用TPTD。虽然容积指标和血管内压力是与生理相关的,但TPTD和PAC提供的心血管功能信息有时会因压力/体积曲线和测量误差而产生分歧。在大多数情况下,这两种技术会导致类似的诊断分类,但在一些患者中可以观察到不同。 虽然被认为比PAC的侵入性更小,但TPTD仍然需要插入中心静脉导管和大动脉的插管(通常是股动脉)。最常见的并发症是局部小血肿(4.5%)和感染(2%)。 直接对两种技术的结果进行面对面的比较是非常有限的。在一群监测TPTD或者PAC,患者中,与PAC相比TPTD患者需要更积极液体平衡和更多的机械通气天数。对潜在混杂因素进行调整后无差异。在一个小的随机试验中,没有观察到生存率的差异;然而,在心脏功能受损患者的亚组中,机械通气时间较短,但在ARDS患者中却没有。 总之,与PAC相比,TPTD提供了一种同样精确的CO,更好的流体状态评估,以及EVLW的独特度量,这对ARDS的情况很有帮助。它的主要缺点是区分左心室和右心室的性能能力差。
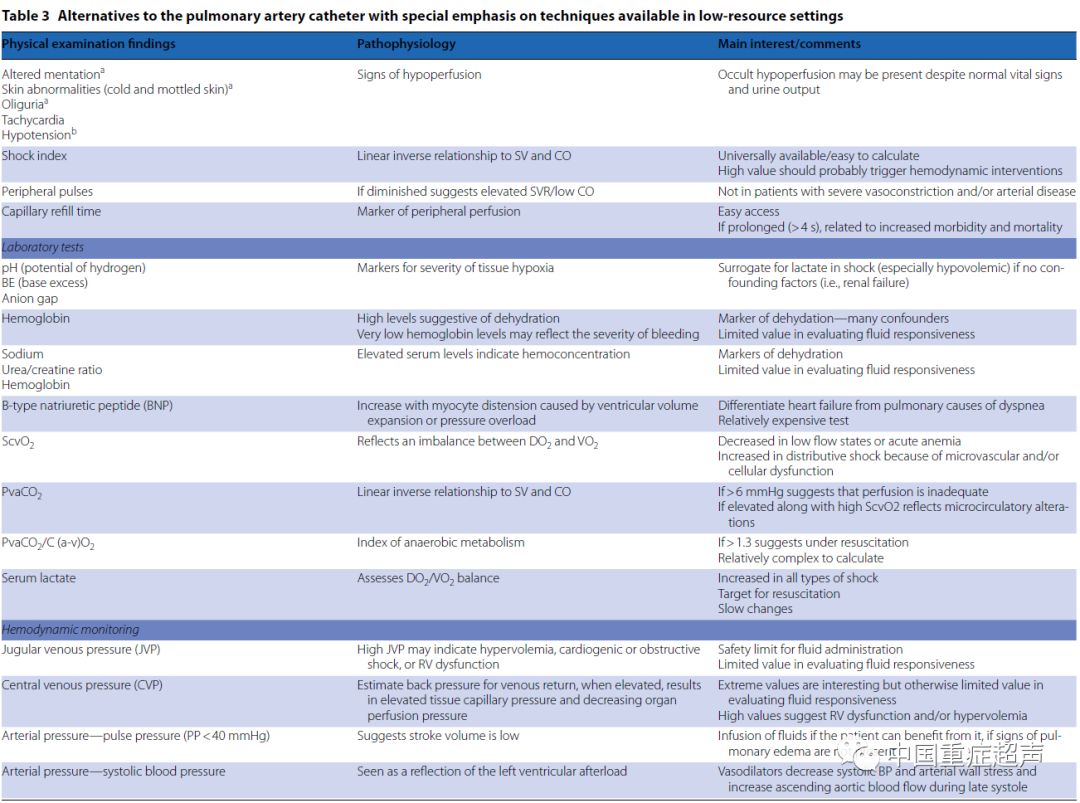
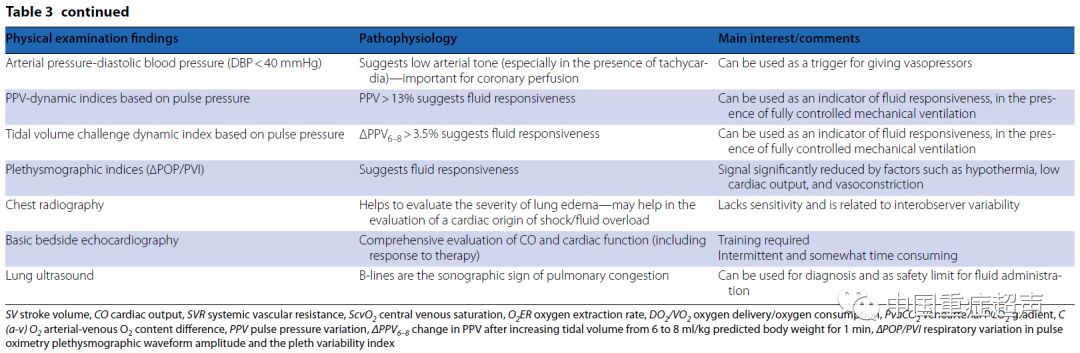
心脏超声和肺部超声的作用 心脏超声正越来越多地应用于重症患者。在脓毒症或充血性心力衰竭患者中,它比PAC更常用。心脏超声通常被认为是用于测量和监测一氧化碳的一种替代PAC的方法,但这是值得怀疑的。虽然PAC可以提供连续的心输出量测量,但心脏超声只能提供间歇性的测量。最近对文献的系统回顾表明,PAC和心脏超声在评价心输出量的过程中是不可互换的,从证据的角度来看,超声的研究在方法上是有限的。然而,这些分歧大多出现在旧的研究被纳入的时候,而新研究采用了更好的方法来确定CO找到了更好的协议。重要的是,CO趋势,在临床实践中比绝对CO值更重要的CO的趋势,是通过心脏超声准确检测到的。 对于测量心输出量,心脏超声比PAC有一些优势。首先,心脏超声的侵入性较低,即使是经食管的方法。第二,心脏超声可用于某些情况下,PAC是有限的,如巨大的三尖瓣反流或非常低的流量状态。第三,与PAC相比,心脏超声提供了一种对SV的一搏一搏的测量,它允许通过动态指标评估液体反应性。最后,更重要的是,心脏超声在ICU中除了CO提供了更多的信息。 重症监护心脏超声(CCE)的概念很好地反映了心脏超声在重症病人管理中的普遍应用。通过直接观察心脏功能,心脏超声在定义休克机制方面是独一无二的。与PAC相比,它提供了对左心和RV功能和瓣膜结构的直接评价。在有循环衰竭的患者中,建议在消除明显的低血容量后,通过CCE快速评估心脏功能。CCE最重要的优点之一是了解机械通气患者的心肺相互作用。通过评估右心功能,CCE提供了重要的血流动力学信息来指导血流动力学和呼吸治疗。在所有的潜在应用中,CCE还允许通过几个动态指标来评估液体的需求,最后,CCE是一种检测左心室舒张功能障碍的独特工具,它与脓毒症休克的脱机失败和死亡率密切相关。 心脏超声的一个最重要的局限性就是它的间歇性。连续型微型化的TEE已经被开发出来,但是这些技术只能提供有限的信息,除了流体的反应性和对心室的视觉评价,因为定量的多普勒评估是不可行的。因此,在这些设备上测量充盈压力、肺动脉压和心脏输出是不可行的。 在肺超声检查中也可使用超声探头。后者准确检测肺水肿、压缩、气胸或胸腔积液。重症超声被联合应用于在呼吸和循环衰竭中,如肺栓塞、肺水肿(心源性或非心源性)、脓毒症相关肺炎或脱机失败的情况下。 评估微循环 在重症患者中 通常观察到微小血管发生异常改变。这往往颇具灌注相关异质性的特点,即低氧区域与过度灌注区共存。它们的严重程度和持续时间与器官功能障碍和死亡率有关。其中可能牵涉到各种机制。 视频显微镜不能在任何情况下使用。他们需要技术技巧和耐心的合作;他们也很难适用于呼吸困难的病人。因此,我们需要其他方法来定期评估微循环改变。周围组织灌注不足的临床情况可能无法监测到在微血管中央灌注的改变。 微血管改变患者的血乳酸水平经常升高,但是乳酸动力学的缓慢变化使它成为微血管功能障碍的一个非常间接的标志。由于局部分流,SvO2并不能很好地反映微血管的改变。有趣的是,PvaCO2的增加是微血管灌注异常的一个很好的指标。特别是当SvO2值正常时,PvaCO2的变化反映了微血管灌注的变化而不是CO的变化。 一个重要的问题是一旦达到令人满意的系统血流动力学指标,微循环目标治疗是否优于经典的血流动力学监测。在这个阶段,解决这个问题似乎为时过早。虽然毫无疑问,对病理生理过程有更好的理解很需要,但主要的实际限制是我们缺乏专门针对微循环水平的治疗。早期的液体和多巴酚丁胺可能在一定程度上改善微循环,但它们的作用是相当不同的。血管扩张剂可能改善微血管灌注,但它们缺乏选择性,并且在已灌注区增加血流。内皮型一氧化氮合酶与各种药物(包括维生素C)的调制似乎是有希望的。因此,有必要了解各种治疗方法所发生的微循环变化,以便为未来制定复苏目标。 在资源有限的情况下 资源有限的情况下的特殊情况不仅包括发展中国家的部分地区,这些地区缺乏医疗资金导致有限的医疗资源获取,而且还包括在发达国家的医院内,如急诊科和病房的监测受限的地区。表3给出了这些区域的不同血流动力学资源。 急性循环衰竭可以通过3个临床窗口进行组织灌注评估:意识状态的改变,皮温低和皮肤花斑和少尿,并伴有心动过速和低血压。休克指数的计算(心率与收缩压的比值;正常范围,0.5 0.7)也可以有用。 心血管功能的评估要困难得多。当可用时,心脏超声和全身超声成为备选的技术。虽然需要提供医生的技能,但这些都能快速获得肺水肿的体积、心脏功能的评估。超声波评估相对便宜,但涉及一些初始支出。 在没有升高颈静脉压力的情况下,通过器官灌注的临床征象和乳酸水平的升高,可以做出输液的决定。当中心静脉导管到位时,CVP、ScvO2和PvaCO2值有助于监测生理过程和指导治疗。然而,如上所述,CVP有其局限性,而其他指标表明灌注不足,但不具备液体反应能力。 由于过度和不足的流体管理可能会恶化结果,所以在提供流体之前确定流体反应者是很重要的。在资源有限的地区,不适当的液体管理可能会造成更大的危害。在伴有感染性休克的非洲儿童中,液体会补充到出现不耐受的迹象,死亡率会大大增加。一些策略可以用来预测对液体的反应。PPV很好地预测了液体反应性,如果使用了动脉导管,则不需要特定的设备。这些可以通过大多数床边监视器自动计算出来。然而,在低的潮气量通气中,它是不可靠的,目前在所有危重病人中使用。潮气量挑战是一种新的测试,它可能有助于规避这一限制。这包括潮气量从6 ml/kg 瞬时增加到到8 ml/kg,1 min,观察PPV的变化( PPV6 8)。然而,信号质量严重依赖于周围的灌注。注意,SV变异和衍生变量也存在于急性肺心病中。可以使用被动抬腿实验,并且具有避免这些限制的优点,但是也有些麻烦。它需要评估心脏输出的变化与动脉脉压的变化有关,或者,更好的是,在气管插管患者中评估呼气末二氧化碳,或者尤其是在急诊部/病房中,通常有线性超声探头的情况下进行心脏超声或颈动脉/臂多普勒监测。最后,需要进行研究来评估、共识和远程医疗是否能够在有限资源环境中有效地改善结果。 总结 正如本文所描述的,PAC有很多替代方案,每个都有其有趣的特性和限制。与其依赖单一的技术,还不如将不同的技术结合起来,更重要的是,将干预措施应用于患者的情况,考虑到实际的血流动力学状态以及恶化和并存病的可能性。作为第一步,临床和生命体征应该用于识别受损组织灌注的患者。无论何时可用,重症心脏超声应作为它提供快速和全面的血流动力学评价。如果病人对治疗反应迅速,则不需要额外的监测或脉搏波分析(允许持续监测,以防潜在的损伤)。如果患者对治疗没有迅速反应,或观察到复杂的血流动力学改变,则建议使用脉冲波分析,当然要定期评估灌注的临床和生物学指标,如果需要的话,再进行心脏超声的评估。当大循环似乎在合理的目标和代谢指标仍然改变时,怀疑微血管改变似乎是合理的。虽然在这个阶段治疗选择仍然有限,但迹象表明进一步尝试增加CO可能是不必要的。 表3 资源有限情况下如何应用PAC以外手段获取血流动力学参数
原文链接: https://pan.baidu.com/s/1NTGcKg63beCiuVGj41ifEw 提取码:z2ou返回搜狐,查看更多 |
【本文地址】