| 配图详解 12 个 WB 翻车原因 | 您所在的位置:网站首页 › sds电泳marker弥散 › 配图详解 12 个 WB 翻车原因 |
配图详解 12 个 WB 翻车原因
|
经常做 western blot 的同学 通常会有一种错觉这哪里是搞科研 明明是搞「玄学」  十个 WB 七个歪八个丑九个坏 还有一个不出来 要么条带失踪  要么背景漆黑  要么杂带丛生  …… 有时就算凑齐天时地利人和 也不一定能得到一组完美条带 江湖传言:一个生物学博士,要跑满 1000 板胶才有可能毕业 WB 实验本身就难 还总是牵涉进 「造假」「撤稿」「学术不端」等丑闻 使得主流期刊对 WB 数据要求越来越高 要求作者提供相关原始数据 甚至要求提供未切割的 WB 全膜条带 对于出道 29 年的大博士而言 WB 的「玄」之操作 它早就积攒了一本厚厚的攻略 【PS:由于排版字数限制,以下分享部分精华】 收获这份攻略 高灵敏度,高信噪比,更低背景…… 让你的条带显露真身    跑胶是 WB 实验成败之母 提高跑胶质量的 Tips 蛋白分子量偏高或偏低 可能是胶的浓度与目的蛋白的浓度不对应,比如说 100KD 的蛋白你用 12% 的胶跑,或者说 20KD 的蛋白你用 8% 的胶跑。 蛋白质降解 蛋白质降解后很可能会在比原来位置低的地方出现主带,然后出现一些其他带,最主要的特点是所有的条带比正常的都低,并且条带模糊不清晰。 所有条带连成一片无间隔 最可能是上样量过多,其次是样品弥散(比如电泳长时间停止样品弥散)。 溴酚蓝拖尾 样品溶解不好或上样前未变性完全。 纵向的纹理 上样样品中存在不溶性颗粒。 溴酚蓝很粗 浓缩胶浓缩效果不好,可能是浓缩胶太短或者配错。 在分离胶中跑不动 Tris-Cl pH 值不对,或者忘记加 SDS。 BOSTER #1/无背景无条带 http://www.boster.com.cn  原因分析 如果 marker 正常,其他位置没有条带,最可能是一抗加成其他抗体,或者二抗种属加错了,比如兔的加成鼠的。 解决办法 a. 目的蛋白完全无信号,但同时做的内参是正常的,那么大部分情况是一抗抗体失效或用错二抗。 b. 目的蛋白和内参均无信号,则考虑是否发光液失效。如果膜上没有 marker 则为转膜失败。 c. 如果中间出现了细微条带,可能是蛋白上样量太少,或一抗浓度过低。 经验之谈 上图展示一点信号都没有,大部分情况是因为抗体加错了。如果中间出现细微的条带,可能是蛋白上样量太少,一抗浓度过低,ECL 发光液失效。 BOSTER #2/高背景 http://www.boster.com.cn  原因分析 封闭不充分,一抗浓度过高,洗膜时间次数不够。 解决办法 降低一抗浓度,增加洗膜时间和次数。 a.一抗/二抗浓度配比不合适:杂带多,大概率是抗体特异性不好,也有可能抗体浓度太高,可尝试降低一抗浓度进行实验。 b.封闭液问题:配制封闭液所用的脱脂奶粉应选用无防腐剂实验专用脱脂奶粉。 c.洗膜不充分:洗膜按规定来 5min*5 次或 10min*3 次。 经验之谈 高背景是 WB 实验中最常见的问题,目的条带单一清晰,但其他地方又弥漫性较均一的背景(比较连续的)。杂带多大概率是抗体特异性不好,也有可能抗体浓度太高,可尝试降低一抗浓度进行实验。 BOSTER #3/非特异性条带 http://www.boster.com.cn  原因分析 一抗非特异性与蛋白结合。 解决办法 更换一抗。 经验之谈 此种情况绝大多数是因为一抗不好,你无法判断哪一条是目的条带。如果实在没有更好的抗体,建议采用阴性对照和阳性对照来确定上述哪个条带是目的条带。当然也有一种很小几率的可能是一抗浓度太高引起的非特异性结合。 BOSTER #4/条带中出现边缘规则的白圈 http://www.boster.com.cn   原因分析 a.电转中膜与胶之间存在气泡。 b.可能是转膜过程烧膜了,特别是半干转操作不当导致烧膜。 c.转膜时温度过高产生气泡。 d.印迹膜活化不佳。 解决办法 a.注意排清气泡。 b.优化实验条件或使用湿转法转膜。 c.把整个转膜装置放于 -20 度冰箱中电转。 d.确保印迹膜完全活化。 经验之谈 我们常常将电转液倒入一个盘子里,倒入的液体不宜太多或太少,建议高度与放上第一层滤纸齐平,然后往滤纸上浇点转膜液,往胶上面浇点电转液,用两只手的拇指和食指轻轻夹住 NC 膜的两侧中间,使膜成 U 型,然后将 U 型底部接触胶的中间,慢慢往两边放下膜,这样一般气泡很少。然后上层滤纸同样用 U 型的放置方法,用玻璃棒稍微贴实下,最后盖上海绵。 BOSTER #5/出现黑点和黑斑 http://www.boster.com.cn  原因分析 a.一般出现这种情况可能是封闭液溶解不完全或封闭液存放时间太久(长菌)。 b.膜上其他部位与一抗或二抗非特异性结合。 解决办法 a.过滤封闭液或选用其他类型封闭液。 b.与其他品牌已验证过好用的抗体处理相同样本,作比较,看是否还有斑点。 经验之谈 牛奶溶解后,最好静止一下,然后轻轻吸取上层牛奶进行封闭,封闭结束后一定要洗 3 遍之后再加一抗。 BOSTER #6/条带拖尾 http://www.boster.com.cn 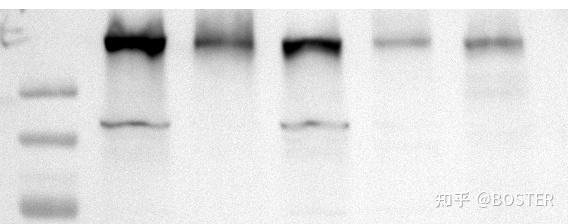 原因分析 一抗浓度太高和时间太长。 解决办法 根据情况调整一抗浓度,时间也可缩短。 经验之谈 这种情况一般出现在大分子量抗体实验中,是因为一抗浓度太高,作用时间太长引起的。另外洗一抗和洗二抗千万不要偷工减漏,建议 5min*5 次,不要担心洗这么多次把抗体和蛋白洗掉了,真正的抗原抗体相结合通过这种方式是洗不掉的。 BOSTER #7/出现非均一性背景 http://www.boster.com.cn  原因分析 膜可能在孵育或洗涤过程中干过。 解决办法 每一步的操作过程中,注意不要让膜干。 经验之谈 封闭时洗一抗洗二抗,以及发光时都应时刻注意切记蛋白面风干,一旦风干很可能会导致这个结果。 BOSTER #8/某个条带变形 http://www.boster.com.cn  原因分析 SDS-PAGE 胶中存在气泡或某不溶性颗粒。 解决办法 配胶过程中,要注意不要使用无杂质液体。 经验之谈 很多实验室中使用的不是最新设备,比如配胶用的海绵垫,如果用了很多年,会从下面往上面漏小气泡,当气泡足够小并且胶快凝固的时候,走到中间的小气泡就停留在胶内,并会影响到后面的跑胶。另外配胶用的水,SDS,Tris 缓冲液要注意不要有杂质。 BOSTER #9/条带不均一 http://www.boster.com.cn    原因分析 a.配置胶凝固不均一。 b.转膜问题:转膜夹子不紧,转膜滤纸或海绵由于使用消耗,滤纸及海绵变薄,海绵弹性不足。 c.一抗孵育问题:抗体孵育不充分或抗体稀释液放入过少。 解决办法 a.把胶配好,不合格的胶坚决不用。 b.及时更换转膜滤纸和海绵。 c.增大抗体稀释液用量、更换跷跷板类型的摇床将膜完全进入抗体稀释液中。 经验之谈 出现哑铃最大的可能是胶没有配好,胶凝固后不均一。如果你拔完梳子后出现上图中下面部分的情况,多半会出现哑铃状。另外还有一种可能是样品中含有太多杂质,没有离心下来,然后杂质沉积在孔的中间,蛋白自然被推挤到两边。 BOSTER #10/最边缘条带弯曲 http://www.boster.com.cn  原因分析 电泳电流不均一,玻璃板右下侧有缺口。 解决办法 换用新的玻璃板,不使用两边的两孔。 经验之谈 一般我们使用的是 10 孔的胶,如果你上样刚好 10 个孔,那么最两头的两个孔肯定会歪曲。另外上样最好在胶的中间,这样电场均一。 BOSTER #11/条带笑脸,marker正常 http://www.boster.com.cn  一般来说笑脸问题首先考虑电泳环节,多半是凝胶没凝固好。但上图 marker 却异常整齐,笑脸条带整齐地手拉手,这就不是凝胶问题导致的。 原因分析 a.loading buffer 失效,导致样品变性失败。 b.上样量过大或样品杂质多。 c.电压太高。 解决办法 a.更换 loading buffer。 b.超滤样品或降低上样量。 c.降低电压。 经验之谈 准备样本主要确认上样缓冲液是否为近期配置,并且要妥善保存,否则就会浪费珍贵的实验样本。一般电泳过程中恒压电泳,浓缩胶 80V,分离胶 120V,整个过程差不多需 2 个小时左右。 BOSTER #12/曝光结果条带扭曲 http://www.boster.com.cn  原因分析 转膜问题,对于分子量稍大的蛋白,转膜时间过长,转膜装置产热过多,无法维持转膜时的低温环境,造成条带扭曲。 解决办法 建议在条件允许的情况下直接在 4℃ 中进行转膜,将冰更换为冰水混合物,及时更换转膜液并将转膜液放入 4℃ 中提前预冷。 经验之谈 对于大分子量的抗体,跑胶前可以先把样本煮一下,然后稍微离心一下,同样也可以改善这种情况。 |
【本文地址】