| SDS | 您所在的位置:网站首页 › sds-page凝胶电泳图 › SDS |
SDS
|
分享按钮 一、原理
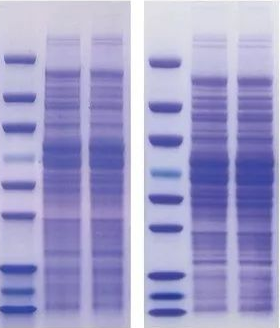
聚丙烯酰胺凝胶是由丙烯酰胺(Acrylamide简称Acr)和交联剂甲叉双丙烯酰胺(N,Nˊ-MethyleneBisacrylamide,简称Bis),在催化剂核黄素或过硫酸铵和四甲基乙二胺的催化下,聚和而成的具有三维网状结构的胶。 正常情况下蛋白的迁移率取决于它所带净电荷以及分子的大小和形状等因素。而在丙烯酰胺凝胶中加入阴离子去污剂十二烷基磺酸钠(SDS),则蛋白的迁移率主要取决于蛋白大小,与所带电荷与形状无关。因此可以利用SDS-PAGE对蛋白质分子量与纯度进行鉴定以及浓度的检测。
二、试剂 1、A溶液:1.5M Tris(三氨基甲烷),0.4%SDS,pH8.8。 2、B溶液:0.5M Tris.Cl,0.4%SDS,pH6.8。 3、5×ESB(加样缓冲液)。 4、染色液:0.25%的考马斯亮蓝R 250、40%的甲醇、10%的乙酸。 5、脱色液:40%的甲醇、10%的乙酸。 6、10×Laemmle-buffer(电极缓冲液):250mMTris、1920mM甘氨酸、1%SDS。 7、10%过硫酸铵(APS) 8、异丙醇 9、四甲基乙二胺(TEMED)
三、制胶 根据蛋白样品的大小制不同浓度的胶,蛋白分子量小就要制高浓度的胶,分子量大的蛋白就制低浓度的胶,制不同厚度的胶所需的浓缩胶和分离胶体积也不一样。 5%浓缩胶: 30%Acr-Bis 1ml、A溶液1.5ml、无菌水3.5 ml、APS 75ul、TEMED 10ul。 12.5%分离胶: 30%Acr-Bis 5 ml、B溶液3 ml、无菌水3.9 ml、APS 150ul、TEMED 10ul。
四、加样、电泳 过稍许时间等胶凝固后把蛋白marker和所需的鉴定的蛋白和标准品蛋白(如BSA)经处理后加到加样孔中,倒入电泳缓冲液接通电源开始跑胶。
五、染色、脱色 等示踪染料溴酚蓝跑至胶末端,关闭电源,去除浓缩胶后,将分离胶放入考马斯亮蓝染色液中染色40分钟,然后放入脱色液中脱色1小时,并换脱色液2-3次。
六、蛋白大小、纯度的鉴定及浓度的检测 根据Marker(或者蛋白标准品的相对迁移率制作的标准曲线)判断蛋白大小,根据有无杂带判定蛋白的纯度。根据BSA标准品条带的灰度制作标曲,并计算出目的蛋白的相应浓度。
七、注意事项 1、 SDS与蛋白质的结合按质量成比例(即:1.4gSDS/g蛋白质),如果比例不当,就不能得到准确的数据。 2、 用SDS-聚丙烯酰胺凝胶电泳法测定蛋白质相对分子量时,必须同时作标准曲线。不能利用这次的标准曲线作为下次用。 3、 有些蛋白质由亚基(如血红蛋白)或两条以上肽链(α-胰凝乳蛋白酶)组成的,它们在巯基乙醇和SDS的作用下解离成亚基或多条单肽链。因此,对于这一类蛋白质,SDS-聚丙烯酰胺凝胶电泳法测定的只是它们的亚基或是单条肽链的相对分子量。 4、 有的蛋白质(如:电荷异常或结构异常的蛋白质;带有较大辅基的蛋白质)不能采用该法测相对分子量。 5、 如果该电泳中出现拖尾、染色带的背景不清晰等现象,可能是SDS不纯引起。
八、节省时间小窍门 正常情况下胶跑完之后要染色脱色3-4个小时之后才能看到结果,如果我们把染色液加热一下染色这样就会加快染色,或者是把染色中考马斯亮蓝R 250加倍10-20分钟就可以。脱色的时候我们可以不用脱色液,直接在水中煮沸10分钟就能看到结果,如果不够清楚,可以换水再煮10分钟。
关注微信公众号:每日生物评论,精彩不容错过!  赞
2
赏
分享
发表评论
被查看13,921 次
A+
发布日期:2018年03月09日 所属分类:实验技术
标签:AcrSDSSDS-PAGE十二烷基磺酸钠聚丙烯酰胺凝胶
赞
2
赏
分享
发表评论
被查看13,921 次
A+
发布日期:2018年03月09日 所属分类:实验技术
标签:AcrSDSSDS-PAGE十二烷基磺酸钠聚丙烯酰胺凝胶
|
【本文地址】