| 【学术前沿】NAR | 您所在的位置:网站首页 › replication翻译 › 【学术前沿】NAR |
【学术前沿】NAR
|
单链DNA ( ssDNA )结合蛋白复合物RPA在促进DNA复制和多种DNA修复途径中起关键作用。然而,在这些过程中,RPA是如何被调控以精确地实现其功能的,目前还不清楚。 2023年5月4日,武汉大学陈学峰团队在Nucleic Acids Research 上在线发表题为“Proper RPA acetylation promotes accurate DNA replication and repair”的研究论文,该研究发现需要对RPA进行适当的乙酰化和去乙酰化修饰来调节RPA促进高保真DNA复制和修复的功能。研究人员发现酵母RPA在DNA损伤时被乙酰转移酶NuA4乙酰化在多个保守的赖氨酸上。模仿组成型RPA乙酰化或阻断其乙酰化会导致自发突变,其特征是微同源性介导的大片段缺失或插入。同时,不适当的RPA乙酰化/去乙酰化通过精确的基因转换或断裂诱导的复制损害DNA双链断裂( Double-strand break,DSB )修复,而通过单链退火或替代末端连接增加易错修复。 在机制上,该研究证明了RPA适当的乙酰化和去乙酰化可以保证其正常的核定位和ssDNA结合能力。重要的是,人RPA1中等效残基的突变也会损害RPA与ssDNA的结合,导致RAD51装载和同源重组修复的减弱。因此,及时的RPA乙酰化和去乙酰化很可能代表一种保守的机制,促进高保真复制和修复,同时区分真核生物中容易出错的修复机制。  DNA复制和修复过程中错误的积累会导致基因组不稳定和癌症。事实上,癌细胞往往具有复杂的基因组重排和突变特征,这是因为不同的DNA修复或复制蛋白存在缺陷。因此,抑制突变和低保真修复对于避免癌症和其他疾病至关重要。 单链DNA ( ssDNA )是DNA代谢过程中形成的最普遍和最重要的生物中间体之一。然而,暴露的ssDNA会形成二级结构,阻碍正常的DNA交易。此外,ssDNA可被核酸酶攻击。因此,暴露的ssDNA对基因组稳定性构成潜在威胁。复制蛋白A ( Replication Protein A,RPA )是真核生物中主要的ssDNA结合蛋白复合物,与ssDNA的亲和力非常高,被认为是ssDNA的第一反应者。 RPA保护ssDNA免受非程序性核酸酶的消化,融化二级结构,感应ssDNA以激发检查点信号。它也是招募参与不同DNA交易的因子的关键支架。它也是招募参与不同DNA交易的因子的关键支架。因此,RPA对于基本的核过程至关重要,包括转录、复制、修复、重组和染色体分离。而RPA是一种必需蛋白,其功能异常可引起基因突变、基因组不稳定和染色体突变,与癌变密切相关。 RPA是由三个亚基( Rfa1、Rfa2、Rfa3)组成的异聚体复合物。RPA共有6个寡核苷酸/寡糖结合基序( OB ),其中Rfa1亚基( OB - A、OB - B、OB - C、OB - F)有4个,Rfa2 ( OB-D )和Rfa3 ( OB-E ) 各有1个。其中4个结构域主要协调ssDNA相互作用,被称为DNA结合结构域( DBDs ; DBD-A , B , C , D)。这些基序介导RPA与ssDNA或蛋白的动态结合。RPA可以以不同的方式结合短( 8 ~ 10 nt)或长( 28 ~ 30nt ) ssDNA,并在结合的DNA配体上扩散。RPA的细胞功能依赖于其高ssDNA结合亲和力和与不同蛋白质相互作用的能力。虽然RPA对ssDNA有很高的亲和力,但最近的研究提示RPA与ss DNA的结合需要额外的调控。 RPA在DNA复制和修复中起着不可或缺的作用。在DNA复制过程中,RPA对于复制起始和延伸都是必需的。此外,RPA有利于聚合酶装载和复制偶联的核小体组装。RPA对于同源重组( HR )也至关重要,同源重组是修复DNA双链断裂( DSB )或重新启动停滞或折叠的复制叉的重要机制。在HR修复过程中,DSB末端的5′- ss DNA被切除机器选择性降解,生成3′- ss DNA。 RPA迅速包被暴露的3′-ss DNA并激发信号,激活DNA损伤检查点。重组酶Rad51随后取代RPA形成Rad51 - ss DNA突触前纤维。Rad51 - ssDNA细丝驱动同源序列处3′-链的入侵形成D - loop结构,随后修复DNA合成并解析重组中间体。一个长期存在的问题是,RPA如何被精确调控以保证高保真复制和修复。 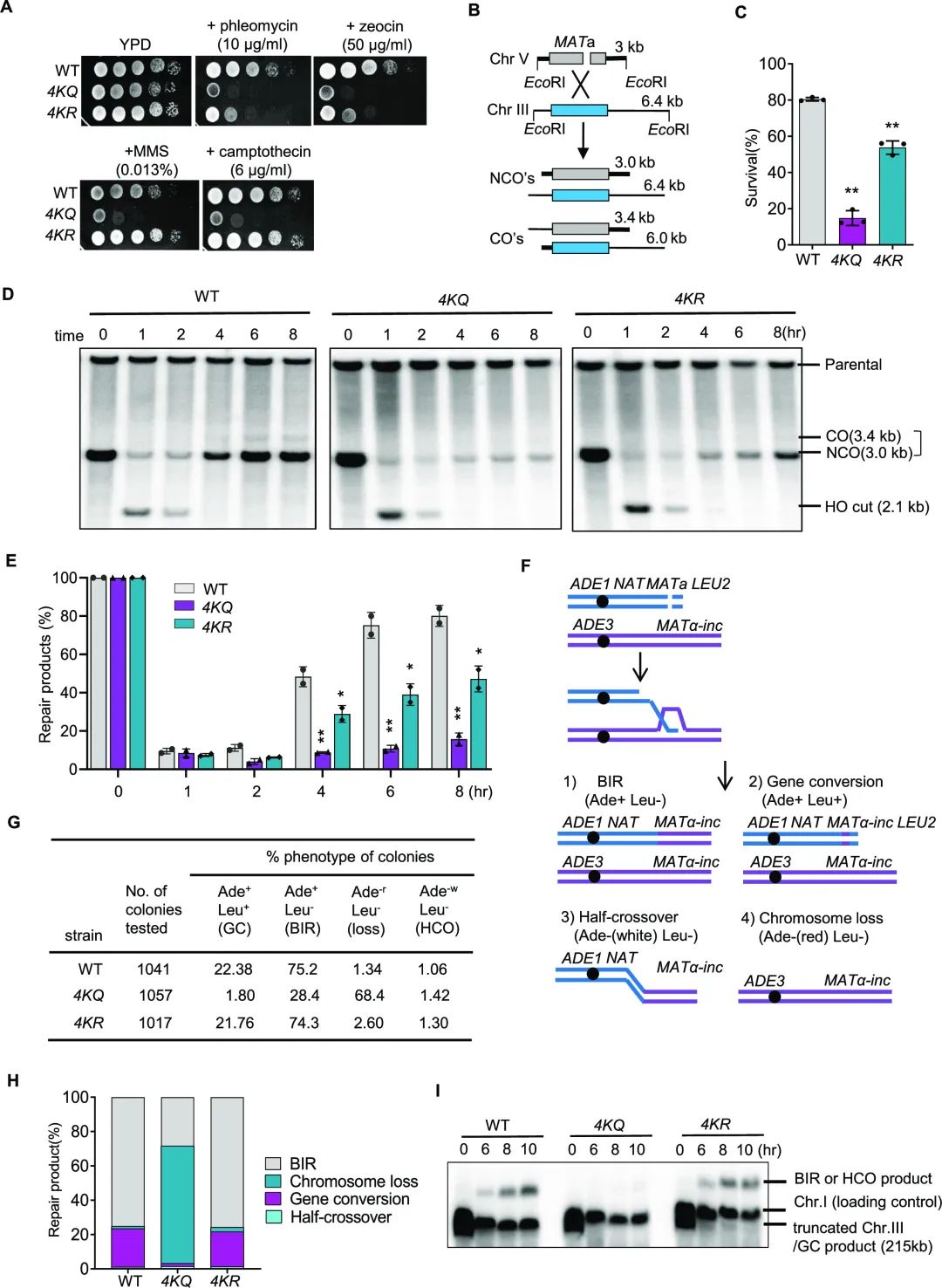 适当的RPA乙酰化和去乙酰化通过基因转换或BIR促进DSB修复(图源自Nucleic Acids Research ) RPA的翻译后修饰在维持基因组完整性方面发挥重要作用。例如,RPA的磷酸化或SUMO化修饰调节DNA复制、损伤反应、HR修复、检查点信号以及RPA与其伴侣的相互作用。同时,E3连接酶RFWD3对RPA的泛素化修饰促进了失速叉或链间交联位点的HR修复,可能是通过促进RPA和RAD51从病变部位的降解或清除。最近的研究表明,在DNA损伤时,RPA在酵母和人类中都被乙酰化。 在酵母中,据报道,Rfa1的赖氨酸K259、K427、K463和K494上的乙酰转移酶Nu A4响应MMS处理而乙酰化RPA。这种乙酰化似乎减弱了RPA与ss DNA的结合,是DNA损伤反应所必需的。同时,人RPA1在K163上被乙酰转移酶GCN5和PCAF乙酰化,这种乙酰化促进了UV诱导的DNA损伤的核苷酸切除修复。然而,RPA乙酰化是否影响最有害的DNA损伤DSBs的修复还有待确定。 基于此,该研究探讨了RPA乙酰化和去乙酰化对自发突变和DSB修复的影响。研究人员发现RPA适当的乙酰化和去乙酰化可以促进高保真DNA复制和重组,同时抑制突变和低保真修复途径。此外,这种调节在人类细胞中发挥着类似的作用。因此,该研究揭示了真核细胞确保复制或修复保真性的保守机制,扩展了对RPA翻译后修饰作用的理解。 参考信息: https://doi.org/10.1093/nar/gkad291 原标题:《【学术前沿】NAR | 武汉大学陈学峰团队发现适当的RPA乙酰化促进精确的DNA复制和修复》 阅读原文 |
【本文地址】