| 国内甲状腺癌BRAF阳性率过高难以指导预后分层?多基因检测来解围 | 您所在的位置:网站首页 › rad54l基因突变阳性 › 国内甲状腺癌BRAF阳性率过高难以指导预后分层?多基因检测来解围 |
国内甲状腺癌BRAF阳性率过高难以指导预后分层?多基因检测来解围
|
以往认为BRAFV600E是预测 PTC 不良预后的重要辅助手段,而随着研究的不断增多,关于仅凭BRAF单一突变是否可以代表一个可靠的预后标志物备受争议,从近年发布的指南和共识来看,单纯依靠BRAF突变指导患者预后的临床地位已下滑。2019年发布的关于甲状腺微小乳头状癌巴西专家意见书中指出,RAS突变或其他RAS样突变或BRAF V600E或其他BRAF V600E样突变不应影响临床管理。然而,一些少见的低风险甲状腺微小乳头状癌(mPTC)患者携带高风险突变,如 TERT 启动子突变或 p53突变,则不适合主动监测。2020年美国内分泌外科协会(AAES)发布的指南提到BRAF V600E已被广泛研究与更具侵袭性的 PTC 亚型相关,BRAF V600E 突变肿瘤也与复发有关,即使在 PTMC 中也是如此。当 PTC 为单发且大小为 1 -4 cm 时, BRAF V600E突变患者复发的可能性更大(9.5%vs3.4%)。然而,并非所有BRAF V600E 突变PTC 都与侵袭性疾病有关。总体而言,当组织学特征可用于细化风险分层时,BRAF V600E的预后价值的有限。另外提到BRAF K601E突变肿瘤在临床上表现为惰性,不应与BRAF V600E 混淆。
2020年的发布的《甲状腺癌基因检测与临床应用广东专家共识(2020版)》提到BRAF 和 TERT 启动子双突变在 PTC 发生率为 7.7%,双突变协同效应预测甲状腺癌的恶性程度高,与单基因BRAF或TERT突变相比,经过15年随访, 双基因突变肿瘤复发率明显升高、预后不良、死亡率高。专家组意见为腺叶切除及患侧中央区淋巴结清扫是DTC 的基本治疗术式。是否需要扩大手术范围,可结合基因变异(如BRAF/RAS 合并TERT、 PIK3CA、TP53 等)判断肿瘤复发危险度。在2022年卫健委发布《甲状腺癌诊疗指南(2022年版)》将BRAF V600E 突变阳性的甲状腺腺内乳头状癌(直径1~4cm)、BRAF V600E 突变阳性的多灶的甲状腺微小癌合并腺外浸润归为中风险分层,在高风险分层中并未提及。
为什么随着近年研究的不断深入,单基因BRAF V600E检测识别高危PTC患者的临床意义越发有限呢?尤其对于亚洲的 PTC 患者。除了不同研究之间患者的选择、组织学类型、检测的方法(不同方法学灵敏度不同)等差别,还有一个主要原因是2017年以前很多BRAF的预后预测数据是西方PTC患者队列研究得出来的,西方PTC的BRAF V600E突变频率较低(35-50%),来自亚洲的大多数数据却报道了相当高的BRAF V600E突变频率(50-90%),而预后不良的患者仅占15-20%,表明许多低风险 PTC 也携带该突变,因此简单从数据上来看就发现亚洲DTC患者如此高频的BRAF突变率失去了临床筛选高危患者的指导意义。因此大量的临床研究结果强调了BRAF突变联合其他多基因检测结果综合评估指导复发风险的意义。 BRAF+TERT突变TERT 启动子 (TERTp) 的两个突变(C228T和 C250T)在PTC 中的突变率约为10%。2020年发表的这项荟萃分析[1]评估 BRAF V600E 和 TERTp 突变对 PTC 患者的预后价值。研究者共分析纳入 4184 名 PTC 患者的 12 项研究,总共有 2412(57. 6%)的患者携带 BRAF V600E 或 TERTp 突变,290(6.9%)名患者同时携带两种突变。TERTp 突变在 BRAF V600E 突变患者中更为常见(RR=1.75 [1.93-4.35] )。与携带单一突变的患者相比,携带两种突变的患者预后更差(与仅 BRAF V600E 相比:RR = 5.34 [4.20-6.78] 与仅 TERTp相比:RR = 2.12 [1.41-3.19])。BRAF V600E 突变的 PTC 患者更有可能携带TERTp 突变。TERTp突变是PTC患者预后不良的独立预测因素(RR = 2.90 [1.93-4.35]),然而与 TERTp 突变相比,BRAFV600E 突变的预后作用相对有限(图7)。由于亚洲人群的某些特定特征,仅发现 BRAF V600E 突变对肿瘤复发的预测价值在亚洲以外人群中具有统计学意义。因此应该全面评估分子检测结果,而不是关注单个突变。基于分子的PTC风险分层总结为 BRAF + TERT+ > BRAF - TERT+ > BRAF + TERT-。
2015 年 ATA 指南扩大了甲状腺腺叶切除术(LT)的适应症,基于证据表明LT可为T1 或 T2N0M0 分期患者提供良好的长期预后,并且与 LT 相比,甲状腺全切除术(TT) 与诸如甲状旁腺功能减退、喉返神经麻痹等并发症的风险显著增加有关。此外,所有接受 TT 的患者都需要终生甲状腺激素替代治疗。自该指南发布后,低风险患者中接受甲状腺腺叶切除术的比例显著增加。然而,即使低风险患者也会出现肿瘤复发和疾病特异性死亡,因此需要筛选合适的生物标记物预测 PTC 的预后并确定初始治疗方式。2020年日本医科大学附属医院报道了一项研究[2],纳入连续685例接受原发性甲状腺手术的PTC 患者,初次手术后的平均随访时间为 10 ± 3 年。基因检测结果显示538 名 (78.5%) 携带BRAF V600E突变,133 名 (19.4%) 携带TERT启动子突变。大多数(126/133)携带TERT启动子突变的患者同时携带BRAF突变,只有 7 名患者仅携带TERT突变。因此,与该人群中的TERT突变相比, BRAF V600E突变并不是与疾病特异性生存率 (CSS) 和无病生存率 (DFS) 相关的更好指标。研究者仅分析TERT启动子突变来评估甲状腺切除范围与 1-4 cm 甲状腺内 PTC 患者预后之间的关系。具有TERT突变的患者比没有突变的患者表现出明显更差的临床结局(10年CSS:73.7% vs 98.1%,p < 0.001;10 年DFS:53.7% vs 93.3%, p < 0.001)。接受腺LT的患者与接受TT的患者相比,10年CSS和10年DFS无显著差异,而TERT未突变的PTC 患者(直径1-4 cm)可从LT获得良好的预后。避免对这部分患者进行 TT 表明可能防止过度治疗和减少术后并发症。
2021年《临床癌症研究》上发表了一项研究[3]回顾了225名BRAF V600E突变型 PTC 患者的临床病理数据,并将其与来自肿瘤样本的NGS数据相结合分析。结果在 16% 的肿瘤样本中发现了额外的致癌基因变异。BRAF+“其他突变”组的患者更有可能处于美国甲状腺协会(ATA)划分的高复发风险组中(48.6%vs17.6%;P=0.0009),其有更大的基线肿瘤负荷(2.7 vs 1.9 厘米;P = 0.0005)和更高的疾病分期阶段(14.3% vs 1.1% 4期;P < 0.0001)。重要的是,在 65 个月的随访中,仅BRAF突变组与BRAF +其他突变组相比更有可能经历疾病特异性进展,并且疾病特异性死亡(DSM)的风险增加(BRAF+其他突变组为13.8%,而仅BRAF突变组为 1.4%;P= 0.005)。另外还确定了在 PI3K/AKT/mTOR 通路中存在关键致癌突变的患者亚群,这些突变患者与 DSM 独立相关(OR = 47.9;P = 0.0043),与疾病分期无关。该研究表明识别BRAF V600E突变 PTC患者携带的其他 PIK3/AKT/mTOR 通路相关变异可预测更具侵袭性的临床病理特征,并可能确定获益靶向治疗的候选者。这些数据支持对PTC 患者进行更广泛的基因分析,可获得重要且可干预的预后风险分层意义,以指导临床治疗策略。
2022年中国医学科学院北京协和医院发表了一项多中心研究,回顾性分析了 2018 年 5 月至 2020 年 12 月期间从国内14 家医院收集的先前未经治疗的395名 PTC 患者的数据。高危病理特征定义为 T3/T4、N(+) 和 N1b(+) 。通过NGS分析显示有78.5% 的患者(n=310/395)存在BRAF突变,且均为BRAF V600E突变。与来自TCGA数据进行比较发现本研究中BRAF突变的发生率显著高于美国 PTC 人群 (59.7%, p |
【本文地址】
 图3、2019年发布的关于甲状腺微小乳头状癌巴西专家意见书
图3、2019年发布的关于甲状腺微小乳头状癌巴西专家意见书 图4、《2020 AAES指南:成人甲状腺疾病的明确手术治疗》
图4、《2020 AAES指南:成人甲状腺疾病的明确手术治疗》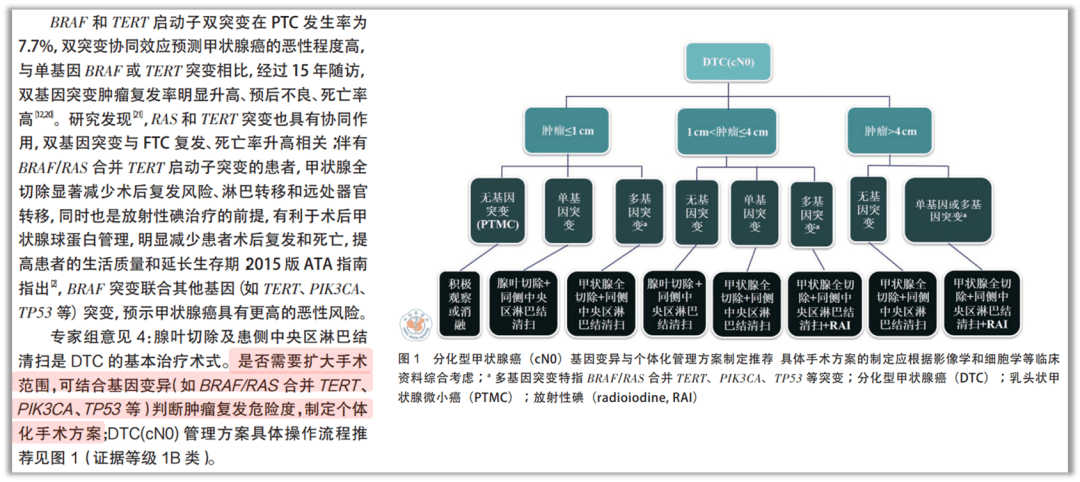 图5、《甲状腺癌基因检测与临床应用广东专家共识(2020版)》
图5、《甲状腺癌基因检测与临床应用广东专家共识(2020版)》 图6、2022年卫健委发布《甲状腺癌诊疗指南(2022年版)》
图6、2022年卫健委发布《甲状腺癌诊疗指南(2022年版)》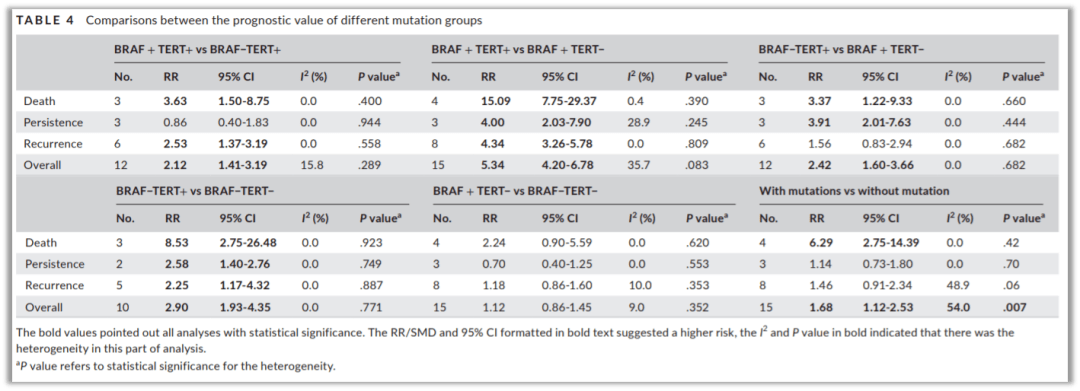 图7
图7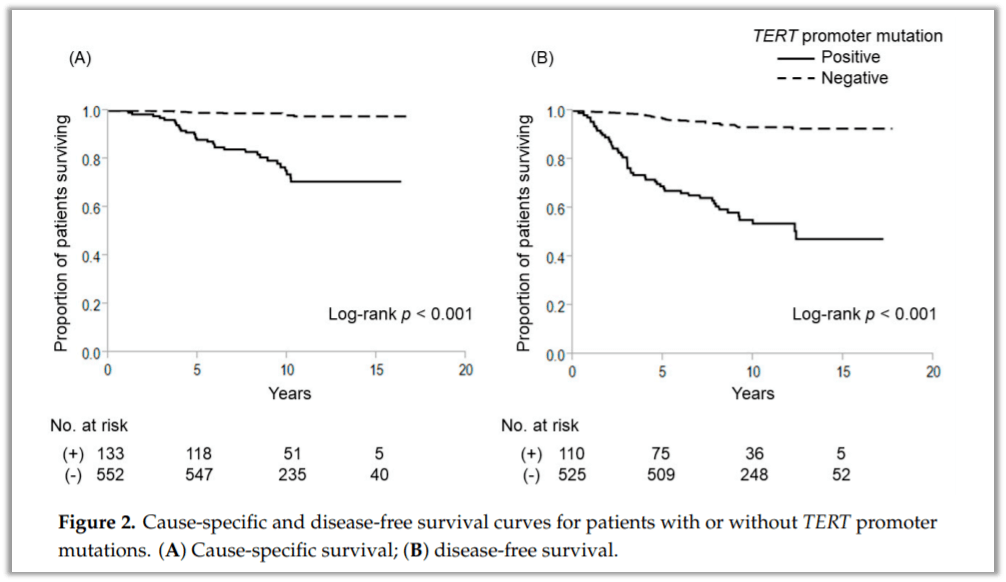 图8、携带或不携带TERT启动子突变的患者的疾病特异性和无病生存曲线
图8、携带或不携带TERT启动子突变的患者的疾病特异性和无病生存曲线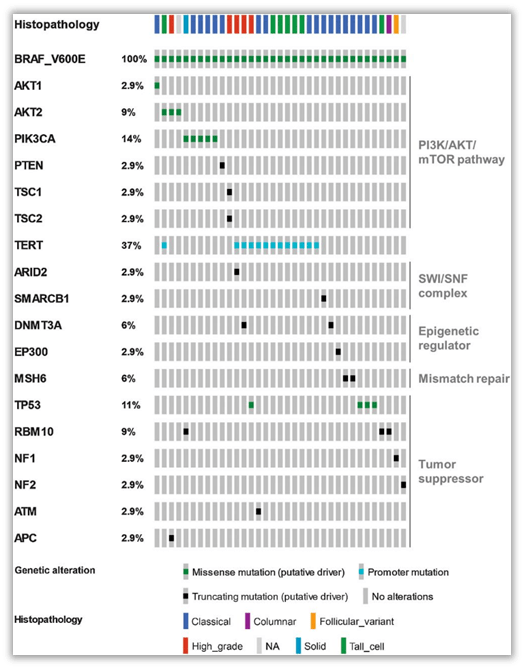 图9、BRAF + “其他突变”队列 ( n = 35) 中致癌基因变异的分布
图9、BRAF + “其他突变”队列 ( n = 35) 中致癌基因变异的分布