| 2022年7月8日:药品研发领域IND、Pre | 您所在的位置:网站首页 › pre-service是什么意思 › 2022年7月8日:药品研发领域IND、Pre |
2022年7月8日:药品研发领域IND、Pre
|
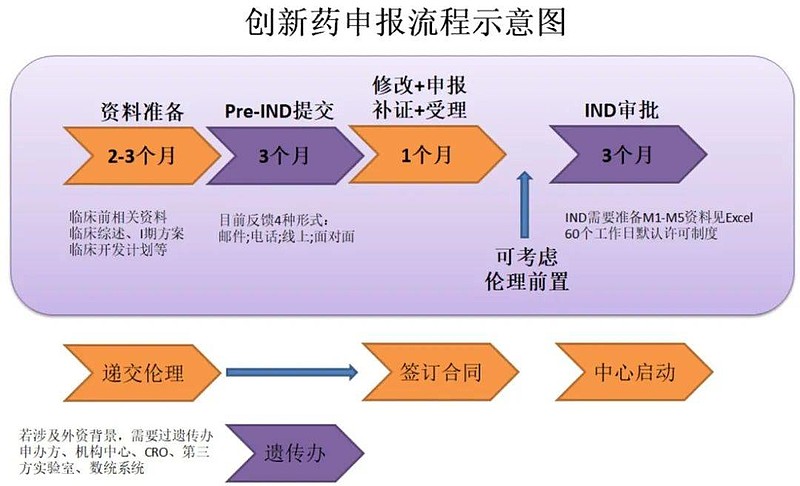
来源:雪球App,作者: 铁树开花终有时,(https://xueqiu.com/5748188627/224802949) 2022年7月8日:药品研发领域IND、Pre-NDA、NDA、ANDA是什么含义 一个创新药物从发现到最终的上市,其中要经历新化学NCE的发现、临床前研究、新药临床试验申报(Investigational New Drug,IND)、临床研究、NDA申请(New Drug Application)到最后上市以及上市后开发公司仍需对产品进行IV期临床研究和上市后监测等等过程,其中的每一步都有可能会导致药物研发失败。 一、IND IND是Investigational New Drug 的缩写,是指新药临床研究审批,新药的产生需要进行两次行政审批,一是在临床研究阶段(IND申报),二是临床研究完成注册上市(NDA申报)。临床研究是指药物经过动物试验后,在人体上进行试验,分为Ⅰ期、Ⅱ期、Ⅲ期临床试验,每一期临床试验都有不同的试验目的,其中Ⅲ期临床试验人数最多,也是最关键的。 二、NDA NDA是New Drug Application 的缩写,是指新药经过临床试验后,申报注册上市的阶段。创新药物的产生需要经历五个阶段,分别是:制备化合物阶段、临床前研究、临床研究、上市注册、新药监测。在临床研究后,药品上市前还有临门一脚,就是按照要求准备材料,进行注册上市申报(NDA申报)。经过NDA申报,药品获得批准后才能上市销售。 以上就是新药(创新药)产生必须进行的两项行政审批,不但创新药上市需要审批,仿制药的上市批准也需要审批,但仿制药的申报过程要简单得多。 三、ANDA ANDA是Abbreviated New Drug Application的缩写,即仿制药NDA申报。仿制药是对创新药的复制,仿制药也要进行NDA申报,但仿制药不需要进行临床试验,只需要证明其质量和疗效与原研药一致就行,所以他的NDA申报要简单地多,即ANDA中的Abbreviated就是简短的、简要的含义。 以上便是FDA新药申报程序的相关介绍,简言之,IND申报就是向当局申报要进行临床试验;NDA申报是向当局申报药品注册上市;而ANDA申报则是指仿制药注册上市的申报。在实务当中,经常用到相关的缩写,比如IND药物,即临床研究阶段的药物;NDA数量,即正在申报上市的药物数量。 四、Pre-NDA Pre-NDA会议让NDA申请人有机会向FDA审评团队充分展示他们的NDA是完整并且有条理的,已为FDA审评做好了充分准备。另外,它还使申请人有机会让FDA审评员提前熟悉拟申请适应症以及支持该适应症的所有研究、分析、数据展示和结果。不仅如此,申请人能够通过Pre-NDA会议提前收到FDA对NDA申报资料格式与内容等相关问题的反馈,从而进一步优化和完善递交的NDA申请。通过提前解决FDA关注的问题,可以节省大量审评时间和资源,并且能在最大程度上避免FDA在审评期间提出过多问题以及申请人对这些问题的回复和资料增补。申请人在递交NDA之前,如果未能与FDA进行Pre-NDA会议,可能会导致在申请审评期间出现不必要的延误,并可能错失在第一个审评周期(First Cycle Review)后的批准。 五、创新药申报流程图
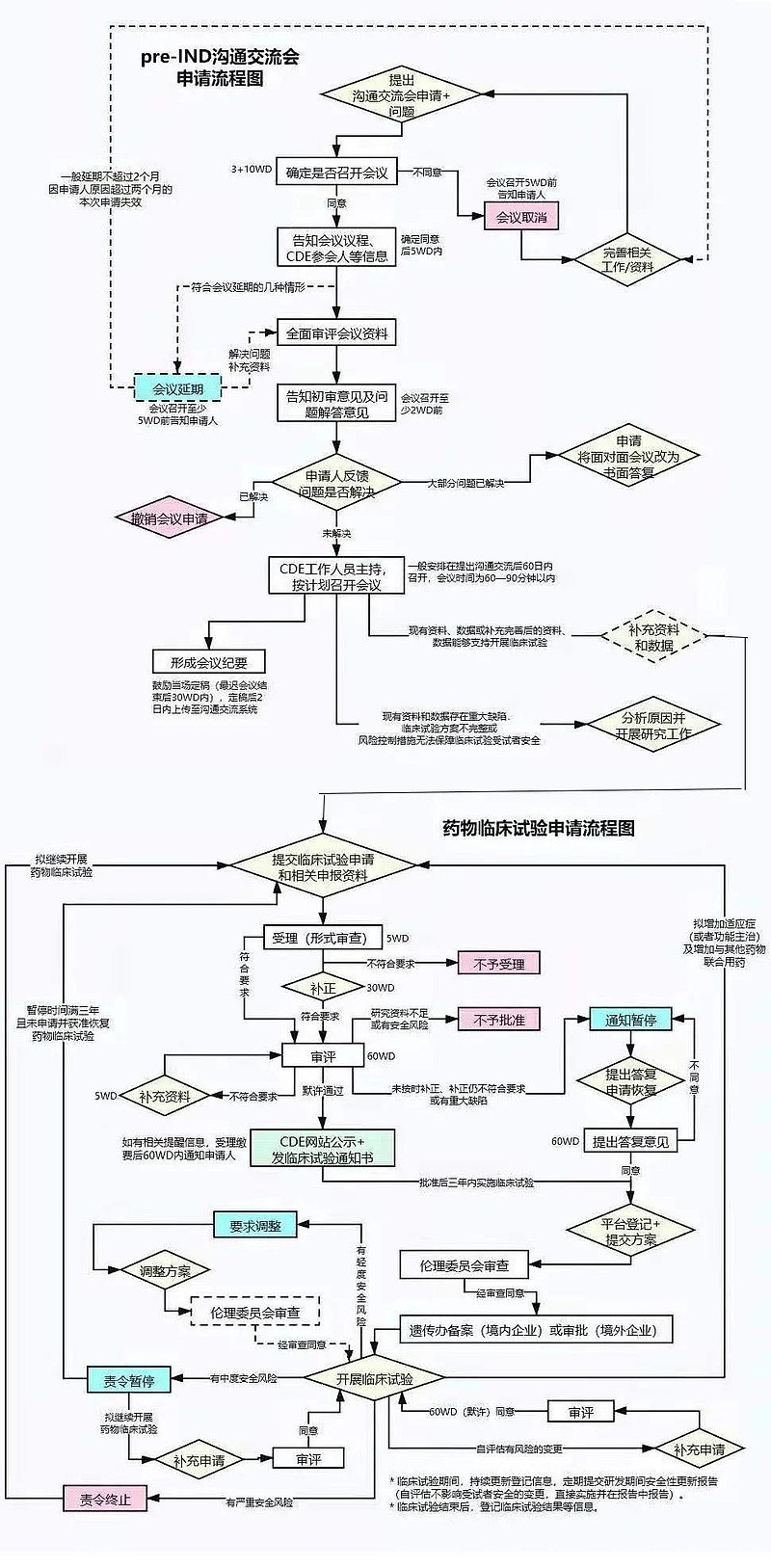
(一)新药临床试验(IND)的申报流程。药物开发从药物发现和筛选开始,企业需开展一系列的合成工艺、制剂工艺、质量研究等等前期工作,且还需开展一系列动物毒理、药效和(或)药代动力学研究,得到药物安全性方面的初步证明后,方可申请临床试验。
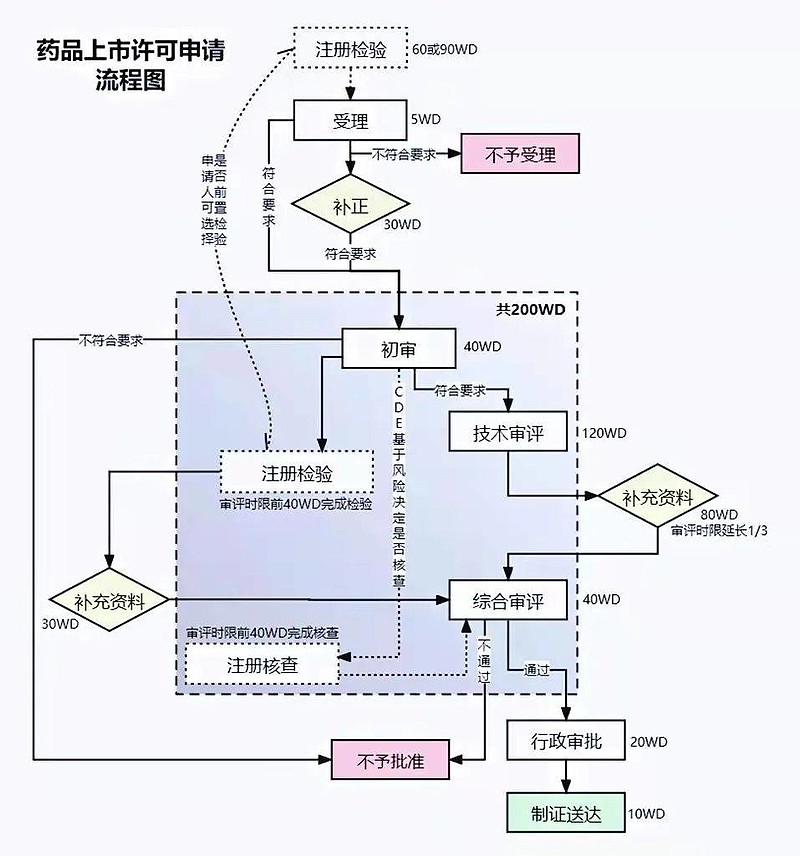
(二)Pre-IND会议。向FDA申报IND,首先,企业需要有在美办事处或者寻求合适的美国代理人,负责与FDA的沟通联络。 FDA建立了多种有效的和企业的沟通机制,比如各种与企业的正式会议,如Pre-IND会议、二期临床结束后会议、NDA/BLA递交前会议等等。通过会议,企业可以获取更多FDA对于药物开发方面的建议、清楚FDA的要求,减少走弯路、走错路的可能性,提高申报成功率。顾名思义,在申报IND之前企业与FDA的会议,即称为Pre-IND会议。 为此,企业需要准备一个Pre-IND package,预先告知FDA药物的基本信息、研究现状、初步的研究计划等等,通常包括CMC、临床前药理毒理、临床试验方案大纲、已有人体临床经验(如有)的综述资料,而最重要的内容当数企业拟在Pre-IND会议上与FDA讨论的问题。准备问什么样的问题可以说是整个Pre-IND阶段最重要的一项工作。 一般说来,企业需在计划和FDA开会前60天左右,向FDA提出会议申请。FDA在收到会议申请后,一般在14天内作出会议安排。之后,企业向FDA递交Pre-IND简报文件(一般在会议前4周左右递交)。FDA通常会回复对拟讨论问题的初步意见,企业可以了解到FDA对问题的初步看法。通常企业只有一次与FDA开Pre-IND会议的机会,其重要性不容小觑。 在Pre-IND会议结束后数个工作日,FDA会提供正式的Pre-IND会议纪要,记录FDA和申报者对于问题的意见和讨论结果。申报者也可以在会后提供自己的会议记录给FDA,表达自己对讨论情况的理解,避免双方理解上的误差。 (三) IND申报文件包。根据Pre-IND会议与FDA的讨论结果,申报者进行IND申报文件包的编写。 IND申报文件包主要包括9部分的内容:①首页函、FDA 1571表;②目录;③引言和总体研究计划;④研究员手册;⑤临床研究方案;⑥化学、生产和质量控制信息;⑦药理和毒理信息;⑧已有人体临床经验;⑨额外信息;需要注意的是,在IND申报文件包中,还需提交相关原始完整研究报告,如毒理研究报告等。 (四)IND审评。审评工作从FDA收到IND申报文件包开始计时,FDA需在30天内完成审评。在审评后期,FDA可能会和申报者就某些问题开展讨论。审评结果一般包括三种情况:允许开始临床;部分临床限制以及临床限制。 IND申报的流程比较复杂,在整个的IND过程中每一步都存在着失败的可能。有报道称IND总体失败率超过了90%。导致药物研发申报失败的前3位因素分别是药代动力学、临床有效性和毒性研究。 (五)药品上市后许可申请。
特别说明:以上内容来自网络。 |
【本文地址】