| 一种丹参酮IIAPEG‑PLGA‑PEG纳米粒及其制备方法与流程 | 您所在的位置:网站首页 › plga纳米粒制备方法 › 一种丹参酮IIAPEG‑PLGA‑PEG纳米粒及其制备方法与流程 |
一种丹参酮IIAPEG‑PLGA‑PEG纳米粒及其制备方法与流程
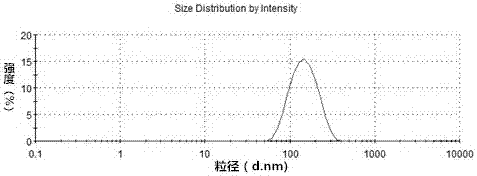 本发明涉及医药技术领域,涉及一种包载丹参酮iiapeg-plga-peg纳米粒的制备方法及用途。 背景技术: 丹参酮iia(tanshinoneiia)为二萜醌类化合物,是临床常用活血化瘀中药丹参的主要有效成分之一,属于脂溶性的药物,易溶于有机溶剂,是一种天然的抗氧化药物。丹参酮iia具有广泛的药理作用,丹参酮iia可以通过保护血管内皮细胞、降低体内过氧化脂质、免疫调节等多种方式,起到改善动脉粥样硬化的作用。临床研究发现,丹参酮iia还具有抑制心肌细胞凋亡作用,在治疗心血管疾病的发展中起关键的作用;丹参酮iia不仅在治疗心血管疾病方面有广泛的应用,对于缺血缺氧引起的大脑中枢神经系统损伤也有显著的治疗效果。药理学实验已经证明,丹参酮iia的抗炎、抑制细胞凋亡、抗氧化及清除氧自由基的作用,可以用来治疗脑缺血等疾病并且效果非常明显。 虽然丹参酮iia在治疗很多脑部疾病方面有广泛的药理活性,但是在药物研发上还有许多问题没有得到解决,比如丹参酮iia难溶于水,制成水溶性制剂存在困难,且血液循环半衰期短、生物利用度低、跨越血脑屏障的渗透性差等,因此限制了丹参酮iia在临床的应用。目前,主要是通过磺酸化反应对丹参酮iia进行结构修饰,转化为水溶性的丹参酮iia磺酸钠注射液,但是由于丹参酮iia磺酸钠在血液中半衰期短,快相和慢相分别为26min及108min,因此必须用较大剂量(160mg/250ml/日)进行静脉滴注【邵鹤生,景锡南,殷兰琴,顾建峰,赵敏敏。丹参酮iia磺酸钠在大鼠体内的分布排泄和代谢的研究,《中成药研究》1979,2:8-12】。此外,磺酸钠盐为离子型化合物,较难通过以脂质及蛋白质成分为基础的生物膜结构系统,使得丹参酮iia的利用率不高,大幅度降低了丹参酮iia的治疗效果,而且反复给药对正常器官组织的副作用较大。 随着纳米技术的快速发展,直径小于100nm纳米材料的在生物医学领域得到了广泛的应用,尤其是在医学成像、疾病诊断、药物靶向递送、癌症精准治疗、基因转染等领域。脑血管疾病的治疗,由于血脑屏障的阻碍,大约有98%的亲水性小分子和绝大多数大分子都不能通过,使药物分子难以达到病灶处,限制了对脑血管疾病的临床疗效。而纳米药物载体由于优良的生物相容性、可修饰性等特性,成为脑靶向递药系统研究的热点之一。研究发现,采用纳米载药系统负载化学治疗药物、多肽、蛋白质药物,能实现缓释、控释和靶向给药的目的,使得这类药物不会在很短的时间内被降解和清除,从而减少注射给药频率,提高患者的顺应性同时,经过特异性靶向配体修饰后,可携载药物分子透过血脑屏障,显著提高药物在脑组织病变部位的有效浓度,达到精准治疗脑部疾病的目的。降低其它非病变部位的药物浓度,减少对机体的毒副作用。 聚乳酸-羟基乙酸共聚物(poly(lactic-co-glycolicacid),plga)是由乳酸(lacticacid,la)和羟基乙酸(glycolicacid,ga)按照不同比例聚合而成的一种功能性高分子有机材料,已经通过美国的食品药品监督管理局(fda)认证。目前,已被广泛用于制备人工导管,药物缓释载体(微球、纳米粒、微丸),埋植剂以及膜剂等制【acharyas,sahoosk.plgananoparticlescontainingvariousanticanceragentsandtumourdeliverybyepreffect.advdrugdelivrev.2011,63(3):170-183.;chenyc,liudz,liujj,etal.developmentofterbinafinesolidlipidnanoparticlesasatopicaldeliverysystem.intjnanomedicine.2012,7:4409-4418.】。作为纳米药物载体plga具有以下优点:①由乳酸(la)和羟基乙酸(或称乙醇酸,ga)聚合而成,合成工艺成熟;②具有可控的粒径,纳米粒分散度小;③具有良好的生物降解性和生物相容性的、无免疫原性;plga共聚物在人体内最终的降解产物是二氧化碳(co2)和水(h2o),并且可以通过正常的生陈代谢排出体外,因此对人的身体没有刺激性和毒性。④能够实现药物的长时间缓释(数周或数月),降低了用药频率,提高患者顺应性;⑤经修饰后的plga纳米粒,适于包埋生物活性分子如蛋白、基因dna,疫苗等;⑥在plga表面修饰配基后,可实现药物的靶向递送【chohj,yoonis,yoonhy,etal.polyethyleneglycol-conjugatedhyaluronicacid-ceramideself-assemblednanoparticlesfortargeteddeliveryofdoxorubicin.biomaterials.2012,33(4):1190-1200.;collinsmnbirkinshawc.hyaluronicacidbasedscaffoldsfortissueengineering-areview.carbohydrpolym.2013,92(2):1262-1279.】。利用纳米载体peg-plga-peg包载丹参酮iia,可以改善丹参酮iia的亲水性、生物相容性、生物利用度低等问题。纳米粒表面的亲水性与亲脂性将影响吞噬细胞对其吞噬的快慢,因而要延长丹参酮iia在体内的血液循环半衰期需增加plga表面的亲水性。因plga嵌段结晶性较强,且有疏水性,所以极易被res清除,很难将药物到达靶向部位。而peg-plga-peg三嵌段共聚物具有亲水性,且生物相容性好,无毒性、抗原性和免疫原性,易溶于水和许多有机溶剂。通过与plga共聚合成peg-plga-peg,可以将peg和plga的优点结合起来,有效延缓res的清除,延长体循环时间。 技术实现要素: 针对上述丹参酮iia传统制剂的技术问题,本发明的目的在于提供一种包载丹参酮iiapeg-plga-peg纳米粒的制备方法,该方法过程简单,重现性好。利用这种方法制备的丹参酮iiapeg-plga-peg纳米粒,大小均一、具有明显的球状结构、稳定性好,载药量和包封率均较高,分散性好,丹参酮iia载药纳米粒在体内的循环半衰期明显延长,不易被res清除。 本发明提供一种包载丹参酮iiapeg-plga-peg纳米粒:是用三嵌段共聚物peg-plga-peg包载亲脂性药物丹参酮iia,经过冷冻干燥后,得到性质稳定、大小均一,加水复溶后溶解性好的载药纳米粒。 所述的三嵌段共聚物peg-plga-peg纳米载体材料,其分子量为10000~60000;其中,plga的含量为40%~96%,分子量为2000~30000,合成plga过程中乙交酯与丙交酯的比例为1/100~99/100;其中peg的含量为4%~60%,分子量为1000~5000。 所述的丹参酮iia的质量分数为80%~98%;乳化剂的类型为:吐温80、聚乙烯醇(pva)、泊洛沙姆188、大豆磷脂或卵磷脂其中的一种或几种的混合物,在内水相和外水相中的质量分数为0.1%~10%;所述的纳米粒径的范围为100~400nm,纳米粒中丹参酮iia的载药量10%~35%,包封率50%~90%。 一种包载丹参酮iiapeg-plga-peg纳米粒的制备方法,工艺如下: (1)将丹参酮iia和peg-plga-peg溶解在混合有机溶剂中作为油相,将乳化剂溶于去离子水作为内水相; (2)在冰水浴搅拌的条件下,用注射器吸取步骤(1)中的内水相缓慢滴加到有机相中,超声形成初乳; (3)将乳化剂溶于去离子水中作为外水相(外水相和内水相中所用的乳化剂为同一种乳化剂),在冰水浴搅拌的条件下,用注射器吸取步骤(2)中的初乳,深入外水相的液面下,缓慢滴加超声震荡形成复乳; (4)采用搅拌的方式除去复乳中的有机溶剂,将纳米混悬溶液高速离心,用去离子水反复清洗超声分散,用微孔滤膜过滤后冷冻干燥,即可获得负载丹参iia的peg-plga-peg纳米粒。 步骤(1)中加入处方剂量的丹参酮iia的量为1mg/ml~20mg/ml,所用的混合有机溶剂为二氯甲烷、三氯甲烷、丙酮、乙酸乙酯,无水乙醇中任意两种混合,混合的比例为1:1~1:20,加入的peg-plga-peg的量为0.5mg/ml~50mg/ml。 步骤(3)中初乳与外水相的比例为1:1~1:30,滴加的速度为10~30滴/每分钟,搅拌的速度为100r/min~700r/min。 所述的一种包载丹参酮iiapeg-plga-peg纳米粒的制备方法中,超声的功率为100w~500w,超声的方式为超声2s~60s间歇10s~30s,连续超声5~40min。 所述的一种包载丹参酮iiapeg-plga-peg纳米粒的制备方法中,搅拌挥发有机溶剂的时间为4~6h,所用高速离心的转速为10000r/min~16000r/min,离心时间为20min~60min。 本发明的优点是: 1.本发明制备的包载丹参酮iia,采用的载体材料二嵌段共聚物peg-plga-peg,是一种毒性低、成本低、生物降解性较好的高分子材料,共聚物中的plga在人体内降解时,降解产物可参与新陈代谢,并最终形成二氧化碳(co2)和水(h2o),不会在体内聚集。因此,生物相容性好,无免疫原性,安全性高; 2.载体材料中plga中羟基乙酸(ga)和乳酸(la)的比例为1/100~99/100,降解能力达到最佳能够缓慢降解,控制药物缓慢释放,能充分发挥丹参酮iia的药理作用;peg亲水基团能够减少血液对纳米粒的调理作用,从而延长药物的血液半衰期;且不使用辅助溶剂,可以避免对其他正常组织器官产生副作用,给药方便,增加患者适应性; 3.peg-plga-peg为两亲性聚合物,其组成的纳米粒经过冷冻干燥后可以有效的溶于水溶液,其内部疏水性区域可以为丹参酮iia提供空间,提高丹参酮iia的溶解性,改变其在体内的分布,提高生物利用度。 附图说明 图1为实施例1制备得到的丹参酮iiapeg-plga-peg纳米粒扫描电镜图。 图2为实施例1制备得到的丹参酮iiapeg-plga-peg纳米粒粒度分布图。 图3为丹参酮iia的高效液相色谱图。 图4为实施例1制备得到的丹参酮iiapeg-plga-peg纳米粒体外释放曲线。 图5为实施例1制备得到的丹参酮iiapeg-plga-peg纳米粒组和临床丹参酮iia注射剂组的血药浓度-时间曲线。 具体实施方式 以下结合实施例对本发明作进一步说明,但本发明并不局限于这些实施例。 实施例1包载丹参酮iiapeg-plga-peg纳米粒的制备 (1)将2mg丹参酮iia和30mgpeg-plga-peg超声溶解在2ml丙酮和二氯甲烷(丙酮:二氯甲烷=1:9)的混合溶剂中作为油相,配制质量分数为0.5%的泊洛沙姆f188溶液作为水相; (2)在冰水浴搅拌的条件下,用注射器吸取步骤(1)中的内水相30μl以10~30滴/每分钟速度滴加到有机相中,超声5s间歇5s,连续超声10min形成初乳; (3)在冰水浴搅拌的条件下,用注射器吸取步骤(2)中的初乳,采用液面下滴加的方式,以10~30滴/每分钟速度滴加到20ml0.5%泊洛沙姆f188溶液中(初乳复乳比为1:10),超声5s间歇5s,连续超声20min形成复乳; (4)室温下搅拌5h,除去复乳中的有机溶剂,15000r/min高速离心30min,倒掉上清液,用去离子水反复清洗超声分散即可获得载丹参酮的纳米混悬溶液,用0.22μm微孔滤膜过滤除去未包裹的药物,冷冻干燥,即可获得负载丹参酮iia的peg-plga-peg纳米粒,测得纳米粒的平均粒径为158nm,包封率为90%,载药量为35%。 实施例2包载丹参酮iiapeg-plga-peg纳米粒的制备 (1)将4mg丹参酮iia和30mgpeg-plga-peg超声溶解在2ml丙酮和二氯甲烷(丙酮:二氯甲烷=1:8)的混合溶剂中作为油相,配制质量分数为0.5%的吐温-80溶液作为水相; (2)在冰水浴搅拌的条件下,用注射器吸取步骤(1)中的内水相30μl以10~30滴/每分钟速度滴加到有机相中,超声5s间歇5s,连续超声10min形成初乳; (3)在冰水浴搅拌的条件下,用注射器吸取步骤(2)中的初乳,采用液面下滴加的方式,以10~30滴/每分钟速度滴加到20ml0.5%吐温-80溶液中,超声5s间歇5s,连续超声20min形成复乳; (4)室温下搅拌5h,除去复乳中的有机溶剂,15000r/min高速离心30min,倒掉上清液,用去离子水反复清洗超声分散即可获得载丹参酮的纳米混悬溶液,用0.22μm微孔滤膜过滤除去未包裹的药物,冷冻干燥,即可获得负载丹参酮iia的peg-plga-peg纳米粒。测得平均粒径为180nm,载药量为27%,包封率为81%。 实施例3包载丹参酮iiapeg-plga-peg纳米粒的制备 (1)将8mg丹参酮iia和30mgpeg-plga-peg超声溶解在2ml丙酮和二氯甲烷(丙酮:二氯甲烷=1:8)的混合溶剂中作为油相,配制质量分数为0.5%的pva溶液作为内水相; (2)在冰水浴搅拌的条件下,用注射器吸取步骤(1)中30μl的内水相以10~30滴/每分钟速度滴加到有机相中,超声5s间歇5s,连续超声10min形成初乳; (3)在冰水浴搅拌的条件下,用注射器吸取步骤(2)中的初乳,采用液面下滴加的方式,以10~30滴/每分钟速度滴加到20ml0.5%pva溶液中(初乳复乳比为1:10),超声5s间歇5s,连续超声20min形成复乳; (4)室温下搅拌5h,除去复乳中的有机溶剂,15000r/min高速离心30min,倒掉上清液,用去离子水反复清洗超声分散即可获得载丹参酮的纳米混悬溶液,用0.22μm微孔滤膜过滤除去未包裹的药物,冷冻干燥,即可获得负载丹参酮iia的peg-plga-peg纳米粒,测得纳米粒的平均粒径为210nm,载药量为17%,包封率为74%。 实施例4包载丹参酮iiapeg-plga-peg纳米粒的制备 (1)将8mg丹参酮iia和40mgpeg-plga-peg超声溶解在2ml乙酸乙酯和二氯甲烷(乙酸乙酯:二氯甲烷=1:8)的混合溶剂中作为油相,配制质量分数为1%的pva溶液作为水相; (2)在冰水浴搅拌的条件下,用注射器吸取步骤(1)中的内水相30μl以10~30滴/每分钟速度滴加到有机相中,超声5s间歇5s,连续超声10min形成初乳; (3)在冰水浴搅拌的条件下,用注射器吸取步骤(2)中的初乳,采用液面下滴加的方式,以10~30滴/每分钟速度滴加到30ml%的pva溶液中(初乳复乳比为1:20),超声5s间歇5s,连续超声20min形成复乳; (4)室温下搅拌5h,除去复乳中的有机溶剂,15000r/min高速离心30min,倒掉上清液,用去离子水反复清洗超声分散即可获得载丹参酮的纳米混悬溶液,用0.45um微孔滤膜过滤除去未包裹的药物,冷冻干燥,即可获得负载丹参酮iia的peg-plga-peg纳米粒,测得纳米粒的平均粒径为240nm,载药量为12%,包封率为61%。 实施例5包载丹参酮iiapeg-plga-peg纳米粒的制备 (1)将2mg丹参酮iia和20mgpeg-plga-peg超声溶解在2ml无水乙醇和二氯甲烷(无水乙醇:二氯甲烷=1:10)的混合溶剂中作为油相,配制质量分数为1.0%的吐温-80溶液作为水相; (2)在冰水浴搅拌的条件下,用注射器吸取步骤(1)中的内水相30μl以10~30滴/每分钟速度滴加到有机相中,超声5s间歇5s,连续超声10min形成初乳; (3)在冰水浴搅拌的条件下,用注射器吸取步骤(2)中的初乳,采用液面下滴加的方式,以10~30滴/每分钟速度滴加到1.0%的吐温-80溶液中(初乳复乳比为1:5),超声5s间歇5s,连续超声20min形成复乳; (4)室温下搅拌5h,除去复乳中的有机溶剂,15000r/min高速离心30min,倒掉上清液,用去离子水反复清洗超声分散即可获得载丹参酮的纳米混悬溶液,用0.22μm微孔滤膜过滤除去未包裹的药物,冷冻干燥,即可获得负载丹参酮iia的peg-plga-peg纳米粒将,测得纳米粒的平均粒径为196nm,载药量为20%,包封率为71%。 实施例6包载丹参酮iiapeg-plga-peg纳米粒的制备 (1)将10mg丹参酮iia和60mgpeg-plga-peg超声溶解在2ml丙酮和二氯甲烷(丙酮:二氯甲烷=1:5)的混合溶剂中作为油相,配制质量分数为1.5%的吐温-80溶液作为水相; (2)在冰水浴搅拌的条件下,用注射器吸取步骤(1)中的内水相30μl以10~30滴/每分钟速度滴加到有机相中,超声5s间歇5s,连续超声10min形成初乳; (3)在冰水浴搅拌的条件下,用注射器吸取步骤(2)中的初乳,采用液面下滴加的方式,以10~30滴/每分钟速度滴加到40ml1.5%的吐温-80溶液中(初乳复乳比为1:20),超声5s间歇5s,连续超声20min形成复乳; (4)室温下搅拌5h,除去复乳中的有机溶剂,15000r/min高速离心30min,倒掉上清液,用去离子水反复清洗超声分散即可获得载丹参酮的纳米混悬溶液,用0.22μm微孔滤膜过滤除去未包裹的药物,冷冻干燥,即可获得负载丹参酮iia的peg-plga-peg纳米粒将,测得平均粒径为260nm,载药量为10%,包封率为53%。 实施例7丹参酮iiapeg-plga-peg纳米粒的载药量及包封率的测定 采用高效液相色谱测定丹参酮iia的含量:色谱柱:watersc18色谱柱(250mm×4.6mm,5μm),流动相:甲醇:水=75:25(v/v)柱温:25℃流速:1.0ml/min紫外检测波长:268~270nm,进样量:20μl; 分别取浓度为1、5、10.0、25.0、50、80、100μg/ml的丹参酮iia标准品溶液,按照色谱条件进行测试,以峰面积对丹参酮iia浓度进行拟合,建立回归方程。精密称取冻干好的2mg丹参酮iiapeg-plga-peg纳米粒,置于10ml容量瓶中,用甲醇稀释后摇匀定容。0.22μm微孔滤膜过滤后,进样3次每次20μl。用hplc检测,测定峰面积,根据标准曲线回归方程,计算丹参酮iia的含量。根据以下公式,可以求得载药量和包封率(丹参酮iia高效液相色谱图如图3所示),包封率%=(纳米载体中所含的药量/投入的总药量)×100%,载药量%=(纳米载体中所含的药量/投入的总药量)×100%。 实施例8:丹参酮iiapeg-plga-peg纳米粒外观形态、zate电位、粒径大小和分布的测定。 实施例9:使用扫描电子显微镜观察纳米粒(实施例2制备)的外观形态,如图1所示,采用激光粒度分析仪可测定纳米粒的粒径分布及zeta电位,如图2所示。 实施例10丹参酮iiapeg-plga-peg纳米粒体外释药的测定。 精密称量丹参酮iia原料药和冷冻干燥后的丹参酮iiapeg-plga-peg纳米粒各8mg,分别置于5ml0.01mol/l的ph=7.4pbs缓冲液中,再放入50ml的离心管,立即置于37±1℃恒温水浴摇床中,100r/min匀速搅拌,并保持漏槽条件。分别于0、15min、30min、1h、2h、4h、8h、12h、24h、48h、72h规定的时间点取样1ml,同时补充等量等温的新鲜介质。样品经15000r/min离心25min后,取出上清液用0.22μm微孔滤膜过滤后,加一倍量的甲醇稀释后进样20μl,记录峰面积,代入标准曲线,计算溶液中丹参酮iia的浓度液,计算规定时间内的药物累计释放率。每个样品平行操作3份,以累积释放率的平均值对时间绘制体外累计释放曲线(如图4所示)。 实施例11:丹参酮iiapeg-plga-peg纳米粒大鼠体内药动学性质考察。 使用健康雄性sd大鼠,随机分为两组(n=10),每组5只,空白丹参酮iia(10mg/kg)混悬在羧甲基纤维素钠溶液中,peg-plga-peg纳米粒(含有tiia10mg/kg,实施例1制备)分散于生理盐水中,分别通过尾静脉注射,分别于给药后(0,5,15,30和45分钟;1,2,4,6,8,12、24和36小时),通过尾静脉收集血样(0.5ml),4000r/min离心l0min,取上清(血清)200μl,加入500μl甲醇,涡旋3min,7000r/min离心l0min,取上清液过0.22μm微孔滤膜,使用高效液相法测定滤液中丹参酮iia的浓度,计算血液中丹参酮iia的浓度,绘制peg-plga-peg纳米粒组和临床丹参酮iia注射剂组血药浓度一时间曲线(如图5所示)。 |
【本文地址】