| 一种玉米整株TRV载体介导病毒诱导基因沉默方法与流程 | 您所在的位置:网站首页 › pds基因检测 › 一种玉米整株TRV载体介导病毒诱导基因沉默方法与流程 |
一种玉米整株TRV载体介导病毒诱导基因沉默方法与流程
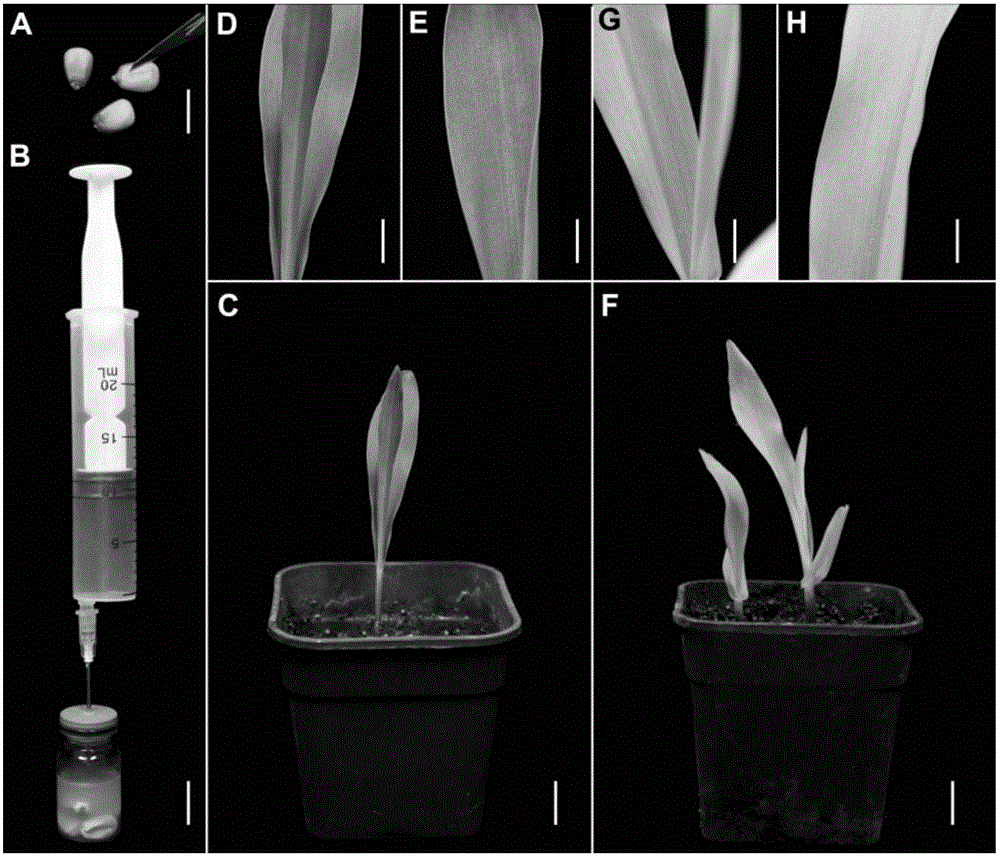 本发明属于植物基因工程技术领域,具体涉及一种玉米整株TRV载体介导病毒诱导基因沉默方法。 背景介绍 植物突变体很难获得,有些基因的突变对植物可能是致死的,基因沉默相对容易获得,病毒诱导的基因沉默(Virus-induced gene silencing,VIGS)是一种转录后基因沉默技术,作为一种有效的反向遗传学技术已经广泛应用于植物基因工程的研究中,其作用原理是植物在抵御病毒侵染时会启动RNA沉默(RNA silencing)机制。植物体内的Dicer-like protein4可以识别病毒复制过程中产生dsRNA,并将其切割成21-24nt的siRNAs(small interferingRNAs),siRNAs中的一条链与Agronatue(AGO)等蛋白结合形成RNA诱导的沉默复合体(RNA induced silencing complex,RISC),并特异的与同源的靶标mRNA结合最终导致靶标mRNA的降解,这一过程即病毒诱导的基因沉默。同样的,如果将寄主植物基因的片段克隆岛病毒VIGS载体中,当寄主植物通过RNA沉默引起防御反应时,相应的寄主基因也会被沉默。 一系列改造过的RNA或DNA病毒载体被用于VIGS(Becker and Lange,2010)。烟草脆裂病毒(Tobacco rattle virus,TRV)是一类应用比较广泛而且效率和持久性较好的病毒载体,能够介导基因沉默同时不会带来病毒诱导的症状。改造后的病毒能够促进非病毒序列的插入以及对植物的后续感染,也可以鉴定宿主植物生长点的基因,因此TRV在植物基因功能鉴定中具有广泛的应用。 玉米(学名:Zea mays),亦称玉蜀黍、包谷、苞米、棒子。粤语称为粟米,闽南语称作番麦。是一年生禾本科草本植物,是重要的粮食作物和重要的饲料来源,也是全世界总产量最高的粮食作物。玉米也是我国重要的粮食作物,玉米基因组测序的初步完成为玉米功能基因组学的研究提供了重要的参考(Schnable et al.,2009)。但是玉米基因组复杂,突变体不易获得,遗传转化困难,受基因型限制等这些对玉米基因功能的研究带来了诸多不便。 技术实现要素: 为了解决上述问题,本发明提供一种快速方便的玉米整株TRV载体介导病毒诱导基因沉默方法及应用,能够快速高效的在整个玉米植株中沉默目的基因。 一种玉米整株TRV载体介导病毒诱导基因沉默的方法,具体步骤如下: 步骤(1):取玉米种子50粒,用刀片将胚上方的种皮划开;用有效氯为1%的次氯酸 钠消毒液进行种子消毒,备用; 步骤(2):用基因工程的方法将扩增后的番茄八氢番茄红素脱氢酶(下称:番茄PDS)基因片段连接到TRV病毒诱导基因沉默载体pTRV2中,得到pTRV-SlPDS; 具体步骤如下: cDNA合成:按TaKaRa提取试剂盒操作说明提取番茄的总RNA,以1μg的总RNA做模板,按照TaKaRacDNA合成试剂盒操作说明合成cDNA的第一链,然后稀释10倍备用; PDS基因扩增:设计引物,上游引物5’-CGGGGTACCGGCACTCAACTTTATAAACC-3’和下游引物5’-CGGGGATCCTTCAGTTTTCTGTCAAACC-3’,以番茄的cDNA第一链为模板、用KAPA HiFi PCR Kits的50μL体系进行扩增;扩增程序为95℃预变性3min;30个循环的98℃变性20s,60℃退火20s,72℃延伸30s;72℃后延伸5min,4℃保存;PCR产物经电泳检测为单一条带,纯化后备用;番茄的cDNA经PCR扩增后的产物为409-bp番茄PDS基因片段; pTRV-SlPDS质粒构建:纯化后的PCR基因片段经KpnI-BamHI双酶切后,与经KpnI-BamHI双酶切的pTRV2质粒用T4-DNA连接酶连接,连接产物转化到大肠杆菌DH5α感受态细胞,涂布于含有50mg/L Kan抗生素的LB平板培养基,37℃倒置过夜培养,长出单克隆,挑取单克隆至含有50mg/LKan抗生素的液体LB培养基中,37℃,250转每分钟震荡培养12小时,提取质粒,验证正确后,备用; 步骤(3)农杆菌转化及培养: 3.1)将验证正确的pTRV-SlPDS、pTRV2以及pTRV1质粒分别用液氮冻融法转化到农杆菌GV3101感受态细胞中,所述的液氮冻融法具体方法为:取农杆菌GV3101感受态细胞,冰上融化,加入200纳克待转质粒,冰浴30分钟,液氮速冻2分钟,37℃水浴锅水浴2分钟,冰浴2分钟,加入800微升无抗LB液体培养基,28℃180转每分钟震荡培养3小时,涂布于含有50mg/L Kna和50mg/L Rif抗生素的固体LB培养基上,28℃倒置避光培养3天长出单克隆;挑取单克隆于含有50mg/L Kan和50mg/L Rif抗生素的液体LB培养基中,28℃200转每分钟震荡培养24小时,经菌液PCR鉴定合格后,得到含有质粒pTRV1、pTRV2和pTRV-SlPDS农杆菌GV3101阳性菌株,记为TRV1、TRV2和TRV-SlPDS,保菌备用; 3.2)将含有TRV1、TRV2、TRV-SlPDS质粒的农杆菌GV3101菌液,分别在含有抗生素的LB平板培养基上划线,28℃倒置避光培养3天长出单克隆; 3.3)分别挑取3.2)中的单克隆放于含有抗生素的LB液体培养基中,用离心管在28℃、200转/min条件下,震荡培养24小时,以实现单克隆的增殖; 3.4)将3.3)得到的TRV1与TRV2单克隆培养液以1:1混合,TRV1与TRV-SlPDS单克隆培养液以1:1混合,分别按1:100转接到相同的LB培养基上,在三角瓶中继续培养到菌液的O.D.600=0.04-1.5,并调整两个三角瓶中的菌液的O.D.600值相同; 步骤(4)配制转化菌液: 向步骤(3)所得的菌液中加入乙酰丁香酮(AS)终浓度为19.62mg·L-1、半胱氨酸(Cys)终浓度为400mg·L-1和吐温20(Tween 20)终浓度为5ml·L-1,均匀混合得到含TRV1与TRV2的转化菌液和含TRV1与TRV-SlPDS的转化菌液,放置于超净工作台中备用; 步骤(5)玉米种子侵染:将等量的处理过的玉米分别放入带橡胶塞的10ml玻璃瓶中,记为玻璃瓶1和2,玻璃瓶1中加入5ml含TRV1与TRV2的转化菌液,玻璃瓶2中加入5ml含TRV1与TRV-SlPDS的转化菌液,使种子完全浸泡在转化菌液中;用20ml注射器对玻璃瓶抽真空,每次保持15s,操作1~4次;最后,分别将玻璃瓶1、玻璃瓶2中的玉米种子和转化菌液倒入步骤(4)相应的剩余转化菌液中,在28℃、200转每分钟下过夜培养0-25小时; 培养结束,超净台中用无菌水清洗干净,将经TRV1与TRV2以1:1混合侵染过的玉米和经TRV1与TRV-SlPDS以1:1混合侵染过的玉米清洗干净,分别转接到相同的固体MS培养基上,培养条件为:19-22℃,光照强度为150μmol·m-2·s-1,光周期为16小时光照/8小时黑暗,相对湿度为55%,培养至长出叶片,移栽至土壤中继续生长两周后观察表型,提取DNA采用TRV壳蛋白基因检测番茄PDS病毒的扩增情况,提取RNA使用半定量RT-PCR方法检测被沉默玉米中PDS基因转录本的沉默效果。 进一步,步骤(3)中,100ml三角瓶中培养的菌液的OD600的最优值是0.3. 进一步,步骤(4)中,采用乙酰丁香酮、半胱氨酸和吐温20的混合液培养效果最佳,混合液中,乙酰丁香酮,终浓度为19.62mg·L-1;半胱氨酸,终浓度为400mg·L-1,;吐温20,终浓度为5ml·L-1。 进一步,步骤(5)中,带橡胶塞的10ml玻璃瓶中,同时加入转化菌液5ml,是种子完全浸泡在转化菌液中;用20ml注射器抽真空,每次保持15秒,操作4次,效果最佳。 进一步,步骤(5)中,所述的分别将玻璃瓶1、玻璃瓶2中的玉米种子和转化菌液倒入步骤(4)相应的剩余转化菌液中,在28℃、200转每分钟下过夜培养15小时,侵染效果最佳。 与现有技术相比较,本发明具有以下技术创新点: (1)玉米基因组复杂,突变体不易获得,遗传转化困难且受基因型限制,本发明首创利用利用TRV、采用番茄PDS病毒基因对玉米种子进行病毒载体的侵染,进而实现玉米PDS基因沉默,本发明方法简便、快捷、高效、低成本、不需要基因转化,且本发明为全株沉默,效率高,方便研究目的基因在各个组织中功能。 (2)本发明首创对玉米种子进行负压辅助侵染的方法,该法方便快捷、侵染效果好。 附图说明 图1玉米PDS基因ZmPDS和番茄PDS基因SlPDS片段相似度比对结果; 图2 TRV介导的番茄PDS基因沉默的玉米植株萌发16天的表型; 图3半定量检测沉默玉米植株中PDS基因表达水平; 图4不同参数下TRV诱导玉米基因沉默效果。 具体实施方式 下面通过实例对本发明作进一步阐述,其目的在于更好理解本发明内容而非限制本发明的保护范围。 实施例沉默玉米PDS基因 一种玉米整株TRV载体介导病毒诱导基因沉默的方法: 原料来源:玉米品种为郑单958 KpnI-BamHI,购自NEB公司; T4-DNA连接酶,购自NEB公司; VIGS实验所用沉默载体为烟草脆裂病毒(TRV)的RNA1和RNA2cDNA的双元表达载体,分别为TRV1和TRV2由剑桥大学David Baulcombe教授和清华大学刘玉乐教授馈赠。pTRV1载体包括编码RNA依赖的RNA聚合酶、运动蛋白和16kD蛋白的基因,是VIGS体系的辅助病毒载体。pTRV2载体包括衣壳蛋白(Cp)基因、多克隆位点(MCS)等,用于目的基因的构建。 具体步骤如下: 步骤(1):取玉米种子50粒,用刀片将胚上方的种皮划开;用有效氯为1%的次氯酸钠消毒液进行种子消毒,备用; 步骤(2):用基因工程的方法将扩增后的番茄八氢番茄红素脱氢酶(下称:番茄PDS)基因片段连接到TRV病毒诱导基因沉默载体pTRV2中,得到pTRV-SlPDS; 具体步骤如下: cDNA合成:按TaKaRa提取试剂盒操作说明提取番茄的总RNA,以1μg的总RNA做模板,按照TaKaRacDNA合成试剂盒操作说明合成cDNA的第一链,然后稀释10倍备用; PDS基因扩增:设计引物,上游引物5’-CGGGGTACCGGCACTCAACTTTATAAACC-3’和下游引物5’-CGGGGATCCTTCAGTTTTCTGTCAAACC-3’,以番茄的cDNA第一链为模板、用KAPA HiFi PCR Kits的50μL体系进行扩增;扩增程序为95℃预变性3min;30个循环的98℃变性20s,60℃退火20s,72℃延伸30s;72℃后延伸5min,4℃保存;PCR产物经电泳检测为单一条带,纯化后备用;番茄PDS经PCR扩增后的产物为409-bp番茄PDS基因片段;番茄PDS经PCR扩增后所得的番茄PDS基因片段与玉米PDS基因ZmPDS的相似度为78.24%,详见图1; pTRV-SlPDS质粒构建:纯化后的PCR基因片段经KpnI-BamHI双酶切后,与经KpnI-BamHI双酶切的pTRV2质粒用T4-DNA连接酶连接,连接产物转化到大肠杆菌DH5α感受态细胞,涂布于含有50mg/L Kan抗生素的LB平板培养基,37℃倒置过夜培养,长出单克隆,挑取单克隆至含有50mg/LKan抗生素的液体LB培养基中,37℃,250转每分钟震荡培养12小时,提取质粒,验证正确后,备用; 步骤(3)农杆菌转化及培养: 3.1)将验证正确的pTRV-SlPDS、pTRV2以及pTRV1质粒分别用液氮冻融法转化到农杆菌GV3101感受态细胞中,所述的液氮冻融法具体方法为:取农杆菌GV3101感受态细胞,冰上融化,加入200纳克待转质粒,冰浴30分钟,液氮速冻2分钟,37℃水浴锅水浴2分钟,冰浴2分钟,加入800微升无抗LB液体培养基,28℃180转每分钟震荡培养3小时,涂布于含有50mg/L Kna和50mg/L Rif抗生素的固体LB培养基上,28℃倒置避光培养3天长出单克隆;挑取单克隆于含有50mg/L Kan和50mg/L Rif抗生素的液体LB培养基中,28℃200转每分钟震荡培养24小时,经菌液PCR鉴定合格后,得到含有质粒pTRV1、pTRV2和pTRV-SlPDS农杆菌GV3101阳性菌株,记为TRV1、TRV2和TRV-SlPDS,保菌备用; 3.2)将含有TRV1、TRV2、TRV-SlPDS质粒的农杆菌GV3101菌液,分别在含有抗生素的LB平板培养基上划线,28℃倒置避光培养3天长出单克隆; 3.3)分别挑取3.2)中的单克隆放于含有抗生素的LB液体培养基中,用离心管在28℃、200转/min条件下,震荡培养24小时,以实现单克隆的增殖; 3.4)将3.3)得到的TRV1与TRV2单克隆培养液以1:1混合,TRV1与TRV-SlPDS单克隆培养液以1:1混合,分别按1:100转接到相同的LB培养基上,在三角瓶中继续培养到菌液的O.D.600=0.04-1.5(OD600最优值是0.3,参见图4(C)),并调整两个三角瓶中的菌液的O.D.600值相同; 步骤(4)配制转化菌液: 向步骤(3)所得的菌液中加入乙酰丁香酮(AS)终浓度为19.62mg·L-1、半胱氨酸(Cys)终浓度为400mg·L-1和吐温20(Tween 20)终浓度为5ml·L-1,(采用乙酰丁香酮、半胱氨酸和吐温20的混合液培养效果最佳,图4表示不同参数下,TRV诱导基因沉默效果,图4A表示:不同组分侵染液对基因沉默效率的影响,结果显示:采用乙酰丁香酮、半胱氨酸和吐温20的混合液培养效果最佳,混合液中,乙酰丁香酮,终浓度为19.62mg·L-1;半胱氨酸,终浓度为400mg·L-1;吐温20,终浓度为5ml·L-1),均匀混合得到含TRV1与TRV2的转化菌液和含TRV1与TRV-SlPDS的转化菌液,放置于超净工作台中备用; 步骤(5)玉米种子侵染: 将等量的处理过的玉米分别放入带橡胶塞的10ml玻璃瓶中,记为玻璃瓶1和2,玻璃瓶1中加入5ml含TRV1与TRV2的转化菌液,玻璃瓶2中加入5ml含TRV1与TRV-SlPDS的转化菌液,使种子完全浸泡在转化菌液中;用20ml注射器对玻璃瓶抽真空,每次保持15s,操作1~4次(利用注射器抽真空能非常有效的辅助侵染,真空处理每次15s,四次即总时间60s沉默效率最高(参见图4(B));最后,分别将玻璃瓶1、玻璃瓶2中的玉米种子和转化菌液倒入步骤(4)相应的剩余转化菌液中,在28℃、200转每分钟下过夜培养0-25h(侵染效果最好的是和农杆菌共培养15小时,参见图4(D)); 培养结束,超净台中用无菌水清洗干净,将经TRV1与TRV2以1:1混合侵染过的玉米和经TRV1与TRV-SlPDS以1:1混合侵染过的玉米清洗干净,分别转接到相同的固体MS培养基上,培养条件为:19-22℃,光照强度为150μmol·m-2·s-1,光周期为16小时光照/8小时黑暗,相对湿度为55%,培养至长出叶片,移栽至土壤中继续生长两周后观察表型,提取DNA采用TRV壳蛋白基因检测番茄PDS病毒的扩增情况,提取RNA使用半定量RT-PCR方法检测被沉默玉米中PDS基因转录本的沉默效果。 结果分析: 1.对经TRV1与TRV2以1:1混合侵染过的玉米和经TRV1与TRV-SlPDS以1:1混合侵染过的玉米清洗干净,分别转接到相同的固体MS培养基上,培养条件为:19-22℃,光照强度为150μmol·m-2·s-1,光周期为16小时光照/8小时黑暗,相对湿度为55%,培养至长出叶片,移栽至土壤中继续生长两周后观察表型,结果如图2所示(图中,A.表示本实验使用的玉米种子,用手术刀划开种皮;B表示:真空辅助携带病毒质粒的农杆菌侵染玉米种子;C-E表示经TRV1与TRV2以1:1侵染的玉米种子萌发16天后的表型(作为对照组);F-H表示:经TRV1与TRV-SlPDS以1:1侵染后的玉米种子萌发16天后的表型;图中,标尺(A和B),1.41cm;(C,和F),1.27cm;(D,E,G和H),6.16mm;):经TRV1与TRV2以1:1混合侵染过的玉米种子,萌发16天后长势良好,叶子呈绿色或黄绿色,表示控制其叶绿素合成的基因未沉默;经TRV1与TRV-SlPDS 1:1混合侵染过的玉米种子,萌发16天后,叶子呈白色,产生光漂白现象,表示控制其叶绿素合成的PDS基因沉默;由此可知,玉米种子经TRV载体介导番茄PDS病毒基因侵染后,控制其叶绿素合成的PDS基因沉默。 3.按照TaKaRa提取试剂盒提取经TRV1与TRV2 1:1混合侵染过的玉米萌发16天的植株和经TRV1与TRV-SlPDS 1:1混合侵染过的玉米萌发16天的植株的总RNA。以1μg提的总RNA做模板,按照cDNA合成试剂盒(TaKaRa)操作说明合成第一链cDNA,然后稀释10倍备用。采用半定量RT-PCR方法检测沉默植株中PDS基因转录本的沉默效果。玉米Actin基因(登录号J01238)为内参基因,玉米PDS基因(登录号L39266)。半定量RT-PCR引物序列(ZmActin:5’-CAATGGCACTGGAATGGT-3’和5’-ATCTTCAGGCGAAACACG-3’,ZmPDS:5’-GCTTACCTGGCCCGAGAAGGTGAAGTTT-3’和5’-TTCAGTTTTCTGTCAAACC-3’)。PCR所用试剂为Taq酶预混液(2×Taq PCR StarMix with Loading Dye,购于北京康润科技有限公司),20μl体系,按照说明书配制,PCR反应条件:95℃预变性3min;28-36个循环的95℃变性30s,58℃退火30s,72℃延伸30s;72℃延伸5min,4℃保存;按照上述条件进行28、30、32、34和36个不同循环数的扩增,采用1%琼脂糖凝胶电泳检测PCR扩增产物。结果如图3所示:与内参基因相比较,经TRV1与TRV-SlPDS 1:1混合侵染过的玉米萌发16天的植株的根部和叶片中,玉米PDS基因的表达量显著降低。 结果分析1、结果分析2和结果分析3分别从植株表型和RNA水平两个角度证明了本申请提出的“一种玉米整株TRV载体介导病毒诱导基因沉默的方法”,能够实现对特定基因进行基因沉默。 |
【本文地址】