| Chem封面:把酶“关进”MOF的孔道里,它会做得更好 | 您所在的位置:网站首页 › nu化学 › Chem封面:把酶“关进”MOF的孔道里,它会做得更好 |
Chem封面:把酶“关进”MOF的孔道里,它会做得更好
|
Chem封面:把酶“关进”MOF的孔道里,它会做得更好
酶(enzyme)作为生物催化剂,优点非常鲜明,活性高、特异性好、反应条件温和;不过它们的缺点也一样鲜明,化学稳定性及热稳定性差、容易失活、分离纯化困难、成本高、普适性差。此前工业级的酶催化应用,大多不会直接使用分离纯化的酶,而是使用包含这些酶的细胞(包括基因工程菌或者动物细胞等),这就造成了极大的限制。无细胞生物合成技术是生物技术的一个新型领域,探索的正是如何在不使用活细胞的情况下基于酶和辅酶混合物的级联反应将底物转化为产物,这种技术更加开放,更简单,系统可以按需设计,可控制性也更好。不过,为酶找到合适的生物相容性载体,在保护酶不失活且保证酶可重复回收利用的同时,还能不损害酶的催化活性和选择性,却一直是个挑战。金属有机框架(MOF)作为发展迅速的高结晶性多孔材料,在诸多领域都有广泛应用。近来发现的一些水溶液中稳定的介孔MOF材料作为酶的载体,表现出了很高的负载率和优异的酶固定化效果。由于MOF材料结构可调,这使得它们很有希望成为无细胞酶反应体系的理想载体。 近日,美国西北大学的Omar K. Farha教授、Peng Li博士联合2016诺贝尔化学奖得主J. Fraser Stoddart教授等人报道了新的进展,他们利用NU-100x(x = 3, 4, 5, 6, 7)系列锆基MOF,通过调控其多级介孔孔道尺寸,实现无细胞条件下的酶的固定化负载。以乳酸脱氢酶(LDH)为例,负载在NU-100x大孔中的酶可以很好地接触烟酰胺腺嘌呤二核苷酸辅酶(NAD和NADH)与底物,可实现辅酶的原位再生,使得酶体系的活性比游离酶还要高。相关工作发表在Cell Press旗下的Chem 杂志上,并被选为封面文章,共同第一作者是Peng Li博士和Qishui Chen博士。
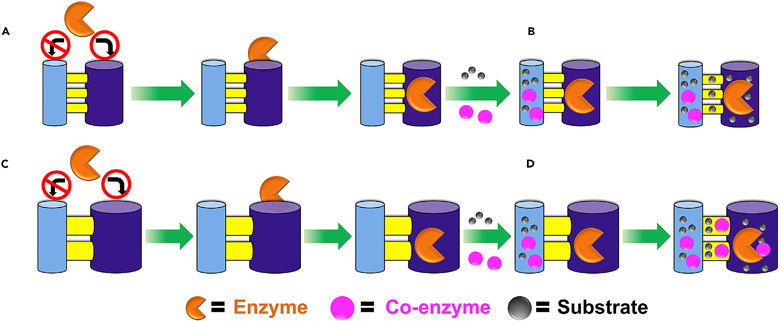
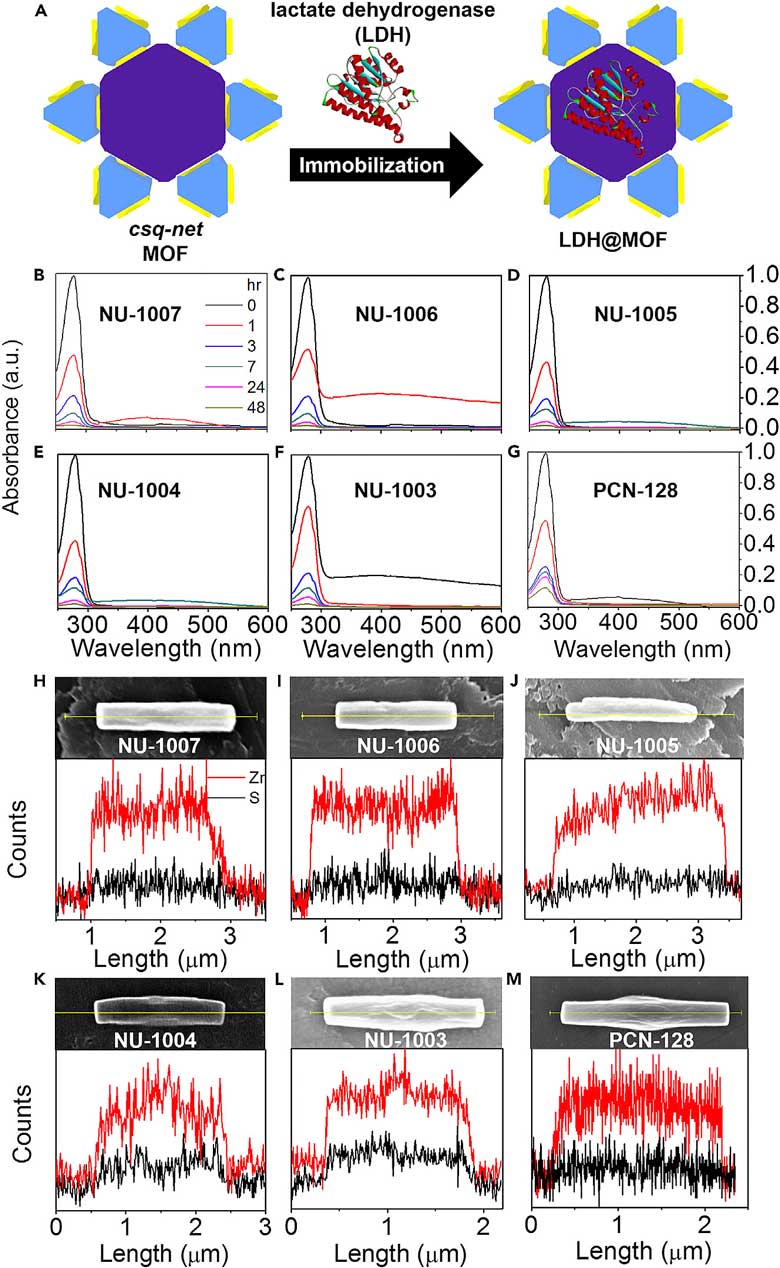
当期封面。图片来源:Chem 由于酶催化反应涉及酶、底物以及辅酶,因此研究者设想使用具有互连多级孔道系统的网状MOF材料作为酶的载体,而且孔道尺寸还需可调节。这样一来,多级孔道中的大孔道(下图紫色圆柱)可用于固定体积较大的酶,而小孔道(下图蓝色圆柱)及孔道间的桥连窗口(下图黄色部分)可以供体积较小的底物和辅酶分子扩散。而且,较大的孔道及桥连窗口尺寸,有助于底物与辅酶的扩散,也可为固定化酶与辅酶的相互识别留出足够的空间(下图C-D)。
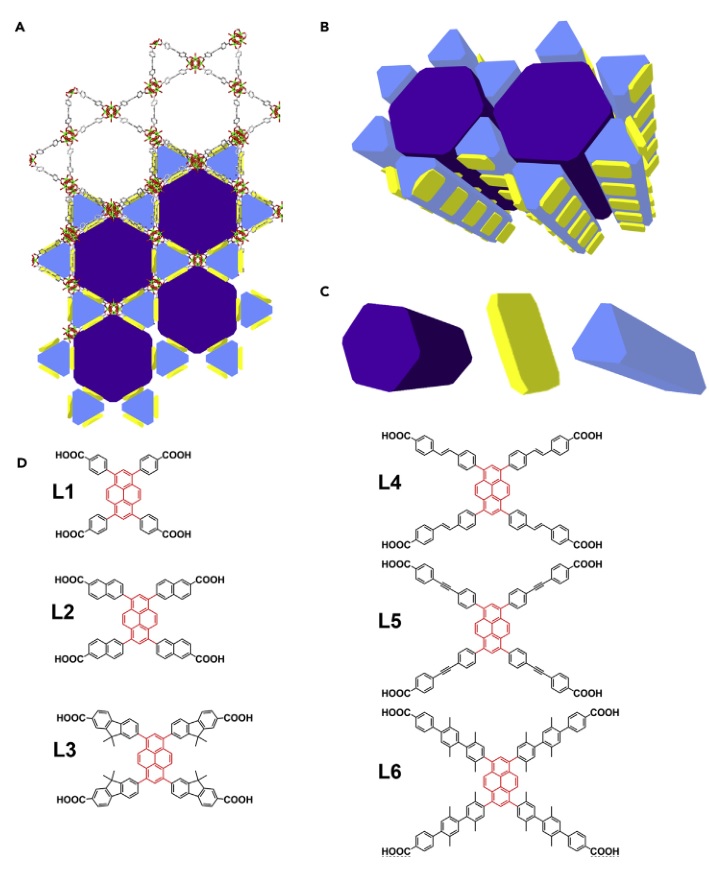
互连多级孔道系统负载酶催化反应示意图。图片来源:Chem 研究团队先前的研究结果表明,拥有优异酶负载能力的锆基MOF材料NU-1000具有互连多级孔道系统(Chem, 2016, 1, 154-169),其中包括较大的六边形孔道和较小的三角形孔道,二者通过开放窗口相连(下图A-C)。不过,NU-1000孔道尺寸较小,还有必要进行进一步的扩展。本文中,研究者精心设计了配体,合成了NU-100x(x = 3、4、5、6、7)系列锆基MOF。
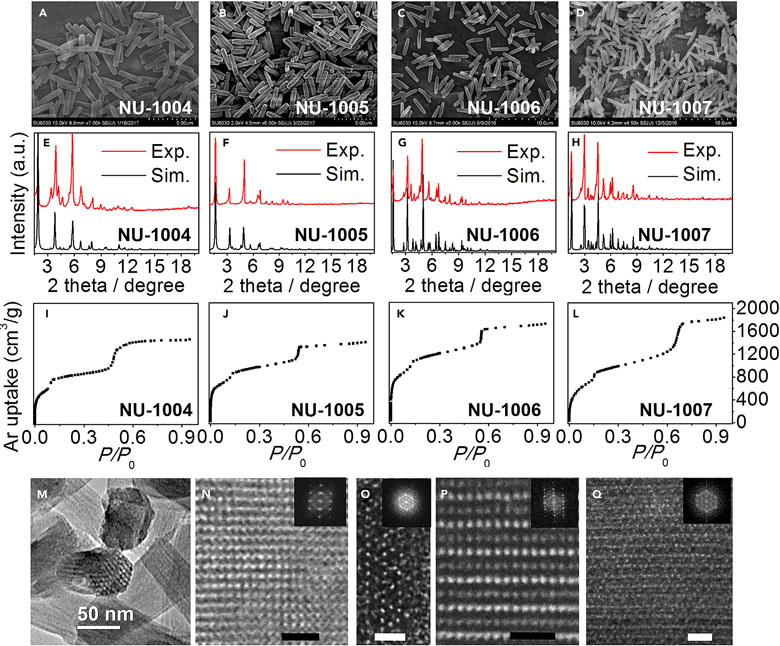
NU-1000结构(A-C)和配体结构:L1-L6分别对应NU-100x(x = 0、3、4、5、6、7)。图片来源:Chem 通过扫描电镜(SEM)、粉末X-射线衍射(PXRD)等手段研究者表征了所得的NU-1004、NU-1005、NU-1006和NU-1007材料。扫描电镜图像表明,NU-1004至NU-1007的宏观形貌与NU-1000一样,都是长条状(下图A-D)。通过与模拟的粉末X-射线衍射图比较,它们的图谱都吻合,并表现出高晶态(下图E-H)。NU-1004、NU-1005、NU-1006和NU-1007的氩气等温吸附逐渐升高(图3I-L)。
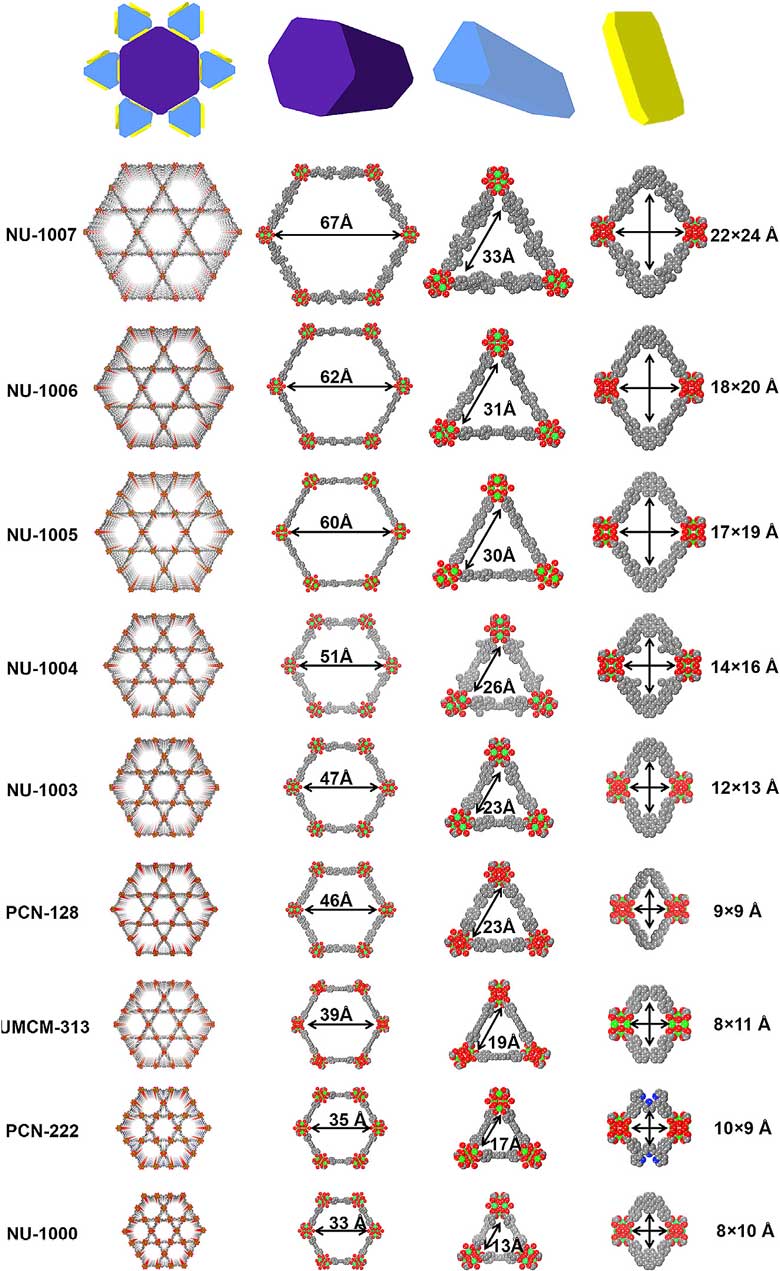
NU-100x系列的表征。(A-D)SEM图谱。(E-H)PXRD图。(I-L)氩气等温吸附图。(M-Q)扫描透射电镜图。图片来源:Chem 研究者接着用晶体堆积图来研究了NU-100x材料的孔道大小(下图)。NU-1000拥有33 Å的六边形孔道,13 Å的三角形孔道,以及8 × 10 Å的窗口。相比之下,NU-100x(x = 3、4、5、6、7),将六边形孔道、三角形孔道和窗口的尺寸分别扩展到47-67 Å、23-33 Å和13-24 Å。孔道尺寸的扩展,有利与吸附更大的酶,也有利于底物与辅酶的扩散以及酶与辅酶的识别。
NU-100x系列及其他MOF材料的晶体堆积图。图片来源:Chem 接着,研究者进一步使用NU-100x(x = 3、4、5、6、7)材料吸附乳酸脱氢酶(LDH),并进行了表征。将NU-100x晶体浸泡在酶溶液中,放置一段时间,通过UV-Vis光谱来检测上清液中残留的酶浓度(下图B-F),从而算出负载量。通过SEM以及能量色散X-射线光谱分析(EDX)结果可以清晰表征出锆元素和硫元素(下图H-L)。由于硫元素是乳酸脱氢酶的特征元素,这说明乳酸脱氢酶在MOF材料中均匀分布。
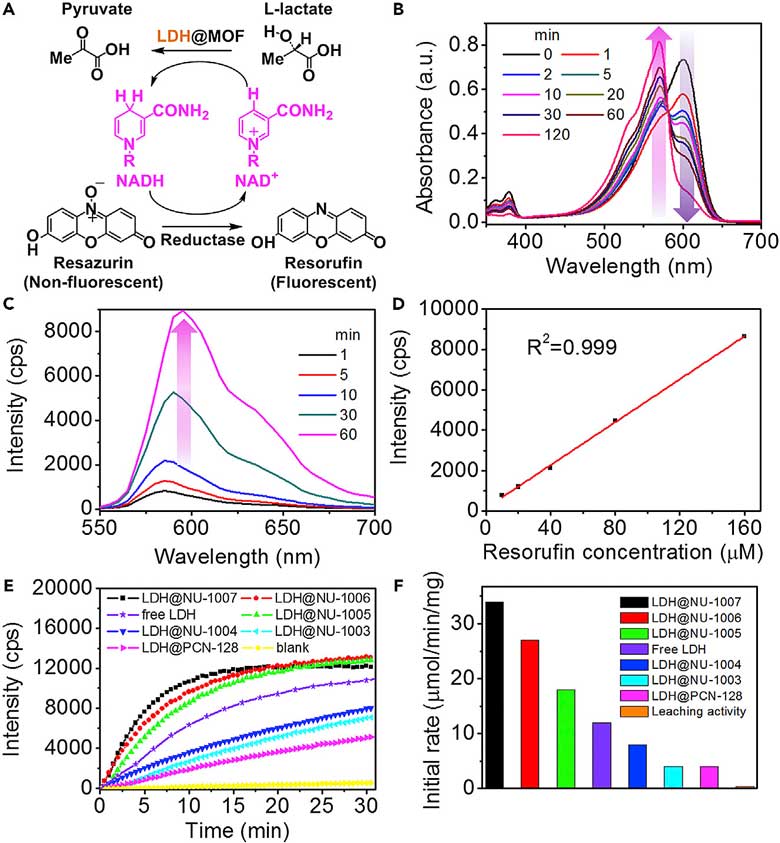
乳酸脱氢酶(LDH)的负载与表征。图片来源:Chem 研究者设计了一套催化系统来继续探究MOF负载酶的反应(下图A)。反应的上半部分中,L-乳酸被LDH@MOF催化脱氢生成丙酮酸酯,同时NAD+得到电子被还原成NADH;反应的下半部分中,NADH被氧化成NAD+,同时无荧光的刃天青(resazurin)被还原为强荧光的试卤灵(resorufin),从而监控反应。反应的UV-Vis光谱中(下图B),随着反应时间的推移,刃天青的特征峰(600 nm)逐渐消失,一个新的特征峰(试卤灵, 570 nm)出现,强度逐渐增强。荧光谱图也显示荧光逐渐加强(下图C),并且荧光强度和试卤灵浓度呈现吻合度很高的线性关系(下图D)。这些结果说明此套系统可以准确测试LDH的酶活性。研究者使用此套系统,测试了MOF负载酶以及无负载的游离酶的活性(下图E),结果表明酶的活性排序如下:LDH@NU-1007 > LDH@NU-1006 > LDH@NU-1005 > 游离LDH > LDH@NU-1004 > LDH@NU-1003 > LDH@PCN-128。NU-1005、NU-1006、NU-1007负载LDH酶的初始反应速度,甚至要明显高于无负载的游离LDH(下图F)。
MOF负载酶的活性研究。图片来源:Chem 总结 美国西北大学的研究者们通过调控互连多级介孔MOF——NU-100x系列来负载乳酸脱氢酶,并研究了孔道大小对酶活性影响,发现较大的孔道可带来较高的酶活性,甚至还可以超过非负载的游离酶。这一发现利用MOF材料为载体,实现了高效的无细胞酶催化生物合成,有望在未来用于生物燃料生产和生物质转化等领域。 原文(扫描或长按二维码,识别后直达原文页面,或点此查看原文):
Hierarchically Engineered Mesoporous Metal-Organic Frameworks toward Cell-free Immobilized Enzyme Systems Chem, 2018, 4, 1022−1034, DOI: 10.1016/j.chempr.2018.03.001 (本文由叶舞知秋供稿) 如果篇首注明了授权来源,任何转载需获得来源方的许可!如果篇首未特别注明出处,本文版权属于 X-MOL ( x-mol.com ), 未经许可,谢绝转载! 点击分享 收藏 取消收藏 评论: 0 |
【本文地址】